有氧运动抑制炎症反应改善ApoE-/-动脉粥样硬化小鼠心肌纤维化机制研究
2023-11-17秦芳马甜甜于子夫刘西花
秦芳,马甜甜,于子夫,刘西花
1.250355 山东省济南市,山东中医药大学康复医学院
2.250014 山东省济南市,山东中医药大学附属医院康复科
动脉粥样硬化(atherosclerosis,AS)是脑梗死、冠心病等多种心脑血管疾病的病理基础,其发病机制与脂质代谢、氧化应激及炎症反应之间复杂的相互作用有关[1]。研究表明,AS发展过程中存在心肌纤维化等心肌改变,进而使心肌适应能力下降,导致心室收缩和舒张功能异常,最终引发心力衰竭等严重心血管病[2]。因此抑制AS、限制心肌纤维化的进程对预防患者发生心力衰竭等心血管事件具有重要意义。心肌纤维化的发病机制复杂多样,受到多种因素的调节和控制,其中炎症反应和氧化应激是重要的发病机制[3]。长期AS导致缺血和缺氧的环境使炎症因子释放增多,激活转化生长因子β1(TGF-β1)信号通路,加速了促纤维化作用的TGF-β1的释放。同时,AS发生发展过程中,miR-132诱发细胞内活性氧(reactive oxygen species,ROS)的生成会影响心肌细胞的收缩机制,同时还介导巨噬细胞和成纤维细胞之间的相互作用,导致组织氧化应激损伤,此为心肌纤维化的关键因素[4-6]。
有规律的运动已被证明可以预防心血管疾病,改善心脏功能,缓解心肌纤维化,并加强防止心肌细胞损伤的机制[7-8]。既往研究表明,长期低强度的体育锻炼可以改善心力衰竭大鼠的心肌纤维化[9]。但是有氧运动改善AS心肌纤维化具体分子学机制的研究尚不全面,其改善机制是否与减轻炎症反应及发挥抗氧化作用有关目前研究较少。为此,本研究基于动物模型,探讨有氧运动改善AS心肌纤维化的作用以及对炎性因子的影响,旨在为有氧运动改善AS小鼠心肌纤维化的作用机制提供新的理论依据。
1 材料与方法
1.1 研究时间
2022年2—8月。
1.2 实验材料
1.2.1 实验动物 选取27只8周龄的雄性ApoE-/-小鼠(20~24 g)作为实验对象,购自中国科学院实验动物中心(中国上海),许可证号[SCXK(京)2019-0008]。所有小鼠适应性饲养1周,温度为(22±1)℃,湿度为45%~55%,光照/黑暗周期为12 h,自由饮水和饮食。本研究通过了山东中医药大学附属医院伦理委员会批准(AWE-2022-004)。
1.2.2 主要试剂与仪器 NOD受体3(NLRP3)抗体(沈阳万类生物科技有限公司,货号:WL02635);TGF-β1抗体(沈阳万类生物科技有限公司,货号:WL02193);白介素(IL)-1β抗体(沈阳万类生物科技有限公司,货号:WL00891);β-actin(沈阳万类生物科技有限公司,货号:WL01372);超氧化物歧化酶(SOD)测定试剂盒(沈阳万类生物科技有限公司,货号:WLA110);谷胱甘肽过氧化物酶(GSHPx)试剂盒(沈阳万类生物科技有限公司,货号:WLA107);BCA蛋白浓度测定试剂盒(沈阳万类生物科技有限公司,货号:WLA004);苏木素(北京索莱宝科技有限公司,货号:H8070);超速冷冻离心机(湖南湘仪实验室仪器开发有限公司,型号:H-2050R);显微镜(日本OLYMPUS公司,型号:BX53);石蜡切片机(德国Leica仪器有限公司,型号:RM2235)。
1.3 实验方法
1.3.1 实验分组:将小鼠随机分为对照组、模型组和有氧运动组,每组9只。
1.3.2 AS小鼠模型制备:模型组和有氧运动组小鼠饲以12周“西方类型”膳食饲料(21%脂肪,0.15%胆固醇)建立AS模型,对照组以普通饲料喂养12周。
1.3.3 运动训练方案:模型组和对照组小鼠不进行运动训练,有氧运动组小鼠在小动物跑台上进行递增运动强度及时间的耐力性运动,参考基因缺陷小鼠的运动量标准[10]。跑台坡度设置为0,前4周的运动量由10 m/min、30 min/d逐渐增加至13 m/min、60 min/d,剩余8周的运动量为13 m/min,60 min/d。运动5次/周,与建模同时进行,连续运动12周。
1.3.4 Masson染色:将心肌组织进行Masson染色,包埋、切片脱蜡至水,滴加苏木素染液、丽春红酸性品红液,使染液完全覆盖组织染浆。以0.2%冰醋酸水溶液浸洗片刻,再向每张切片组织上滴加1%磷钼酸水溶液分化。用苯胺蓝复染后脱水、透明、封片,于显微镜下观察染色效果,400×镜下拍照。
1.3.5 苏木素-伊红(HE)染色:石蜡切片脱蜡后用苏木素染色3~5 min,自来水洗净后进行分化处理,再次自来水洗后进行返蓝处理,之后再次流水冲洗,切片脱水后入伊红染液染色5 min。在显微镜下观察染色效果。
1.3.6 蛋白质印迹法(Western blotting)检测心肌组织NLRP3、IL-1β、TGF-β1:取小鼠新鲜心肌组织,以低温冷冻离心法提取蛋白,BCA法测定蛋白浓度,以RIPA裂解液调整蛋白样本终浓度为2mg/mL。配制5%浓缩胶和14%分离胶,每孔上样40 μg蛋白(20 μL),电泳2.5 h,转膜1.5 h,用5%的脱脂奶粉室温封闭1 h后,抗NLRP3(1∶500稀释)、抗IL-1β(1∶1 000稀释)、抗TGF-β1(1∶400稀释),室温孵育45 min,以肌动蛋白(β-actin)为内参,分析各电泳带灰度值。将胶片进行扫描,用Gel-Pro-Analyzer处理软件分析目标条带的光密度值。
1.3.7 试剂盒检测SOD和GSH-Px表达量:准确称取心肌组织重量,按重量(g)∶体积(mL)=1∶9加入0.9%氯化钠溶液,冰水浴条件下机械匀浆,2 500 r/min离心10 min,半径15 cm,取上清液按照试剂盒说明步骤测定SOD和GSH-Px表达量。
1.4 统计学方法
采用SPSS 19.0统计学软件进行数据分析,符合正态分布的计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 Masson染色
心肌内胶原纤维被苯胺蓝染成蓝色,肌纤维被酸性品红和丽春红染成红色。对照组心肌组织红润,蓝染面积小;模型组心肌组织纤维化较对照组明显加重;有氧运动组心肌组织纤维化较模型组明显改善,见图1。
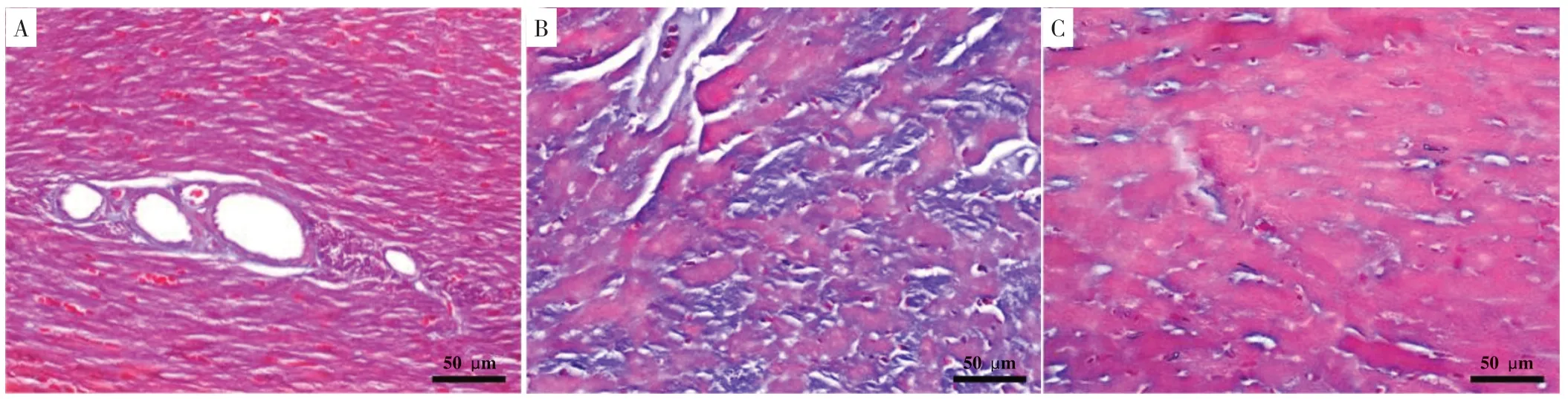
图1 心肌组织Masson染色结果(400×)Figure 1 Results of Masson staining of myocardial tissue
2.2 HE染色
HE染色结果显示,对照组小鼠心肌细胞排列整齐,细胞形态、大小、间隙正常,细胞核分布均匀;模型组小鼠心肌细胞排列较错乱,细胞形态、大小异常,细胞间隙增大,存在炎性细胞浸润;有氧运动组小鼠心肌细胞排列尚整齐,细胞形态、大小异常,细胞间隙基本正常,见图2。

图2 HE染色心肌组织形态变化(400×)Figure 2 HE staining results of morphological changes in heart tissues
2.3 3组小鼠心肌组织Western blotting检测结果
3组小鼠心肌组织中NLRP3、IL-1β、TGF-β1蛋白比较,差异有统计学意义(P<0.05),组间比较结果显示,模型组NLRP3、IL-1β、TGF-β1蛋白表达高于对照组,有氧运动组NLRP3、IL-1β、TGF-β1蛋白表达低于模型组、高于对照组,差异有统计学意义(P<0.05),见表1、图3。
表1 3组小鼠心肌组织中NLRP3、IL-1β、TGF-β1蛋白表达情况(±s)Table 1 Expression of NLRP3,IL-1β,TGF-β1 protein in myocardial tissue of 3 groups of mice

表1 3组小鼠心肌组织中NLRP3、IL-1β、TGF-β1蛋白表达情况(±s)Table 1 Expression of NLRP3,IL-1β,TGF-β1 protein in myocardial tissue of 3 groups of mice
注:NLRP3=NOD受体3,IL-1β=白介素1β,TGF-β1=转化生长因子β1;a表示与对照组比较P<0.05,b表示与有氧运动组比较P<0.05。
组别只数NLRP3IL-1βTGF-β1对照组91.123±0.1101.136±0.1191.162±0.184模型组95.741±0.220ab6.447±0.524ab7.906±0.658ab有氧运动组92.851±0.279a3.724±0.140a2.624±0.244a F值353.02201.52215.98 P值<0.001<0.001<0.001
2.4 3组小鼠心肌组织SOD和GSH-Px表达量
3组小鼠心肌组织中SOD、GSH-Px表达量比较,差异有统计学意义(P<0.05),组间比较结果显示,模型组SOD、GSH-Px表达量低于对照组,有氧运动组SOD、GSH-Px表达量高于模型组、低于对照组,差异有统计学意义(P<0.05),见表2。
表2 3组小鼠心肌组织SOD、GSH-Px表达量比较(±s,U/mg)Table 2 Comparison of SOD and GSH-Px expression in myocardial tissue of mice in 3 groups

表2 3组小鼠心肌组织SOD、GSH-Px表达量比较(±s,U/mg)Table 2 Comparison of SOD and GSH-Px expression in myocardial tissue of mice in 3 groups
注:SOD=超氧化物歧化酶,GSH-Px=谷胱甘肽过氧化物酶;a表示与对照组比较P<0.05,b表示与有氧运动组比较P<0.05。
组别只数SODGSH-Px对照组932.325±0.75425.464±1.067模型组912.879±0.133ab8.672±1.056ab有氧运动组921.615±0.432a15.990±0.608a F值314.13729.53 P值<0.001<0.001
3 讨论
AS及其相关的心肌纤维化是心血管疾病防治的主要方向[11],临床上治疗主要以抗炎、降脂等药物治疗为主,但治疗效果有限。运动有助于降低心血管疾病发生的风险。研究表明,运动训练明显改善了心肌梗死引起的心脏功能障碍和纤维化[12]。此外,也有研究证明运动训练减轻了因年老导致的心肌纤维化,并促进了血管内皮生长因子的释放[7]。上述研究表明,有氧运动可能在改善AS引起的心肌纤维化方面也发挥重要作用。
运动训练可以预防或减轻心肌纤维化,其机制与运动训练抑制心肌细胞炎症和细胞凋亡,清除胞质内受损蛋白质和代谢产物等有关[13-14]。本研究显示,模型组小鼠心肌细胞形态、大小、间隙均有所增宽,存在炎性细胞的浸润,这表明AS激活了炎症反应。免疫炎症反应在加重心肌损伤和纤维化过程中发挥着至关重要的作用[15]。NLRP3炎症小体作为AS中调节炎症的关键因子,其激活可以加剧心肌纤维化的进程[16-17]。也有研究证明,抑制NLRP3炎症小体激活可以通过调节IL-1β分泌来减少巨噬细胞的募集,同时对成纤维细胞向肌成纤维细胞的转化也有抑制作用,以此改善心肌纤维化[18]。IL-1β是另一个致AS的关键因子,主要来源于血管内皮细胞和心脏成纤维细胞,可以诱导促炎细胞因子IL-6和IL-8的表达以及其他参与纤维化的蛋白表达增加[19]。此外,IL-1β还可通过加速心肌细胞凋亡来促进心肌纤维化[20]。本研究结果发现,AS模型组小鼠心肌组织中NLRP3、IL-1β蛋白表达均显著升高,经12周的有氧运动后,小鼠NLRP3、IL-1β蛋白表达显著减少,炎性损伤和心肌纤维化均减轻。蒲咏秋[21]的研究也表明,跑台运动显著降低了心力衰竭小鼠肿瘤坏死因子α(TNF-α)、IL-1β和IL-6的水平,改善心肌功能并减弱心肌损伤。
作为调节纤维化过程的关键生长因子,TGF-β1活性在心肌损伤后显著增加,并参与调节所有促进心肌纤维化细胞的表型和功能[22]。许多研究已经表明血管紧张素、醛固酮等多种因素导致的心肌纤维化与TGF-β信号传导通路的激活有关[23-24]。本研究与刘亚等[25]的研究结果大致吻合,均显示运动可以减少TGF-β1的水平,从而改善心肌纤维化。其原因可能是:TGF-β1是AS心肌纤维化的主要开关之一,AS诱导的氧化应激和慢性炎症环境使TGF-β1表达增加,以发挥抑制过度炎症反应的作用。慢性炎症反应使TGF-β1受体表达发生改变的同时激活了TGF-β1信号通路,刺激成纤维细胞的增殖和分化,活化的TGF-β1还会诱导细胞外基质沉积,加重心肌纤维化[26-27]。有氧运动具有抗炎、抗氧化的作用,可以减轻AS小鼠炎症反应,减少TGF-β1的过度释放,从而减缓AS心肌纤维化。
ROS的过度释放会触发多种信号传导,导致炎性细胞因子TNF-α、IL-1β、IL-6以及转化生长因子的过量产生,促进心肌纤维化[28-29]。SOD和GSH-Px是心肌组织内重要的抗氧化酶,能够间接反映心肌氧化应激水平和自由基的代谢水平,保护组织免受氧化应激的损伤[30]。研究表明,抗氧化酶活性的增加在抑制糖尿病大鼠心肌纤维化方面发挥潜在作用[26]。有研究报道,抑制自发性高血压心肌组织氧化应激反应,可以抑制高血压导致的心肌纤维化[31]。本次实验结果表明,模型组的抗氧化指标SOD和GSH-Px较对照组低,有氧运动后小鼠心肌组织中抗氧化酶SOD和GSH-Px的活性较模型组有所升高。其机制可能是有氧运动激活小鼠的酶促抗氧化系统,调节机体氧化应激,增强AS小鼠抗氧化能力,抑制了ROS产生炎性细胞因子以及转化生长因子的某些通路,从而改变心肌纤维化的进程。
综上所述,本研究结果显示,有氧运动减轻AS小鼠心肌纤维化可能与抑制小鼠心肌组织炎症反应、激活抗氧化应激水平,发挥心脏保护作用有关。然而需要指出的是,本研究仅是对该方面做了初步探讨,有氧运动改善AS小鼠心肌纤维化的具体机制还需要进一步深入研究。
作者贡献:秦芳负责文章构思;马甜甜、于子夫负责数据统计、绘制图表;刘西花对整体研究方案、设计、研究实施过程等进行指导,对论文整体负责。
本文无利益冲突。
