改性硅藻土负载磷钼酸铵复合吸附剂的制备及其吸附Cs+研究
2023-11-16郭雪琴邓小川朱朝梁王瑞瑞马婉霞左方涛卿彬菊
郭雪琴,邓小川,朱朝梁,扶 鑫,王瑞瑞,马婉霞,樊 洁,左方涛,卿彬菊
(1.中国科学院青海盐湖研究所,中国科学院盐湖资源综合高效利用重点实验室,青海西宁 810008;2.青海省盐湖资源开发工程技术研究中心,青海西宁 810008;3.中国科学院大学,北京 100049;4.杭州水处理技术研究开发中心有限公司,浙江杭州 310012)
铯(Cs)由于其活泼的化学性质和独特的光电效应,在特种玻璃、催化剂、生物医药等传统领域及铯原子钟、离子推进剂火箭、光敏电子元件等高新技术领域有着十分广泛的应用前景[1-4]。随着盐湖提钾、提锂工业的快速发展,盐湖卤水中稀散元素的提取也受到广泛关注。中国盐湖数量多,液态矿铯资源丰富,且部分盐湖原卤中铯含量达到工业开采品位以上[5]。相较于美国、智利、以色列等国家,中国盐湖资源开发产品较为单一,而盐湖卤水中含有大量未被开发利用的有用成分,因而造成了资源浪费[6]。开展盐湖卤水中分离提铯工艺的研究有利于资源与环境的可持续发展及盐湖资源的综合利用。
现阶段已开发了多种从溶液相分离提铯的方法,其中吸附法因选择性高、适用于低浓度目标离子的分离,在溶液相分离Cs+方面表现出一定的优势[7-8]。盐湖卤水中Cs+含量低,且含有大量高浓度金属元素(如Li+、Na+、K+、Ca2+、Mg2+等),使得吸附法选择性分离Cs+较为困难。因此,制备选择性强、吸附容量大的吸附剂成为吸附法的关键。
硅藻土(Diatomite,De)是一种天然多级孔无机材料,但其存在可用活性位较少、比表面积小等缺点。基于此,研究者使用有机表面活性剂或无机表面涂层对硅藻土表面进行改性,以提高硅藻土表面活性和比表面积。改性硅藻土已广泛应用于水处理领域[9-13],但对Cs+的吸附能力并不理想。磷钼酸铵[AMP,分子式为(NH4)3PMo12O40·xH2O]由于其独特的Keggin骨架及NH4+(3.31 Å)和Cs+(3.29 Å)水合离子半径相近,对Cs+吸附有较高的选择性和吸附量。大量研究表明,AMP 对Cs+的吸附机理是以NH4+和Cs+之间的离子交换为主,如式(1)所示[14-18]。因此,本研究以具有高Cs+吸附选择性的AMP为吸附剂主体材料,将其分散负载到改性硅藻土表面制备复合吸附剂,并用于Cs+吸附性能研究。
1 实验部分
1.1 实验试剂和仪器
试剂:硅藻土(白色)、氯化铝(AlCl3·6H2O)、氯化铯(CsCl)、十二烷基苯磺酸钠(SDBS)、尿素、氯化铵(NH4Cl)、磷钼酸[H3P(Mo3O10)4·xH2O]、盐酸,均为分析纯;氨水,质量分数为25%。
仪器:高压反应釜;X'Pert Pro 型X 射线衍射仪(XRD);SU8010 型场发射扫描电子显微镜(FESEM);NEXUS 型傅里叶变换红外光谱仪(FT-IR);AAnalyst 800 型原子吸收光谱仪(AAS);930 Compact IC Flex型离子色谱仪;Avio 20型电感耦合等离子体发射光谱仪(ICP-OES)。
1.2 γ-Al2O3/De-AMP复合吸附剂的制备
1)取10 g 硅藻土置于三口烧瓶中,加入一定量质量分数为5%的盐酸,加热至100 ℃后搅拌1 h,自然冷却至室温后真空抽滤,用去离子水洗涤至滤液呈中性,干燥备用。
2)取4 g 预处理的硅藻土置于烧杯中,加入80 mL去离子水搅拌至分散均匀;称取5.79 g氯化铝晶体加入到上述悬浊液中,强力搅拌90 min;称取0.18 g SDBS 作为模板剂,加入到悬浊液中,搅拌3 h后用氨水调节pH 至4;加入4.32 g 尿素,继续搅拌30 min;将上述悬浊液转入反应釜中,加热至180 ℃后反应5 h;自然冷却至室温后离心分离,用去离子水和乙醇洗涤样品至滤液显中性,真空干燥后得到改性硅藻土γ-AlOOH/De。将制备的γ-AlOOH/De在500 ℃下煅烧3 h后得到γ-Al2O3/De。
3)称取1 g制得的γ-Al2O3/De置于烧杯中,加入15 mL NH4Cl溶液(1 mol/L),室温下磁力搅拌8 h;取25 mL 磷钼酸溶液(0.02 mol/L),缓慢滴加至混合液中,继续搅拌12 h;反应生成的AMP 晶体分散沉淀在改性硅藻土表面;固液分离后用去离子水将固样洗涤数次,然后在80 ℃下干燥12 h 以上,最终制得复合吸附剂γ-Al2O3/De-AMP。
1.3 材料表征
采用X射线衍射仪对所制备吸附剂物相结构进行分析;采用场发射扫描电子显微镜观察分析吸附剂表面形貌;采用傅里叶变换红外光谱仪对制备的复合吸附剂表面官能团进行分析;采用原子吸收光谱仪测定吸附前后溶液中Cs+浓度;采用离子色谱仪测定吸附前后溶液相中的NH4+;采用ICP-OES 测定吸附前后Cs+以外的离子含量。
1.4 吸附实验
为了研究吸附剂γ-Al2O3/De-AMP 对Cs+的吸附性能,考察了吸附时间、Cs+初始浓度、溶液pH 及干扰离子对吸附过程的影响。制得的复合吸附剂对Cs+的吸附容量(qe)和吸附率(R)的计算公式如下:
式中:qe为吸附平衡时的吸附容量,mg/g;ρ0和ρe分别为溶液中初始和吸附平衡时的Cs+质量浓度,ρt为吸附时间t时的Cs+质量浓度,mg/L;V为溶液体积,mL;m为吸附剂用量,mg。
为了探究γ-Al2O3/De-AMP 对Cs+的吸附过程,分别用准一级和准二级吸附动力学模型对吸附数据进行拟合分析。相关模型方程如下:
式中:qt为吸附时间为t时的吸附容量,mg/g;t为吸附时间,min;k1、k2分别为准一级、准二级吸附速率常数。
采用Langmuir 和Freundlich 两种吸附等温模型对吸附数据进行拟合,以探究吸附质与吸附剂之间的相互作用。其中,Langmuir 吸附等温模型是吸附质在吸附剂表面的单层吸附模型;Freundlich吸附等温模型是吸附剂的吸附能分布不均的多层吸附模型。相关模型方程如下:
式中:qm为以吸附等温线性模型计算的理论吸附容量,mg/g;KL是特定温度下Langmuir 常数;KF、n分别为与吸附容量和吸附强度有关的Freundlich常数。
1.5 脱附实验
称取一定量吸附饱和后的吸附剂置入离心管中,以一定比例的H2O、KCl、NH4Cl、NH4NO3为脱附剂进行脱附实验研究。脱附率(D)计算公式如下:
式中:ρ2为脱附液中Cs+质量浓度,mg/L;V2为脱附剂用量,mL;m2为脱附时吸附剂(吸附Cs+后)用量,mg。
2 结果与讨论
2.1 材料表征
2.1.1 样品XRD分析
图1 为De、改性硅藻土γ-AlOOH/De、煅烧后改性硅藻土γ-Al2O3/De及复合吸附剂γ-Al2O3/De-AMP的XRD谱图。由图1可知,De样品的X射线衍射峰表现出典型的晶态SiO2衍射峰,这主要是因为本研究选择了SiO2含量较高的优质硅藻土。γ-AlOOH/De的XRD谱图中出现了新衍射峰,对应于γ-AlOOH的标准卡片(PDF#21-1307)的晶面衍射峰。γ-AlOOH/De 经500 ℃煅烧后,γ-AlOOH 的衍射峰消失,此时改性硅藻土表面γ-AlOOH 转变成γ-Al2O3晶体[13,19]。在γ-Al2O3/De上负载AMP后,样品在10.72°、13.13°、15.16°、18.63°、24.11°、32.53°、39.35°处出现新的衍射峰,分别对应于(110)(111)(200)(211)(310)(411)(510)晶 面 衍 射 峰,与(NH4)3PO4(MoO3)12·4H2O 标准卡片(PDF#09-0412)相符,说明制备的样品中含有AMP。
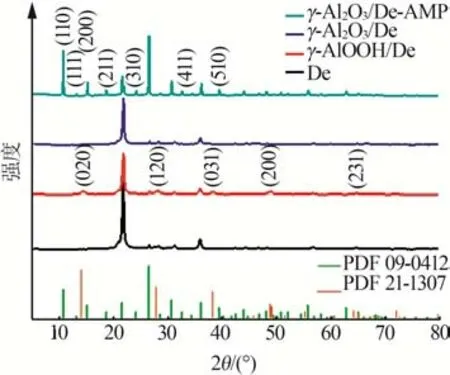
图1 De、γ-AlOOH/De、γ-Al2O3/De和γ-Al2O3/De-AMP的XRD谱图Fig.1 XRD patterns of De,γ-AlOOH/De,γ-Al2O3/De and γ-Al2O3/De-AMP
2.1.2 样品SEM分析
图2为De、γ-AlOOH/De、γ-Al2O3/De及γ-Al2O3/De-AMP 的SEM 图。从图2a 可以看出,本实验所选De为直径在30~40 μm的圆盘状De,且该De经过1 200 ℃煅烧后表面部分孔道被堵塞,这也是本研究所选De 比表面积(见表1)远小于文献报道[13]的主要原因。从图2b 可以看出,经氯化铝改性后De 表面生成结构丰富的纳米片层晶体。从图2c 可以看出,γ-AlOOH/De经500 ℃煅烧后表面束状结构未发生显著变化,但片层轮廓模糊。从图2d 可以看出,负载AMP对改性硅藻土表面片层结构无显著影响,AMP 球形颗粒均匀负载在γ-Al2O3/De 表面,有利于AMP与Cs+的充分接触,提高吸附量。

表1 De、γ-AlOOH/De、γ-Al2O3/De和γ-Al2O3/De-AMP的比表面积、平均介孔孔径及孔容积Table 1 Specific surface area,average mesoporous pore size and pore volume of De,γ-AlOOH/De,γ-Al2O3/De and γ-Al2O3/De-AMP
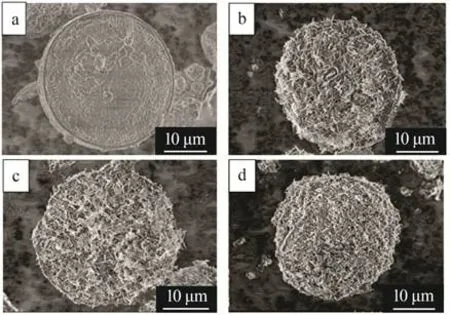
图2 De(a)、γ-AlOOH/De(b)、γ-Al2O3/De(c)、γ-Al2O3/De-AMP(d)的SEM图Fig.2 SEM images of De(a),γ-AlOOH/De(b),γ-Al2O3/De(c)and γ-Al2O3/De-AMP(d)
2.1.3 样品FT-IR分析
图3为De、γ-AlOOH/De、γ-Al2O3/De及γ-Al2O3/De-AMP 的FT-IR 谱图。由图3 可知,γ-AlOOH/De样品在3 102 cm-1处出现对应于Al—O—H伸缩振动带的吸收峰,经过500 ℃煅烧处理后样品中Al—O—H伸缩振动峰消失,结合图1 中改性硅藻土的XRD 谱图分析,可推测硅藻土改性成功,且在煅烧后形成稳定性较强的γ-Al2O3。样品γ-Al2O3/De-AMP在1 405 cm-1处出现对应于NH4+振动带的吸收峰,分别在1 060、961、866 cm-1处出现对应于P—O、Mo—O、Mo—O—Mo 振动带的吸收峰[15]。结合γ-Al2O3/De-AMP 的SEM 图和XRD 谱图分析,可推断成功制备了复合吸附剂γ-Al2O3/De-AMP。
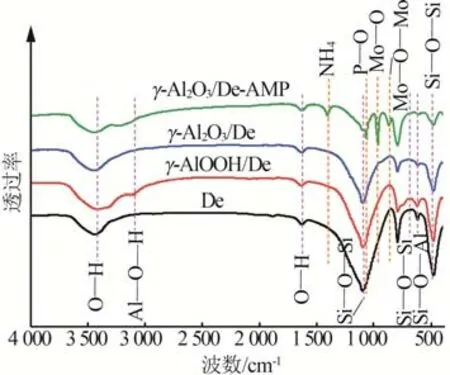
图3 De、γ-AlOOH/De、γ-Al2O3/De和γ-Al2O3/De-AMP的FT-IR谱图Fig.3 FT-IR spectra of De,γ-AlOOH/De,γ-Al2O3/De and γ-Al2O3/De-AMP
2.1.4 比表面积及孔结构分析
图4为De、γ-AlOOH/De、γ-Al2O3/De及γ-Al2O3/De-AMP 的N2吸附-脱附曲线,表1 为相应材料的比表面积、平均介孔孔径及孔容。根据国际理论与应用化学联合会(IUPAC)的分类方法可知,图4中4种样品的N2吸附-脱附曲线均属于Ⅱ型等温线;在p/p0>0.4 区域出现H3 型迟滞回线,表明孔结构不规整;在p/p0>0.9 区域吸附曲线陡增,且没有出现吸附饱和平台,说明样品中含有大孔结构。这些现象均与样品的SEM 图中所观察到的多级孔结构对应。由表1 可知,由于纳米γ-AlOOH、γ-Al2O3中束状片层结构的存在,改性硅藻土的平均介孔孔径减小,比表面积增大;此外,γ-AlOOH 经煅烧后转变成γ-Al2O3,片层结构表面变得粗糙[13]。因此,煅烧后的改性硅藻土比表面积更大,同时较大的比表面积有利于AMP的均匀分散。
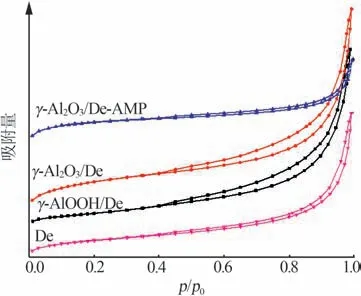
图4 De、γ-AlOOH/De、γ-Al2O3/De和γ-Al2O3/De-AMP的N2吸附-脱附曲线Fig.4 N2 adsorption-desorption curves of De,γ-AlOOH/De,γ-Al2O3/De and γ-Al2O3/De-AMP
2.2 吸附实验
2.2.1 吸附时间对γ-Al2O3/De-AMP 吸附性能的影响及吸附动力学拟合
在吸附温度为25 ℃、Cs+初始浓度为5 mmol/L条件下,考察了吸附时间对γ-Al2O3/De-AMP吸附性能的影响,结果见图5。由图5可知,在前15 min内γ-Al2O3/De-AMP 对Cs+的吸附量明显增加;在15 min时Cs+吸附量达到74.30 mg/g,基本达到吸附平衡状态;15 min后吸附量增速降低,主要是因为随着吸附过程的进行,吸附剂表面可用吸附位点数量减少。
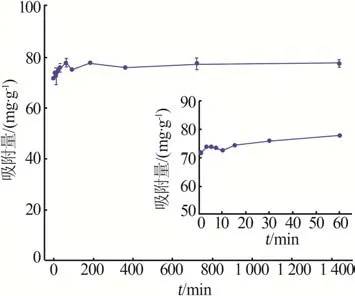
图5 吸附时间对γ-Al2O3/De-AMP的Cs+吸附量的影响Fig 5 Effect of adsorption time on Cs+ adsorption capacity of γ-Al2O3/De-AMP
图6为γ-Al2O3/De-AMP吸附Cs+的准一级、准二级动力学模型拟合曲线,表2为γ-Al2O3/De-AMP 对Cs+的吸附动力学拟合参数。结合图6 和表2 可知,γ-Al2O3/De-AMP 对Cs+的吸附过程更符合准二级动力学模型,说明γ-Al2O3/De-AMP对Cs+的吸附以化学吸附为主。

表2 γ-Al2O3/De-AMP对Cs+的吸附动力学拟合参数Table 2 Linear fitting constants of adsorption kinetic parameters on Cs+ of γ-Al2O3/De-AMP

图6 γ-Al2O3/De-AMP对Cs+的吸附动力学线性拟合曲线Fig.6 Linear fitting curves of adsorption kinetic of Cs+ by γ-Al2O3/De-AMP
2.2.2 Cs+初始浓度对γ-Al2O3/De-AMP 吸附性能的影响及吸附等温模型研究
在其他吸附条件保持不变的情况下,探究Cs+初始浓度对γ-Al2O3/De-AMP吸附性能的影响,结果见图7。由图7 可知,在Cs+初始浓度为0.1~5 mmol/L时,γ-Al2O3/De-AMP 对Cs+的吸附量随初始浓度的增大显著增加;当Cs+初始浓度达到5 mmol/L 时,吸附量可达到79.41 mg/g,这主要是因为该阶段的Cs+初始浓度较低,γ-Al2O3/De-AMP 表面还有大量未被占用的吸附位点;在Cs+初始浓度大于5 mmol/L以后,其吸附量增速变缓并趋于平衡。
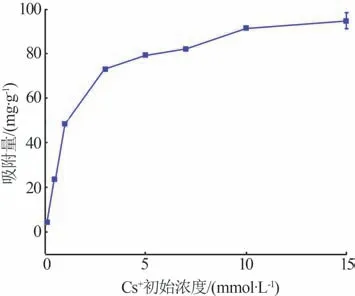
图7 Cs+初始浓度对γ-Al2O3/De-AMP吸附Cs+量的影响Fig.7 Effect of Cs+ initial concentration on Cs+ adsorption capacity of γ-Al2O3/De-AMP
图8 为25 ℃下γ-Al2O3/De-AMP 对Cs+的Langmuir和Freundlich吸附等温线性模型拟合曲线,表3为对应的吸附等温模型拟合参数。结合图8 和表3可知,γ-Al2O3/De-AMP 对Cs+的吸附过程与Langmuir吸附等温模型更吻合,说明γ-Al2O3/De-AMP对Cs+的吸附是吸附剂表面单层吸附。

表3 γ-Al2O3/De-AMP对Cs+的吸附等温模型拟合参数Table 3 Adsorption isotherm model parameters on Cs+ of γ-Al2O3/De-AMP
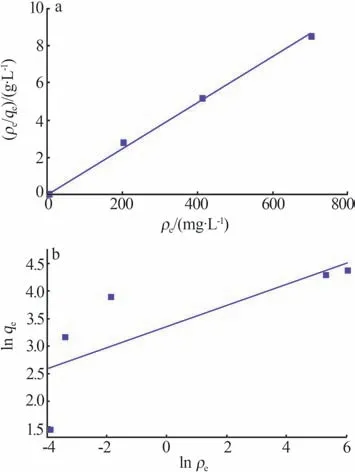
图8 γ-Al2O3/De-AMP对Cs+的吸附等温线性模型拟合曲线Fig.8 Linear fitting curves of adsorption isothermal model of γ-Al2O3/De-AMP
2.2.3 pH对γ-Al2O3/De-AMP吸附性能的影响
盐湖卤水因其水化学类型不同而表现出不同的酸碱度,因此有必要对γ-Al2O3/De-AMP 的pH 适用范围进行探究。利用一定浓度的HCl和NaOH 溶液调节CsCl 溶液pH 为2~11,开展γ-Al2O3/De-AMP 对Cs+吸附实验,结果见图9。由图9 可知,当溶液pH为2 时,γ-Al2O3/De-AMP 对Cs+的吸附量较低,主要是因为此时溶液中H+与Cs+存在竞争吸附;当溶液pH 为3~9 时,吸附量无显著变化;当pH 调至11时,γ-Al2O3/De-AMP 对Cs+的吸附量最高。由此说明,γ-Al2O3/De-AMP 吸附Cs+时可适用的pH 范围较宽。
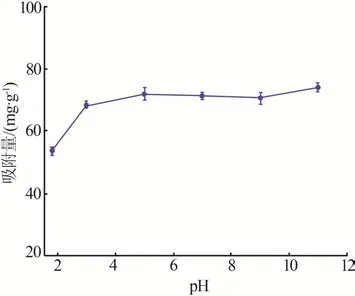
图9 pH对γ-Al2O3/De-AMP吸附Cs+性能的影响Fig.9 Effect of pH on Cs+ adsorption properties of γ-Al2O3/De-AMP
2.2.4 干扰离子的影响及γ-Al2O3/De-AMP 在模拟卤水中的应用
为了探究γ-Al2O3/De-AMP 对Cs+的吸附选择性,分别配制了Cs+与干扰离子(Li+、Na+、K+、Ca2+、Mg2+)共存的简单二元体系和1#、2#模拟卤水复杂体系溶液,进行Cs+吸附实验,结果如图10 所示。图10a 为干扰离子存在的情况下,γ-Al2O3/De-AMP对Cs+的吸附量。由图10a 可知,干扰离子共存对γ-Al2O3/De-AMP 的Cs+吸附量无显著影响,仍保持较高的吸附量。图10b 为模拟卤水中γ-Al2O3/De-AMP 对Cs+的吸附率。由图10b 可知,γ-Al2O3/De-AMP 在两种模拟卤水中对Cs+的吸附率均保持在95%以上,说明γ-Al2O3/De-AMP有较高的吸附选择性,这对γ-Al2O3/De-AMP在实际卤水中的应用提供了一定参考。
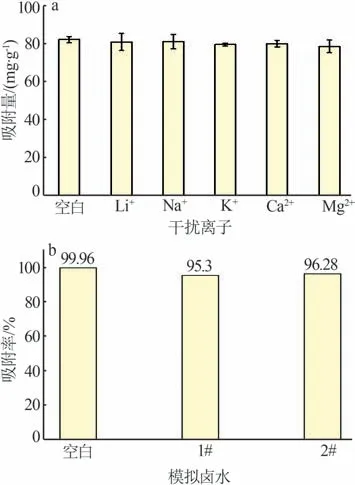
图10 γ-Al2O3/De-AMP对Cs+的吸附选择性Fig.10 Adsorption selectivity of γ-Al2O3/De-AMP for Cs+
2.3 脱附及循环实验
为了进一步探究所制备吸附剂γ-Al2O3/De-AMP 的循环使用性能,本研究以H2O 及1 mol/L 的KCl、NH4Cl、NH4NO3溶液为脱附剂进行脱附实验,结果如图11a 所示。由图11a 可知,脱附剂为NH4Cl、NH4NO3时Cs+的脱附率较高,但并不理想。故本研究考虑通过调整NH4NO3浓度来提高Cs+脱附率,结果如图11b 所示。由图11b 可知,随着NH4NO3浓度的增加,Cs+脱附率显著增加,当NH4NO3浓度增加至5 mol/L 时,Cs+脱附率最高可达88.23%。由于NH4NO3浓度在大于3 mol/L 以后脱附率增量不显著,故后续实验选择以3 mol/L NH4NO3为脱附剂。以3 mol/L 的NH4NO3为脱附剂时脱附时间对Cs+脱附率的影响结果如图11c 所示。由图11c 可知,γ-Al2O3/De-AMP对Cs+的脱附速率极快,可在30 min内快速达到脱附平衡。图11d 为以3 mol/L 的NH4NO3溶液为脱附剂时γ-Al2O3/De-AMP 的循环使用性能。由图11d可知,经过4次吸附-脱附循环后γ-Al2O3/De-AMP 对Cs+的吸附量仍可达到初始吸附量的74.38%,这对吸附剂在实际卤水中的循环利用十分有利。
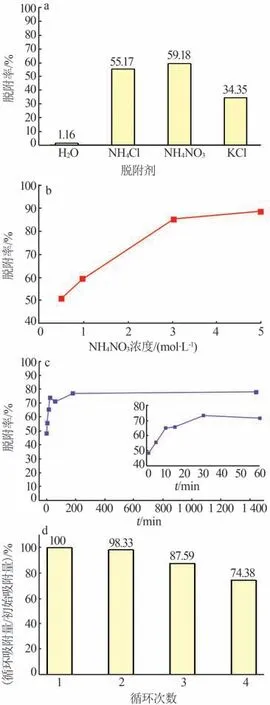
图11 脱附及循环实验研究Fig.11 Study on desorption and cycling experiment
2.4 吸附机理研究
为了进一步探究γ-Al2O3/De-AMP 材料结构稳定性及吸附机理,对吸附前后材料进行了SEM 和XRD 表征分析,结果如图12 所示。由图12a~b 可知,4次吸附-脱附循环后吸附剂表面形貌无显著变化,改性硅藻土表面仍附着大量AMP 颗粒,仅表面片层结构略有损毁。由图12c 可以看出,吸附前后晶体结构未发生显著变化,仅有部分晶面衍射峰强度变弱,说明该吸附过程不会破坏γ-Al2O3/De-AMP的晶体结构。
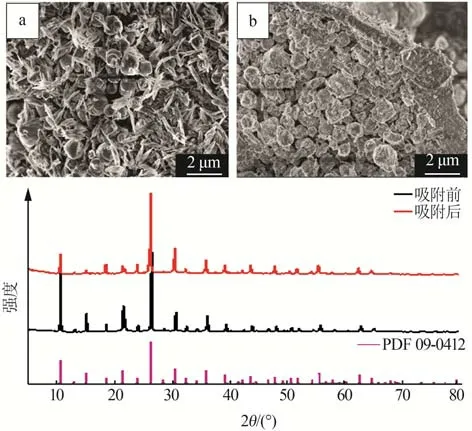
图12 吸附前(a)、吸附后(b)的SEM图和吸附前后XRD谱图(c)Fig.12 SEM images before(a) and after(b) adsorption,and XRD patterns before and after adsorption(c)
表4 为γ-Al2O3/De-AMP 吸附Cs+前后溶液相中Cs+和NH4+的浓度。由表4可知,吸附前后溶液相中Cs+和NH4+浓度近似等物质的量变化,其中Cs+浓度略高于NH4+浓度的部分可认为是γ-Al2O3/De-AMP对Cs+的物理吸附,该结果与文献报道的反应式(1)一致,证实了γ-Al2O3/De-AMP 对Cs+的吸附是由溶液中Cs+和吸附剂中NH4+交换实现的。
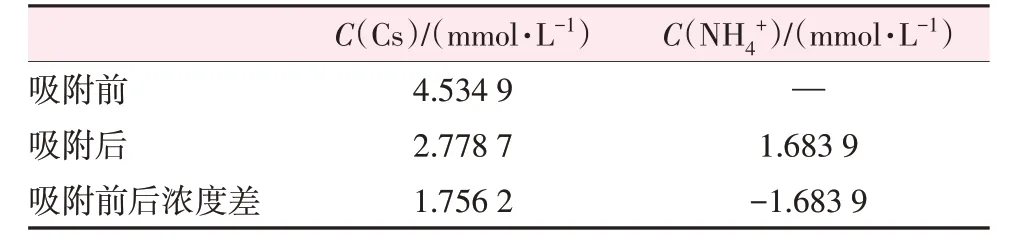
表4 γ-Al2O3/De-AMP吸附Cs+前后溶液中各离子浓度变化Table 4 Changes of ion concentration in solution before and after Cs+ adsorption by γ-Al2O3/De-AMP
2.5 与其他AMP基复合吸附剂的比较
表5 归纳了近年来以AMP 为吸附剂主体的复合吸附剂对Cs+的吸附性能。通过对比发现,本研究所制备的复合吸附剂适用的pH范围较宽,且在吸附速率、吸附容量等方面均表现出较优的Cs+吸附性能。
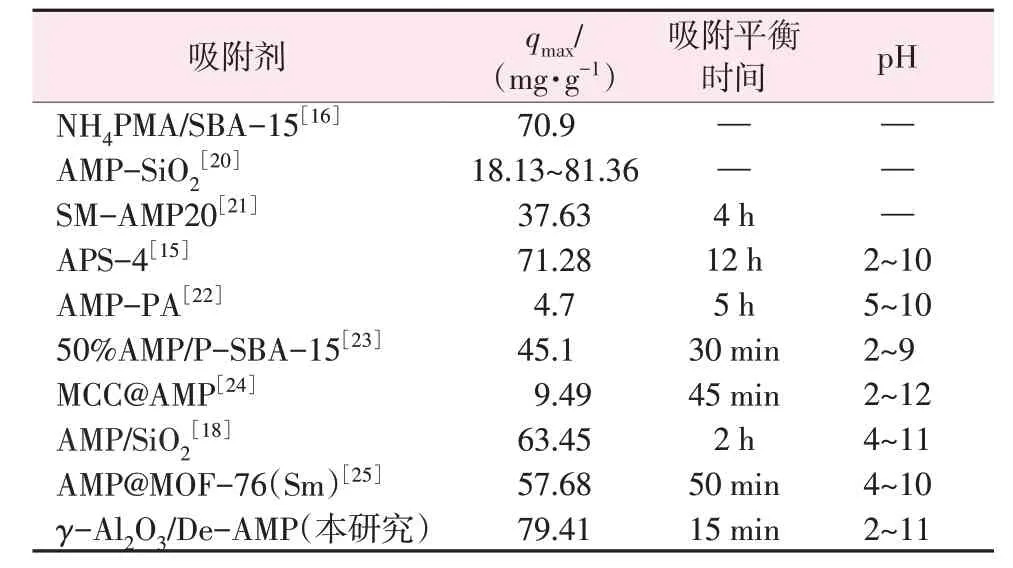
表5 近年来文献报道的AMP基复合吸附剂对Cs+的吸附性能Table 5 Cs+ adsorption properties of AMP-based adsorbents reported in recent years
3 结论
本研究通过前期条件探索制备了表面结构丰富的改性硅藻土,并将其作为载体材料,在500 ℃下煅烧后负载AMP制备了复合吸附剂γ-Al2O3/De-AMP。
1)通过SEM、XRD、FT-IR 表征手段证实了γ-Al2O3/De-AMP已成功制备。
2)通过系统的Cs+吸附实验,得出γ-Al2O3/De-AMP可在15 min内快速达到吸附平衡;所制备的复合吸附剂在较宽的pH范围内均适用。
3)对吸附数据进行动力学和吸附等温模型拟合,得出吸附过程更符合准二级动力学模型和Langmuir吸附等温模型。
4)以3 mol/L NH4NO3为脱附剂时表现出较优的吸附-脱附循环性能;且制备的吸附剂在模拟卤水复杂体系中保持了较高的吸附率,这对其在实际卤水中的应用推广有非常重要的参考价值。
