信迪利单抗致多个内分泌腺功能异常1例并文献复习
2023-11-16武慧敏胡晓霞
竺 晶,谢 骥,武慧敏,胡晓霞△
(兰州大学第二医院:1.老年病科;2.肿瘤内科;3.儿科,甘肃 兰州 730030)
程序性死亡蛋白1(PD-1)抑制剂是免疫检查点抑制剂的一种,其通过克服体内的免疫抑制,重新激活自身免疫细胞来杀伤肿瘤,是一种全新的抗肿瘤药物,这些药物通过精确攻击癌细胞从而减少药物不良反应。但这类药物可能造成体内的T淋巴细胞过度激活,从而产生特有的不良反应——免疫相关不良反应,可涉及消化系统、呼吸系统、内分泌系统、皮肤等,皮肤不良反应以皮疹和瘙痒多见,甲状腺炎和垂体炎是常见的内分泌免疫相关不良事件[1],而孤立性促肾上腺皮质激素(ACTH)缺乏症(IAD)比较罕见[2]。目前,已有与纳武利尤单抗[3-6]、帕博利珠单抗[7-8]、阿替利珠单抗[9]、信迪利单抗[10]治疗相关的IAD,大多数发生在治疗过程中。本院收治1例胃癌术后患者停用信迪利单抗后出现皮肤苔藓样药疹、IAD合并原发性甲状腺功能减退症(甲减)的病例,现将其临床资料报道如下,并进行相关文献复习,旨在提高临床医生对免疫检查点抑制剂导致的罕见病的诊治水平。
1 临床资料
患者,男,53岁。因乏力、恶心、水肿3个月,加重1周于2020年12月7日收入院。2019年8月因便血就诊,行胃镜检查并取活检,结果提示胃癌。2019年9月在本院普外科行胃次全切除术,术后病理提示溃疡型中分化腺癌。2019年10月至2020年3月行6个周期替吉奥+奥沙利铂+阿帕替尼方案化疗,过程顺利。2020年3月开始使用信迪利单抗注射液治疗(200 mg静脉输注,每3周1次),治疗4个周期后停药。停药2个月后(2020年8月)患者出现左侧躯体皮疹,外用炉甘石洗剂治疗后皮疹未见明显好转。停药3个月后(2020年9月)出现乏力、恶心、颜面部及双下肢水肿,查电解质提示钠离子(Na+)134.1 mmol/L、氯离子(Cl-)91.0 mmol/L,钾离子(K+)4.50 mmol/L、血糖4.94 mmol/L、全腹增强CT检查均未见明显异常,未予以治疗。2020年11月30日因乏力、恶心、水肿症状加重就诊于本院急诊科,查血常规:白细胞、中性粒细胞及淋巴细胞百分比、红细胞、血红蛋白均正常,嗜酸粒细胞百分比8%;电解质:Na+122.0 mmol/L、Cl-90.0 mmol/L,K+4.65 mmol/L;肝功能:谷丙转氨酶(ALT)367 U/L、谷草转氨酶(AST)354 U/L;尿常规:尿比重1.004。给予多烯磷脂酰胆碱456 mg、每天3次保肝,10%氯化钠多次静脉输注治疗后ALT、AST逐渐下降,但低钠、低氯仍未纠正;同时,甲状腺功能检查提示甲状腺功能减退,为进一步诊治遂收入院。患者既往无高血压、糖尿病及甲状腺疾病等慢性病史。入院查体:体温36.1 ℃,脉搏73次/分,呼吸频率18次/分,血压101/60 mm Hg(1 mm Hg=0.133 kPa),体重80 kg,左侧前胸壁、侧胸壁、背部、左手及左下肢散在皮疹,高出皮面,部分皮疹伴色素沉着。见图1。患者颜面部水肿,睑结膜无苍白,双侧甲状腺未触及肿大,心、肺、腹未见明显异常,双下肢水肿。实验室检查:Na+132.0 mmol/L、CI-98.0 mmol/L、K+4.04 mmol/L;血糖3.68 mmol/L;淋巴细胞百分比57%,嗜酸粒细胞百分比7%;尿比重1.010;ALT 283 U/L、AST 257 U/L;自身抗体、肝炎病毒检测均为阴性;皮质醇(COR)节律(08:00-16:00-24:00)<1.0 μg/dL-<1.0 μg/dL-<1.0 μg/dL(参考区间:5.0~25.0 μg/dL)、ACTH节律(08:00-16:00-24:00)<5.0 pg/mL-<5.0 pg/mL-<5.0 pg/mL(参考区间:0~46.0 pg/mL)、促甲状腺激素(TSH)>150.000 μIU/mL(参考区间:0.380~4.340 μIU/mL)、游离甲状腺素(FT4)0.79 pmol/L(参考区间:10.44~24.38 pmol/L)、游离三碘甲状腺原氨酸(FT3)1.50 pmol/L(参考区间:2.77~6.31 pmol/L)、三碘甲状腺原氨酸(T3)0.24 nmol/L(参考区间:1.01~2.96 nmol/L)、甲状腺素(T4)0.10 nmol/L(参考区间:54.40~161.20 nmol/L)、甲状腺球蛋白(TG)35.00 ng/mL(参考区间:0.83~68.00 ng/mL)、TG抗体(ATG-Ab)<15.00 U/mL(参考区间:0~60.00 U/mL)、甲状腺过氧化物酶抗体(TPO-Ab)39.30 U/mL(参考区间:0~60.00 U/mL)、醛固酮84.96 pg/mL、肾素活性1.37 ng/(mL·h)。泌乳素(PRL)、卵泡刺激素(FSH)、黄体生成素(LH)、雌二醇(E2)、睾酮(TSTO)、孕酮(PRGE)、生长激素(GH)均在正常范围。影像学检查:心电图、心脏彩色多普勒超声(彩超)均未见异常。甲状腺彩超:甲状腺体积正常,回声均匀。垂体磁共振、肾上腺CT检查均未见明显异常。左下肢皮损皮肤活检提示苔藓样药疹。见图2。
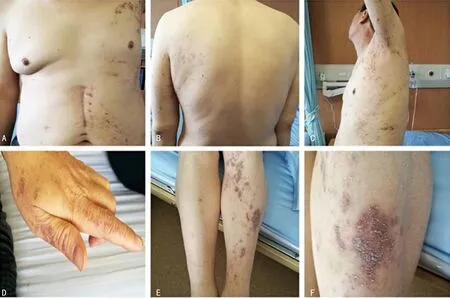
注:A.左侧胸壁及腹部皮疹;B.左侧背部皮疹;C.左侧侧胸壁皮疹;D.左手部皮疹;E.左下肢皮疹;F.左下肢局部皮疹。
结合病史及实验室检查结果考虑为PD-1抑制剂导致的皮肤苔藓样药疹、IAD合并原发性甲减和药物性肝损。给予氢化可的松每天100 mg静脉输注,患者恶心、乏力症状减轻,血压升高至120/70 mm Hg左右,逐渐恢复进食,激素剂量逐渐减量,停用静脉激素后改为氢化可的松08:00 20 mg、16:00 10 mg口服维持治疗。患者恶心、乏力症状好转后加用左旋甲状腺素钠补充甲状腺激素治疗,剂量逐渐增加至100 μg,每天1次。继续口服多烯磷脂酰胆碱456 mg、每天3次保肝治疗。左侧躯体皮损处给予卤米松软膏外用涂抹,每天2次,皮损逐渐消退。保肝治疗及激素替代治疗2周余后复查Na+142.0 mmol/L、Cl-105.0 mmol/L、K+4.14 mmol/L;淋巴细胞百分比34%,嗜酸性粒细胞百分比1%;尿比重1.016;ALT 61 U/L、AST 58 U/L。1个月后复查Na+146.0 mmol/L、Cl-108.0 mmol/L;淋巴细胞百分比26%,嗜酸粒细胞百分比3%;血糖4.17 mmol/L;尿比重1.022;COR 16.7 μg/dL(服用氢化可的松后)、ACTH<5.0 pg/mL、TSH 4.127 μIU/mL、FT4 17.48 pmol/L,FT3 6.07 pmol/L。实验室检查结果及内分泌激素水平变化见表1、2。嘱患者定期门诊随访,激素替代治疗剂量未调整,5个月后复查除ACTH<5 pg/mL外,垂体其他激素水平、垂体影像学、甲状腺功能、电解质、血常规、血糖均正常。目前仍在门诊规律随访。

表2 内分泌激素水平变化
2 讨 论
IAD是一种罕见疾病,由STEINBERG于1954年首次报道,其特征是继发性肾上腺皮质功能不全,COR生成减少或缺失,垂体除ACTH外其他激素水平正常,其诊断需排除长期使用糖皮质激素、垂体瘤切除术后、肿瘤转移破坏垂体等情况[11]。张颖等[12]报道我国仅有30多例,没有相关的流行病学调查,具体发病机制不明确,主要与特异性自身免疫过程相关。免疫检查点抑制剂相关IAD较少见,在回顾性队列研究中发病率仅为0.87%[13]。已有PD-1抑制剂导致IAD的相关文献报道,主要与纳武利尤单抗相关[14-17]。
信迪利单抗为重组全人源免疫球蛋白G型程序性死亡蛋白-1单克隆抗体,属于我国创新药物,2018年12月在我国上市,目前,已有其导致免疫相关不良事件的文献报道。垂体炎是免疫检查点抑制剂治疗中最常见的内分泌不良反应之一,其表现为存在一种或多种垂体激素缺乏,最常见的是TSH、ACTH、FSH、LH缺乏,垂体后叶激素缺乏极为罕见[18]。PD-1抑制剂诱发垂体炎的发生率仅为0.4%,在男性中更多见,常见于60岁以上的男性,比女性风险高2~5倍,30%以上的患者可表现为垂体体积中度增大,有时伴有垂体柄增粗,但垂体磁共振检查正常并不能完全排除垂体炎的诊断[18]。垂体细胞的特异性自身免疫,如自身抗体的存在与IAD的发生密切相关,已有文献报道在IAD患者中检测到了抗ACTH抗体[19]。在接受尸检的IAD患者中可观察到垂体淋巴细胞浸润,这也支持了细胞免疫在IAD的发生、发展中发挥作用这一观点[20-21]。回顾本例患者的临床资料,在使用PD-1抑制剂后出现IAD,垂体影像学检查正常,无创伤史,考虑为PD-1抑制剂诱发的垂体炎导致IAD的发生。
IAD患者临床表现无特异性,如乏力、食欲减退、体重减轻等,因此,不易进行鉴别诊断[22]。其血液生化分析也可能提示轻度低血糖、贫血、淋巴细胞增多、嗜酸粒细胞增多和低Na+血症[23]。通过整理本例患者的实验室检查结果发现,在出现临床症状前血Na+水平已存在缓慢进行性下降,在出现临床非特异性症状时伴顽固性低钠血症,与文献报道的纳武利尤单抗诱导的IAD患者在出现临床症状前血Na+水平缓慢进行性下降一致[24],提示早期观察血Na+水平有利于尽早发现IAD的存在。针对本例患者肿瘤术后出现顽固性低钠血症需与抗利尿激素分泌不当综合征相鉴别,本例患者血Na+水平低,但血渗透压在正常范围,完善实验室检查诊断IAD后仅补充氢化可的松治疗,未限制患者饮水量的情况下患者尿比重上升至正常,血Na+、Cl-恢复至正常范围,排除了抗利尿激素分泌不当综合征。值得注意的是,本例患者在血Na+缓慢进行性下降的同时血嗜酸粒细胞比率缓慢升高,糖皮质激素治疗后血Na+水平升高,嗜酸粒细胞比率下降,提示嗜酸粒细胞比率增高可能也有助于IAD的诊断。
免疫检查点抑制剂相关甲状腺功能障碍发生率为6%~20%,PD-1抑制剂治疗引发甲状腺功能紊乱最常见,发病率为5%~10%,部分患者经历短暂的甲状腺毒症期(2~12周)后转为甲状腺功能减退,与甲状腺炎的自然病程相似,甲状腺损伤在诊断时常有激素水平异常及甲状腺相关抗体阳性[18]。OSORIO等[25]发现,使用PD-1抑制剂治疗的非小细胞肺癌患者中80%的甲状腺功能异常者TPO-Ab和(或)TG-Ab阳性,然而是甲状腺自身抗体导致甲状腺功能异常,还是甲状腺炎过程中甲状腺的体液免疫反应导致抗体阳性,目前尚不清楚。而另一项使用PD-1抑制剂治疗的晚期癌症患者的研究结果显示,14%的患者发生了免疫相关甲状腺不良反应,其中54%的患者发生了甲状腺炎,发生甲状腺炎的患者中57%的患者痊愈,43%的患者出现临床或亚临床甲状腺功能减退,只有少数患者(31%)TPO-Ab呈阳性,PD-1抑制剂导致甲状腺破坏的机制似乎是独立于甲状腺自身抗体的,可能是由T淋巴细胞、自然杀伤(NK)细胞或单核细胞介导的免疫损伤所致[26]。本例患者从临床表现及甲状腺彩超检查均未发现甲状腺炎向原发性甲减的转变,且甲状腺自身抗体均为阴性。施云等[27]报道了1例PD-1抑制剂导致继发性肾上腺皮质功能减退合并原发性甲状腺功能减退病例,其甲状腺抗体同样为阴性。因并未对本例患者甲状腺功能进行系统追踪,所以,尚不能明确患者在发生甲状腺功能减退前是否存在短暂的甲状腺毒症期。PD-1抑制剂的2种最常见的不良反应为皮疹和瘙痒[28],发病机制仍不清楚,皮肤症状出现的时间从3 d至13个月不等[29]。目前,已有文献报道,PD-1抑制剂治疗后发生了组织病理学特征为苔藓样界面性皮炎的丘疹性苔藓样药疹[30-31],可表现为脓疱、丘疹和斑块。PD-1抑制剂治疗恶性肿瘤后平均42 d可出现苔藓样皮炎,病变多发生在四肢和躯干[32]。病理检查可表现为带状淋巴细胞浸润、角化过度、颗粒层及棘层增厚、角化不良等;可伴有明显的表皮增生;也可表现为角化不全、海绵状水肿、皮肤附属器/血管周围炎症和嗜酸粒细胞浸润[33]。本例患者使用PD-1抑制剂治疗后出现偏侧躯体皮疹伴瘙痒,皮疹高出皮面伴色素沉着,未超过前后正中线,病理检查除色素失禁症及表皮真皮交界不清外,还有苔藓样药疹更具有特点的病理改变,如局灶性角化不全、颗粒层断裂、淋巴细胞进入表皮上层、血管周围浸润等。与文献报道不一致的是本例患者皮肤活检未见明显嗜酸粒细胞浸润,考虑与皮疹出现时间较长,进行皮肤活检时病变逐渐好转,缺乏部分病理变化相关。但本例患者为何出现偏侧躯体皮疹尚不清楚,具体机制尚有待于进一步研究。
综上所述,PD-1抑制剂可能会导致多个内分泌腺功能异常、皮肤苔藓样药疹及药物性肝损害。IAD缺乏特异性临床表现,顽固性低钠血症和嗜酸粒细胞增多可能是早期线索。IAD合并原发性甲减时容易被甲减症状所迷惑,补充甲状腺激素早于COR时易出现加快COR代谢诱发的肾上腺危象,危及患者生命。因此,PD-1抑制剂引起内分泌系统一种腺体损伤时,需考虑是否合并其他腺体的自身免疫损伤。由于免疫检查点抑制剂的作用持续时间很长,建议对接受治疗的患者重视内分泌相关激素的检查,治疗过程中及停药后定期复查内分泌激素水平,若出现原发病不能解释的乏力、恶心、水肿、顽固性低钠血症,要警惕IAD及合并原发性甲减的可能。同时,还需监测血Na+水平进行性下降、嗜酸粒细胞百分比逐渐升高患者的ACTH、COR水平,早诊断、早治疗,提高免疫检查点抑制剂相关罕见疾病的诊治水平,提高患者的生活质量。
