TP53基因单核苷酸多态性与原发性肝细胞癌预后的关系
2023-11-15唐豪言潘正龙刘小方
唐豪言,潘正龙,刘小方
在世界范围内肝细胞癌(hepatocellular carcinoma,HCC)的发病率和死亡率位居恶性肿瘤第6 位和第4 位[1],主要由乙型肝炎病毒慢性感染所致。中国是乙肝大国,肝癌发病率高居我国恶性肿瘤的第4位[2]。目前,HCC 有许多既定的治疗方法,包括化疗、射频消融、肝移植及手术切除等。然而,即使早期已接受相关治疗的患者生存率也比较低,手术作为最常见的治疗手段,术后5 年内的肝癌复发率也高达60%~70%[3-4]。研究HCC患者术后预后的危险因素,对提高肝癌的治疗效果具有重要意义。TP53基因作为一个高度突变的抑癌基因,涉及人类多数肿瘤。该基因位于染色体17p13.1,由12 个外显子和10 个内含子组成,其蛋白产物p53 维持着细胞正常的基本活动,如细胞周期、细胞衰老、细胞凋亡和DNA损伤修复[5-6]。TP53基因突变作为HCC里最常见的突变[7],其改变不仅与肿瘤增殖、迁移、生长、侵袭及化疗药物的耐药性相关[8-9],同时具有TP53基因突变的患者肝癌复发时间和总生存期也会受到影响[10]。单核苷酸多态性(single nucleotide polymorphism,SNP)作为基因重要的变异形式,广泛参与各种肿瘤的发生和发展[11]。近年来,与肿瘤预后有关的多态性位点被相继报道,但关于HCC预后的研究相对较少。本研究旨在探讨HCC 患者预后的影响因素,并探究TP53基因SNP与HCC患者预后的关系。
1 对象与方法
1.1 研究对象 选择2014 年1 月—2020 年9 月在青岛大学附属烟台毓璜顶医院接受手术治疗且住院资料完整的HCC患者213例。纳入标准:已行肝恶性肿瘤切除手术;病理组织学诊断为HCC;采集血液样本前未行放疗或化疗。排除标准:既往有其他肿瘤病史;同期合并其他器官恶性肿瘤。研究参与者对试验知情同意,且通过医院医学伦理委员会批准(伦理号:烟毓医伦理审2019-169号)。
1.2 收集指标 通过查阅病历和标准化问卷收集研究对象年龄、性别,吸烟、饮酒情况,乙型病毒性肝炎感染病史、手术方式及围术期输血病史。同时收集患者相关临床病理学数据,包括肿瘤T分期、肿瘤大小、肿瘤数目、肝硬化、门静脉癌栓情况等。
1.3 随访 通过电话或门诊进行随访。术后前2年每3个月进行1次,从术后第3年起每6个月进行1次。随访终点事件为患者死亡或随访截止时间(截至2021年9月1日)。
1.4 SNP位点的选择和基因分型 基于以往相关肿瘤报道,尤其是涉及HCC预后文献,并利用TRANSFACR预测软件及NCBI dbSNP数据库(https://www.ncbi.nlm.nih.gov/snp/)筛选出TP53基因功能性SNP位点。其选择标准为:SNP位点的最小等位基因频率(minor allele frequency,MAF)>0.05。最终筛选出3 个SNP 作为研究对象,即TP53 基因rs1625895、rs9895829和rs28934578。
取静脉血5 mL,采用血液基因组提取试剂盒(北京博奥医学检验所有限公司)提取DNA,DNA片段需完整性好,无降解,无小片段RNA 污染,置于-80 ℃冰箱保存备用。采用聚合酶链反应-限制性片段长度多态性技术(PCR-RFLP)对基因型进行鉴别。利用Primer Premier 5.0软件设计引物[生工生物工程(上海)股份有限公司]。TP53 rs1625895引物序列:上游5'-TGGCCATCTACAAGCAGTCA-3',下游5'-TTGCACATCTCATGGGGTTA-3'。TP53 rs9895829 引物序列:上游5'-GCACCTCCTGCAACCCACTAGCGAT-3',下游5'-CTCTCAAAGAGGCCAAGGCAGGCAG-3'。TP53 rs28934578 引物序列:上游5'-GTCTCTGCTAGGGGGCTGGACTTGG-3',下游5'-CAGGAGTGCTTGGGTTGTGGTGAAA-3'。各SNP 位点均需要1 条延伸引物和2 条PCR 扩增引物。PCR 扩增条件:95 ℃预变性2 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,45 个循环;72 ℃延伸5 min。将PCR 产物使用限制性内切酶消化,消化程序:37 ℃40 min,85 ℃5 min。按照延伸反应扩增程序进行PCR产物的延伸,所得产物采用树脂板进行纯化。采用MassARRAY™质谱分析仪(美国Agena Bioscience 公司)对产物进行质谱分析,检测数据使用Typer 4.0 分析软件分析。
1.5 统计学方法 采用SPSS 25.0软件进行数据分析。计数资料采用例(%)表示。运用单因素或多因素Cox比例风险回归模型计算危险比(HR)及其95%CI并校正混杂因素,采用Kaplan-Meier 法绘制生存曲线,采用Log-rank 检验比较不同基因型之间的生存率差异。检验水准双侧α=0.05。
2 结果
2.1 研究对象一般资料及临床特征与HCC 预后的关系 单因素Cox 回归分析结果显示肿瘤大小、肿瘤T 分期、手术方式、围术期输血、肿瘤数目及肝硬化情况与肝癌预后相关(P<0.05),但年龄、性别、吸烟、饮酒、HBV感染史、肝癌家族史与及门静脉癌栓方面差异无统计学意义(P>0.05),见表1。
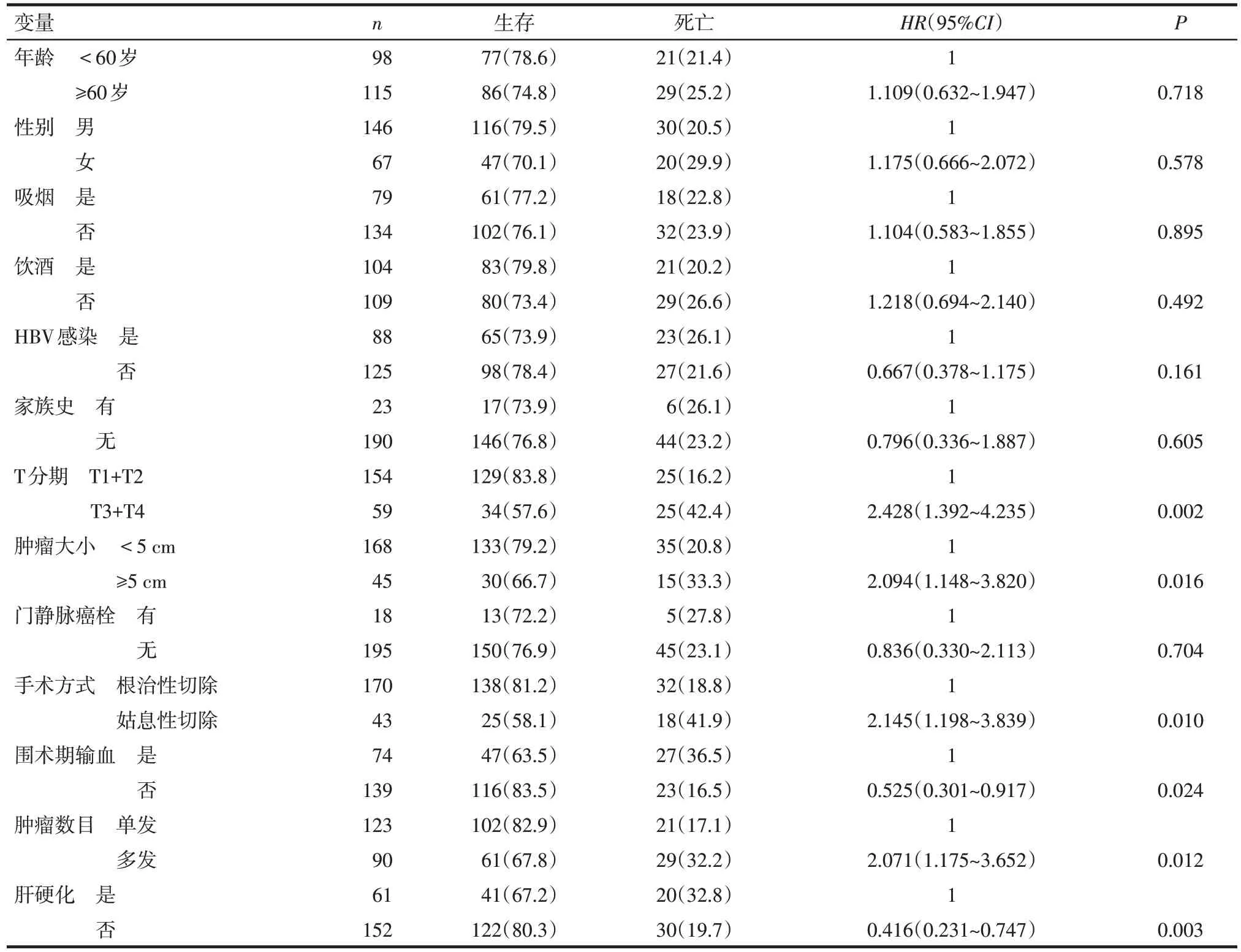
Tab.1 Relationship between clinical characteristics and the prognosis of hepatocellular carcinoma patients表1 HCC患者临床特征与预后的关系[例(%)]
2.2TP53SNPs 与HCC 预后的关系TP53基因rs1625895、rs9895829、rs28934578 位点符合Hardy-Weinberg 平衡,具有群体代表性。采用Kaplan-Meier、单因素Cox 回归分析rs1625895、rs9895829、rs28934578 位点后发现:TP53基因rs1625895 除显性模型外,其共显性模型(HR=2.190,95%CI:1.142~4.201,P=0.018)和隐性基因模型(HR=2.275,95%CI:1.225~4.227,P=0.009)与肝癌患者预后相关,见图1、表2。由于大多数肝癌患者确诊时年龄较大,老年患者的中位生存时间均短于年轻患者,故对年龄进行分层分析。结果显示在年龄≥60岁的人群中,共显性模型和隐性模型中AA基因型患者预后表现更差。TP53基因rs9895829、rs28934578位点基因多态性与HCC预后无关(P>0.05),见表3。
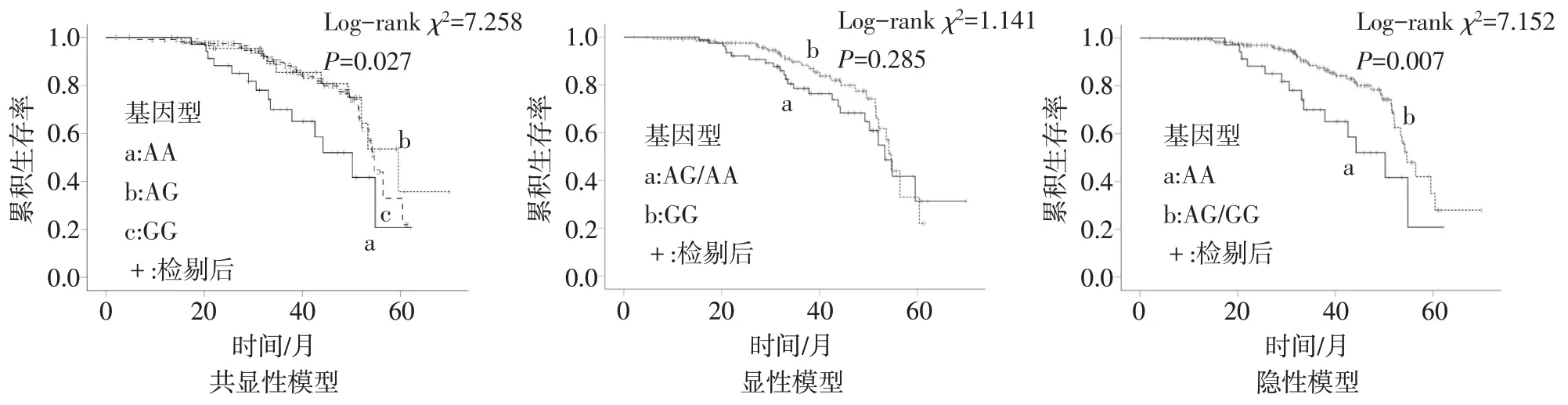
Fig.1 TP53 gene rs1625895 Kaplan-Meier survival curve in patients with hepatocellular carcinoma patients图1 HCC患者TP53基因rs1625895位点不同遗传模型的生存曲线
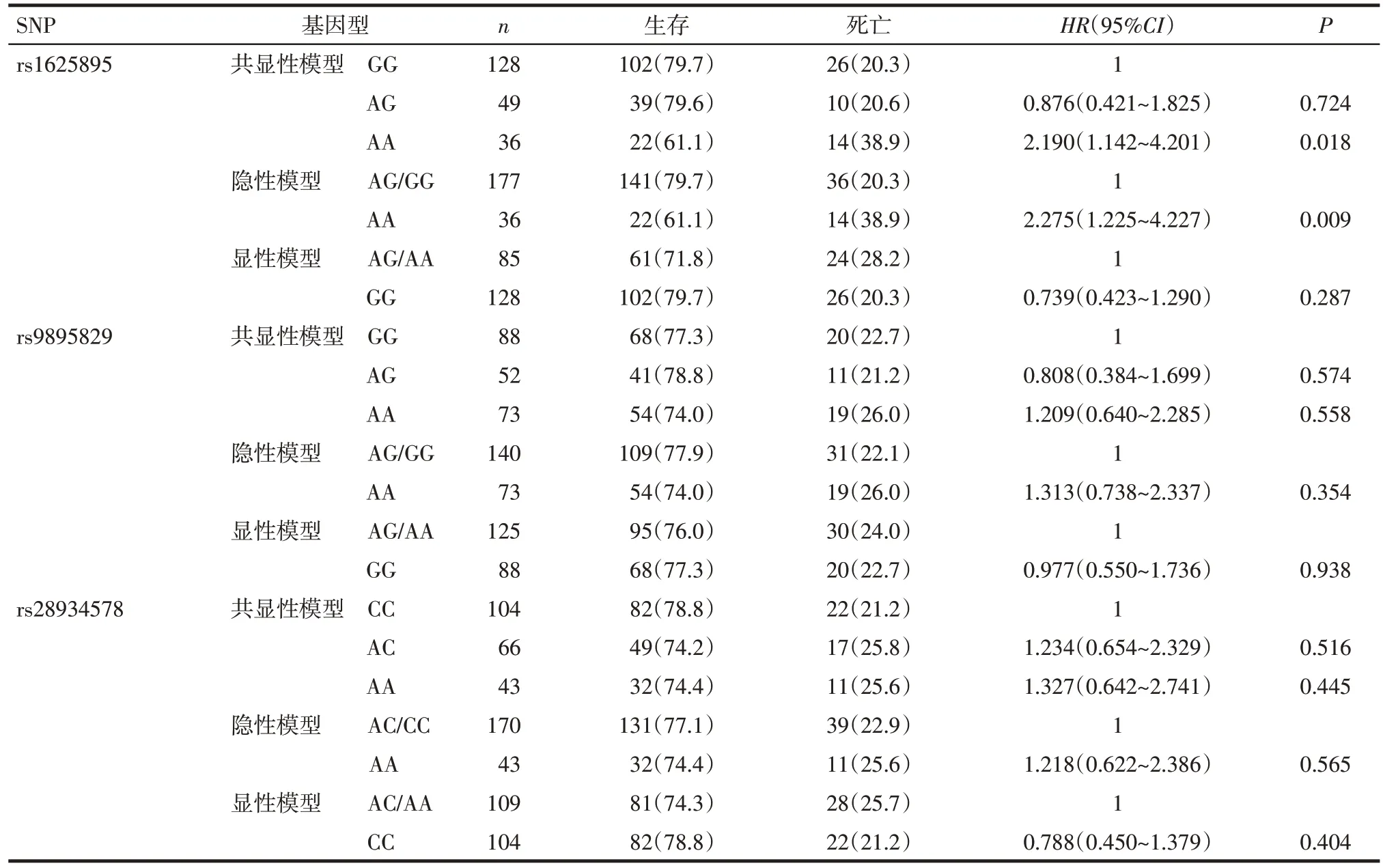
Tab.2 Relationship between TP53 SNPs and the prognosis of hepatocellular carcinoma patients表2 TP53 SNPs与HCC患者预后的关系[例(%)]
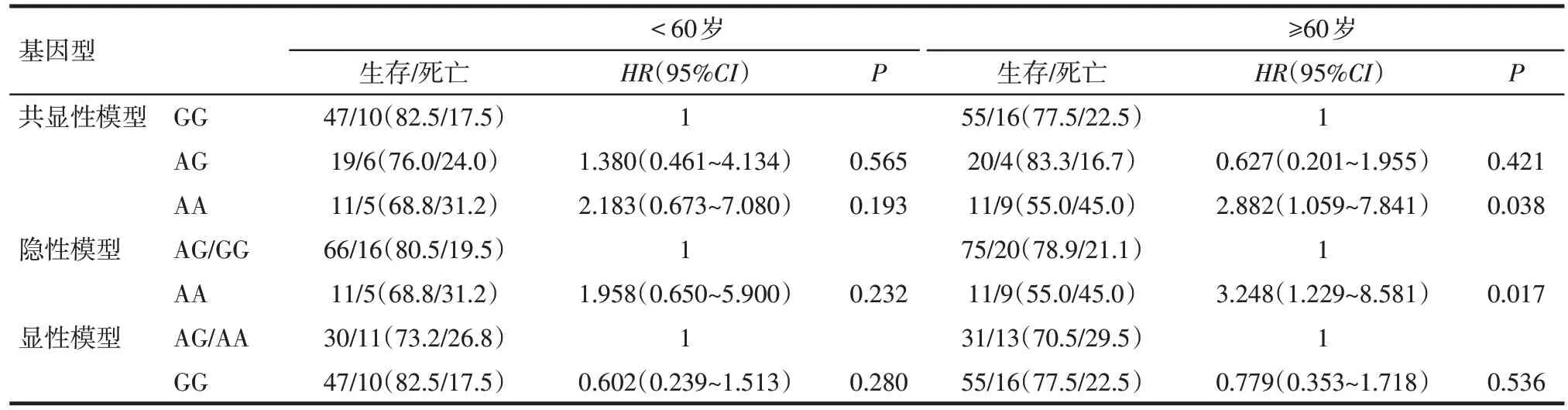
Tab.3 Relationship between TP53 gene rs1625895 and prognosis of HCC patients after age stratification表3 年龄分层后TP53基因rs1625895位点多态性与HCC患者预后的关系[例(%)]
2.3 HCC预后的影响因素分析 采用多因素Cox回归分析影响HCC 患者术后预后的独立因素。变量赋值:肿瘤T 分期(T1+T2=0,T3+T4=1);肿瘤大小(<5 cm=0,≥5 cm=1);rs1625895(AG/GG=0,AA=1);手术方式(根治性切除=0,姑息性切除=1);围术期输血(否=0,是=1);肿瘤数目(单发=0,多发=1);肝硬化(否=0,是=1)。结果显示肿瘤T3+T4 分期、肿瘤直径≥5 cm、TP53rs1625895 AA 基因型、肿瘤姑息性切除、围术期输血、肿瘤多发以及患有肝硬化是影响肝癌预后的独立危险因素,见表4。
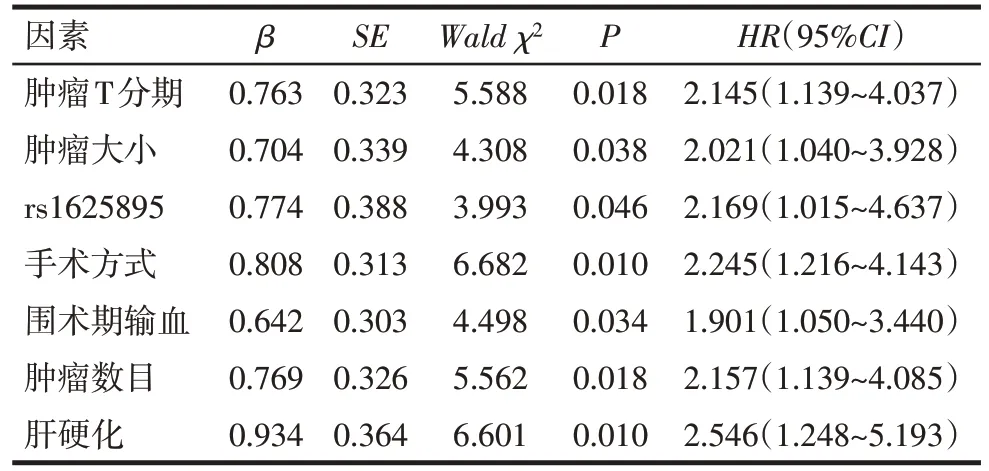
Tab.4 Cox regression analysis of the prognosis of hepatocellular carcinoma patients表4 HCC患者预后多因素Cox比例风险回归结果
3 讨论
本研究探讨TP53基因多态性与HCC 预后的关系,结果显示rs1625895位点多态性与肝癌术后生存期相关,AA 基因型患者较AG/GG 基因型患者术后预后更差,这一情况在年龄≥60岁人群中更为明显。
3.1TP53基因SNP研究现状TP53基因SNP在多个与癌症相关的途径中发挥核心作用[12]。p53通路里存在许多涉及不同肿瘤且功能复杂的SNP 位点,它们结构变异或异常表达能不同程度地影响肿瘤的发生发展,最终影响患者预后并体现于患者的生存周期上。目前已证实TP53基因多态性位点与多种肿瘤预后相关。Assad Samani 等[13]研究发现,在伊朗人群中,rs1625895位点携带A等位基因的乳腺癌患者早期死亡风险是携带G 等位基因患者的3 倍。Voropaeva 等[14]研究发现,rs1625895 多态性会影响弥漫性大B 细胞淋巴瘤患者化疗方案的治愈率,大大降低患者生存周期。在TP53基因多态性与低位直肠癌的生物学行为相关研究中,Zhang等[15-16]发现p53蛋白表达受TP53基因rs1042522多态性影响,这使得肿瘤更快发展到晚期,间接缩短了患者的生存期。
3.2TP53基因SNP 与HCC 的关系 本研究发现TP53基因rs1625895位点多态性与肝癌术后人群生存周期相关。rs1625895 位于TP53基因第6 内含子上,由等位基因A和G组成,该区域的SNP通常会影响TP53mRNA 的加工(如剪接)步骤及DNA 链和蛋白分子之间的相互作用,同时引起细胞DNA 损伤修复及凋亡能力下降,加速肿瘤细胞的发生发展[13,17-18]。TP53基因该点的多态性是因限制性内切酶MspI上的鸟嘌呤与腺嘌呤之间的替换所引起的,这会影响到限制性内切酶的正常功能,进而导致TP53基因表达减少,并可能破坏细胞周期停滞和凋亡所需的靶基因转录激活的过程[19]。特别是当这种突变与有缺陷的肿瘤抑制因子或纺锤体检查位点相结合时,更容易引起基因组不稳定[20-21]。有研究表明TP53基因该位点的多态性可能会让其失去抑制肿瘤的功能,相反会获得一种推进肿瘤发生发展的新能力。杨怡等[22]研究发现TP53基因的变异会促进血管新生,肝脏肿瘤病灶转移发生率增高,肿瘤更具侵袭性,最终使得患者的生存周期明显缩短。同时有研究发现肝癌组织学分级不光与TP53基因突变有关,突变患者的总体生存期、疾病特异性生存期、无进展生存期和无病生存期也明显差于无突变的患者[6]。
3.3 HCC预后的影响因素 本研究多因素Cox回归分析结果显示,肿瘤T3+T4分期、肿瘤直径≥5 cm、肿瘤姑息性切除、围术期输血、肿瘤多发及患有肝硬化同样是影响肝癌患者术后预后的独立危险因素。分析其原因如下:(1)T分期较晚的患者往往肝功能已严重受损,行肝切除术时会增大术中大出血及术后出现肝功能衰竭的风险[23]。(2)肿瘤大小和微血管侵袭之间存在显著的关联,即肿瘤体积较大者发生术后腹腔转移风险高,从而降低了患者生存期[24]。(3)多发肿瘤较单发肿瘤更易转移,同时多发肿瘤更易导致抑制肝癌细胞生长和侵袭的基因突变[25]。(4)肝硬化常伴有凝血功能的异常,这不仅增加出血风险同时还增大了手术难度[26]。(5)根治性肝切除的患者残存肝脏的负荷会增大,而姑息性手术的患者则会因残留的癌细胞导致肿瘤复发[27]。(6)围术期输血会降低机体外周血淋巴细胞数量,降低免疫功能,可能会增加残余肝脏内新生肿瘤的复发[28]。
综上所述,本研究发现TP53基因rs1625895 位点与HCC患者术后的预后相关,尤其对老年群体术后OS影响更大。但同时也存在一定局限性,SNP位点分布频率可能会受到地域、人种等因素的影响,进而导致结果的偏差。本研究样本量相对较小,今后将增大样本量并采用前瞻性研究进一步证实。目前关于TP53基因多态性与HCC 预后的报道相对较少,其中的分子机制还尚未完全阐明,对于未来肝癌相关基因多态性位点研究的方向,功能验证将是重要的一环,这需要进一步深入探究。
