茶黄素调节Snail/Slug信号通路对口腔鳞癌细胞生物学行为的影响
2023-11-15孙绪高杨文超刘彦杰杨旭
孙绪高,杨文超,刘彦杰△,杨旭
口腔鳞癌(oral squamous cell carcinoma,OSCC)是常见的头颈部恶性肿瘤,具有易复发、侵袭及淋巴结转移等特点,患者生存率低且临床预后差,严重影响患者口咽部、喉部等生理功能及生命安全[1-2]。茶黄素是红茶中的酚类成分,体内外研究显示其具有明显的抗癌潜力,可抑制多种癌细胞的增殖、存活和迁移,同时促进癌细胞凋亡[3],如诱导鼻咽癌细胞自噬与凋亡[4],并逆转无机砷引起的表观遗传改变,从而预防皮肤侵袭性鳞状细胞癌发生[5]。因此笔者推测茶黄素可能对OSCC具有抗癌功效。Snail、Slug是调控上皮间质转化的转录因子,上调其表达可促进胰腺癌细胞迁移、黏附和侵袭[6],下调其表达能抑制胃癌细胞上皮间质转化、侵袭、迁移、增殖、肿瘤生长和淋巴结转移[7]。临床研究显示,Snail、Slug 高表达与口咽鳞状细胞癌淋巴血管浸润、淋巴结转移相关[8]。Snail、Slug在OSCC患者肿瘤细胞核中呈现阳性表达,并与其淋巴结转移和临床分期相关[9],由此可知Snail/Slug是OSCC的潜在治疗靶点。本文基于Snail/Slug信号,探究茶黄素对OSCC细胞增殖、凋亡和上皮间质转化的影响。
1 材料与方法
1.1 动物与细胞 SPF 级裸鼠购自厦门大学,生产许可证号:SCXK(闽)2018-0003,雄性,5 周龄左右,体质量18~22 g,分笼饲养在漯河医学高等专科学校第一附属医院动物房中(每笼≤4 只),房内饲养条件:温度23~25 ℃,湿度55%~65%,通风换气8~10次/h。人OSCC细胞SCC-25购自上海泽叶生物科技有限公司。
1.2 试剂与仪器 茶黄素(纯度:HPLC≥98%,货号IT0600)、MTT试剂盒、DMEM/F12基础培养基、Trizol、基底胶购自北京索莱宝科技有限公司;脂质体高效转染试剂、一步法反转录荧光定量试剂盒、Annexin V 凋亡检测试剂盒(FITC/PI 双染法)、Snail 过表达质粒、空载质粒、β-actin 与Snail、Slug 引物均购自生工生物工程(上海)股份有限公司;兔抗人Snail 抗体、β-actin 抗体、Slug 抗体以及辣根过氧化物酶标记山羊抗兔IgG 二抗购自英国Abcam 公司;结晶紫染色液,兔抗人E-钙黏蛋白(E-cadherin)抗体、B 淋巴细胞瘤-2(Bcl-2)抗体、Bcl-2相关X蛋白(Bax)抗体、胞质紧密粘连蛋白1(ZO-1)抗体、N-钙黏蛋白(N-cadherin)抗体均购自上海碧云天生物技术有限公司。
FK-SY96A酶标仪购自山东方科仪器有限公司;MA6000实时荧光定量PCR(qPCR)检测仪购自广东正一实验装备有限公司;DxP Athena流式细胞仪购自青岛佳鼎分析仪器有限公司;IMMOILF30 倒置生物显微镜购自日本奥林巴斯公司;1658033小型电泳转印系统购自美国Bio-Rad公司。
1.3 方法
1.3.1 MTT法检测不同质量浓度茶黄素处理的SCC-25细胞的存活率 取冻存SCC-25细胞,以39.5 ℃温水浴迅速解冻,置于DMEM/F12完全培养基(DMEM/F12基础培养基+10%胎牛血清+1%双抗)中混匀,接种在25 mm2培养瓶中无菌培养,细胞融合率约为85%时传代。
取96 孔培养板,接种传代SCC-25 细胞,每孔约1×104个细胞,无菌培养36 h后分别以0、25、50、100、150、175 mg/L茶黄素[10]处理,每个处理质量浓度6 个重复孔,并以0 mg/L 茶黄素处理细胞作为对照,并选6个不接种细胞的孔作为空白对照。24 h后加入MTT工作液,按照MTT试剂盒说明书中方法检测各组SCC-25 细胞570 nm 波长处吸光度(A570)后计算其存活率,计算公式为:存活率=(药物处理组A570-空白对照组A570)/(对照组A570-空白对照组A570)×100%,然后绘制各组存活率曲线并计算半数抑制浓度(IC50),选取接近IC50值的茶黄素作用浓度进行后续实验。
1.3.2 分组处理SCC-25 细胞后采集标本 取24 孔培养板,接种传代SCC-25细胞,每孔约1×105个细胞,构建OSCC移植瘤模型。无菌培养36 h 后分为对照组、茶黄素低剂量组、茶黄素高剂量组、茶黄素高剂量+空载组、茶黄素高剂量+Snail过表达组。对照组不进行任何干预,茶黄素低、高剂量组分别以100、150 mg/L茶黄素干预,茶黄素高剂量+空载组、茶黄素高剂量+Snail过表达组以150 mg/L茶黄素干预的同时分别以脂质体转染空载质粒和Snail过表达质粒,具体转染步骤按照试剂说明书中方法操作,各组均干预24 h 后收集细胞沉淀,于-80 ℃保存备用。
1.3.3 qPCR和免疫印迹检测各组SCC-25细胞Snail、Slug表达 qPCR:取1.3.2中各组SCC-25细胞,以Trizol混匀后按照说明书提取总RNA,每组取适量总RNA 及相应引物置于反应预混液中混匀,按照一步法实时荧光定量PCR试剂盒说明书中方法进行qPCR 扩增反应,以β-actin 为内参,所得各组Ct 值采用2-ΔΔCt算法量化Snail、Slug 的相对表达,引物序列见表1。

Tab.1 Primer sequences for qPCR表1 qPCR引物序列
免疫印迹实验:取1.3.2 中各组SCC-25 细胞,以RIPA 裂解液混匀后按照说明书提取总蛋白,采用BCA法测定蛋白浓度后置于100 ℃水浴中变性,每组取15µg 蛋白通过电泳分离,并进行电转将其自分离胶中移到硝酸纤维素膜上。使用5%脱脂奶粉溶液封闭后将Snail、Slug、β-actin蛋白剪下孵育相应一抗,洗涤后孵育辣根过氧化物酶标记山羊抗兔IgG 二抗,洗涤并以化学发光法显色,摄取各蛋白图像后采用Image J软件量化其灰度值,计算各组目的蛋白与内参β-actin灰度值的比值,得到其相对表达水平。
1.3.4 MTT 法和流式细胞术检测各组细胞的增殖及凋亡 MTT 法:取96孔培养板,接种传代SCC-25细胞,每孔约1×104个细胞,无菌培养36 h 后按照1.3.2 中步骤分组处理,24 h后以MTT法检测各组细胞存活率,具体方法参照1.3.1。
流式细胞术:取24孔培养板,接种传代SCC-25细胞,每孔约1×105个细胞,无菌培养36 h后按照1.3.2中步骤分组处理,24 h后收集各组细胞并以PBS洗涤、重悬,计数后每组取约2×105个细胞进行FITC/PI 双染,按照Annexin V 凋亡检测试剂盒说明书操作,最后流式细胞仪检测细胞凋亡率。
1.3.5 细胞划痕与Transwell侵袭实验检测各组SCC-25细胞迁移、侵袭 细胞划痕实验:取24孔培养板,以每孔约1×105个细胞的密度接种传代SCC-25 细胞,无菌培养36 h,按照1.3.2中步骤分组处理后使用无菌直尺及1 mL枪头在每孔中央划一条直线,洗去划痕中细胞后于生物显微镜下采集各组细胞图像并以Image J软件定量其划痕宽度(记为W0h),继续培养24 h后再次采集各组细胞图像并定量其划痕宽度(记为W24h),根据公式(W0h-W24h)/W0h×100%得到各组迁移率。
Transwell 侵袭实验:取24 孔Transwell 培养板,每孔加入适量基底胶于4 ℃包被过夜,以PBS洗涤后备用。取24孔培养板,接种传代SCC-25细胞,每孔约1×105个细胞,无菌培养36 h 后按照1.3.2 中步骤分组处理。24 h 后收集各组细胞沉淀,以PBS 洗涤、不含胎牛血清的DMEM/F12 基础培养基重悬,计数后每组取约2×105个细胞于上述包被过的Transwell培养板上室中接种,同时Transwell 培养板下室中加适量含10%胎牛血清的DMEM/F12完全培养基,继续培养24 h后洗涤并固定下室细胞,孵育结晶紫染色液后洗涤,于生物显微镜下采集各组细胞图像,并以Image J 软件定量其细胞数量作为各组细胞侵袭数。
1.3.6 免疫印迹检测各组SCC-25细胞凋亡及上皮间质转化相关蛋白表达 取1.3.2 中采集的各组SCC-25 细胞,提取其中总蛋白后采用免疫印迹实验检测各组Bcl-2、Bax、ZO-1、E-cadherin、N-cadherin蛋白表达。
1.3.7 构建OSCC移植瘤裸鼠模型并分组处理后检测其肿瘤体积及质量 参考文献[11]构建OSCC 移植瘤裸鼠模型:取传代SCC-25 细胞,以PBS 洗涤、重悬后计数,调整细胞密度获得1×106个/mL 的细胞悬液,于裸鼠右前腋皮下接种SCC-25 细胞悬液,每只100µL,1 周后接种处皮下长出硬质结节表明裸鼠模型构建成功。按照随机数字表法将裸鼠分为对照组、茶黄素低剂量组、茶黄素高剂量组、茶黄素高剂量+空载组、茶黄素高剂量+Snail过表达组。茶黄素低、高剂量组分别腹腔注射20、40µg/kg茶黄素(1次/d,茶黄素溶于生理盐水制为4、8µg/L的溶液,均注射5µL/g)[10],同时于移植瘤处皮下注射生理盐水(2次/周,注射5µL/g);茶黄素高剂量+空载组、茶黄素高剂量+Snail 过表达组裸鼠腹腔注射40µg/kg 茶黄素,同时分别于移植瘤处皮下注射空载质粒、Snail 过表达质粒(2 次/周,均为3µg/g,溶于生理盐水制为0.6 mg/L 的溶液,均注射5µL/g);对照组裸鼠腹腔注射生理盐水(1次/d,生理盐水5µL/g),同时于移植瘤处皮下注射生理盐水(2次/周,注射5µL/g)。各组裸鼠均处理3周,然后颈椎脱臼处死并剪开皮肤,取出肿瘤组织块,称其质量后测量其最长径a及最短径b,根据公式1/2×a×b2计算体积。
1.4 统计学方法 采用GraphPad Prism 8.0软件进行数据分析,计量数据采用均数±标准差()描述,多组间比较进行单因素方差分析,组间多重比较行SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 茶黄素对人OSCC 细胞SCC-25 存活率的影响 与0 mg/L茶黄素相比,25、50、100、150、175 mg/L茶黄素均可降低SCC-25 细胞存活率(P<0.05),且呈剂量依赖性,见图1。本文选择IC50值(132.50 mg/L)附近的100、150 mg/L进行后续实验。
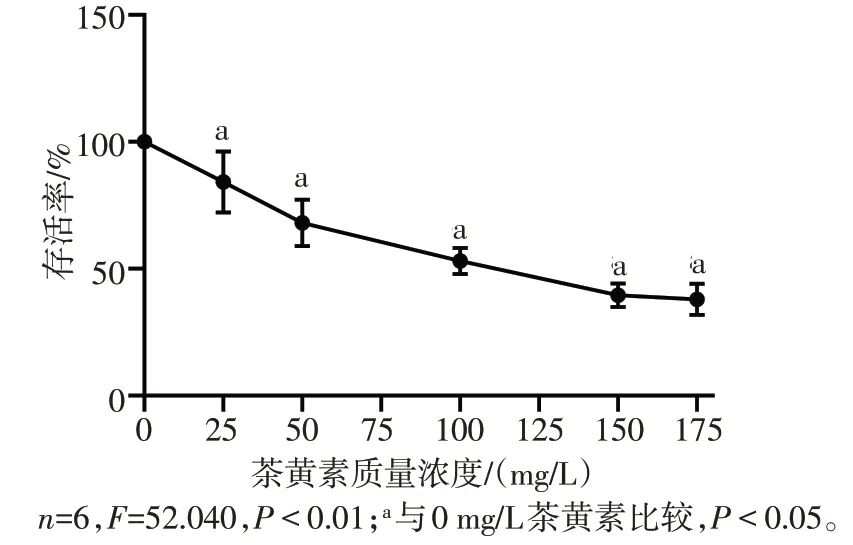
Fig.1 Effects of different concentrations of ttheaflavin on survival rate of SCC-25 cells图1 不同质量浓度茶黄素对SCC-25细胞存活率的影响
2.2 茶黄素对SCC-25 细胞Snail、Slug 表达水平的影响 与对照组相比,茶黄素低剂量组、茶黄素高剂量组细胞Snail、Slug mRNA 及蛋白表达均降低(P<0.05)。与茶黄素高剂量组相比,茶黄素高剂量+空载组细胞Snail、Slug mRNA 及蛋白表达差异无统计学意义(P>0.05),茶黄素高剂量+Snail 过表达组细胞Snail、Slug mRNA 及蛋白表达升高(P<0.05),见图2、表2。
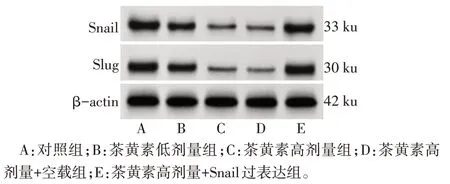
Fig.2 The expression of Snail and Slug proteins in SCC-25 cells in each group detected by immunoblotting图2 免疫印迹检测各组SCC-25细胞Snail、Slug蛋白表达
Tab.2 Comparison of relative expression levels of Snail and Slug in SCC-25 cells between the five groups表2 各组SCC-25细胞Snail、Slug相对表达水平比较(n=6,)
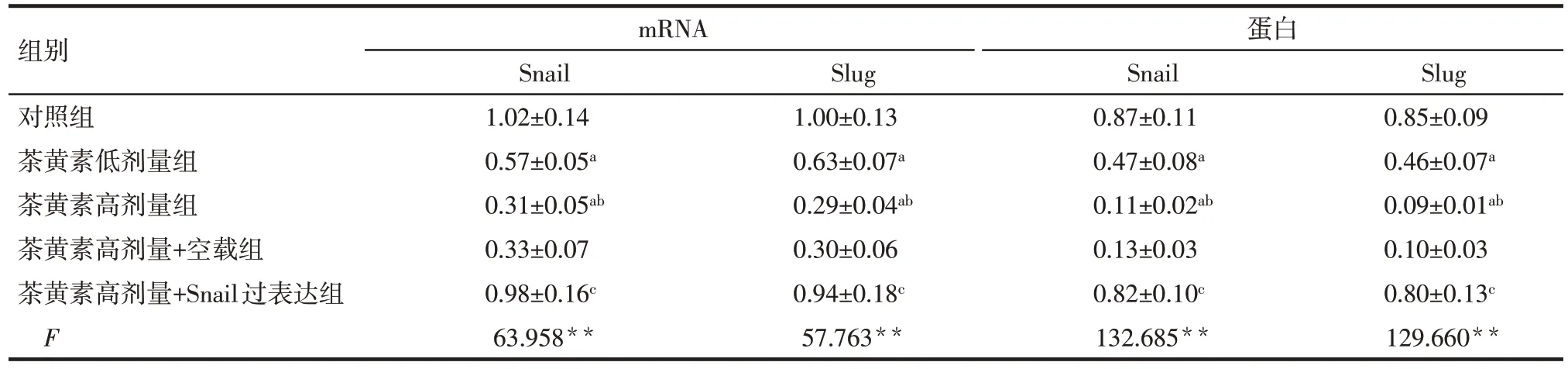
Tab.2 Comparison of relative expression levels of Snail and Slug in SCC-25 cells between the five groups表2 各组SCC-25细胞Snail、Slug相对表达水平比较(n=6,)
**P<0.01;a与对照组比较,b与茶黄素低剂量组比较,c与茶黄素高剂量组比较,P<0.05;表3—6同。
组别对照组茶黄素低剂量组茶黄素高剂量组茶黄素高剂量+空载组茶黄素高剂量+Snail过表达组F mRNA蛋白Snail 1.02±0.14 0.57±0.05a 0.31±0.05ab 0.33±0.07 0.98±0.16c 63.958**Slug 1.00±0.13 0.63±0.07a 0.29±0.04ab 0.30±0.06 0.94±0.18c 57.763**Snail 0.87±0.11 0.47±0.08a 0.11±0.02ab 0.13±0.03 0.82±0.10c 132.685**Slug 0.85±0.09 0.46±0.07a 0.09±0.01ab 0.10±0.03 0.80±0.13c 129.660**
2.3 茶黄素对SCC-25 细胞增殖、凋亡的影响 与对照组相比,茶黄素低剂量组、茶黄素高剂量组细胞存活率均降低,凋亡率均升高(P<0.05)。与茶黄素高剂量组相比,茶黄素高剂量+空载组细胞存活率、凋亡率差异无统计学意义(P>0.05);茶黄素高剂量+Snail 过表达组细胞存活率升高,凋亡率降低(P<0.05)。见图3、表3。
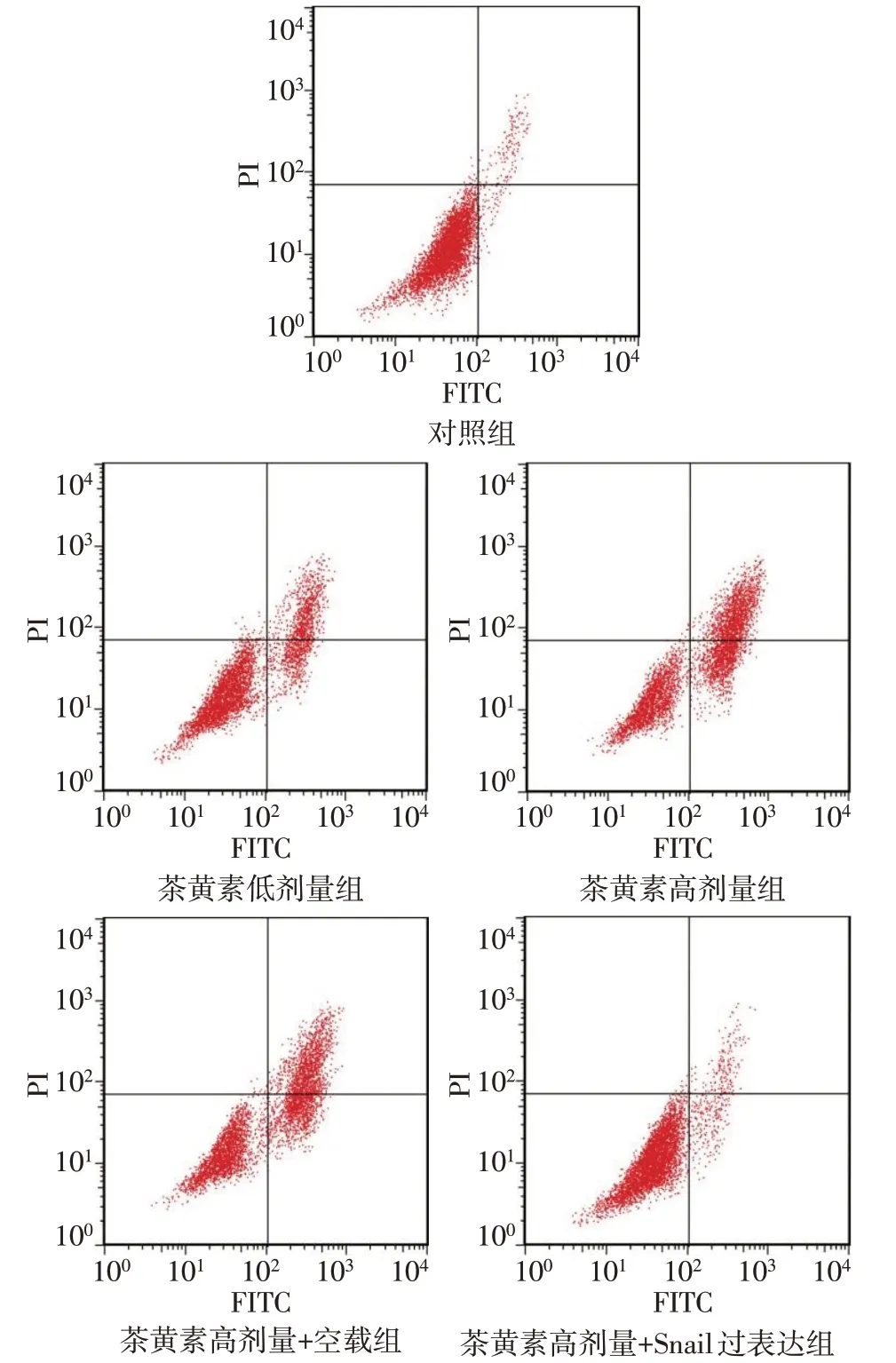
Fig.3 Apoptosis rate of SCC-25 cells in each group detected by flow cytometry图3 流式细胞术检测各组SCC-25细胞凋亡率
Tab.3 Comparison of survival rate and apoptosis rate of SCC-25 cells between the five groups表3 各组SCC-25细胞存活率、凋亡率比较(n=6,%,)
Tab.3 Comparison of survival rate and apoptosis rate of SCC-25 cells between the five groups表3 各组SCC-25细胞存活率、凋亡率比较(n=6,%,)
组别存活率凋亡率对照组茶黄素低剂量组茶黄素高剂量组茶黄素高剂量+空载组茶黄素高剂量+Snail过表达组F 100.00±14.26 61.75±6.20a 34.02±5.32ab 31.46±4.93 93.13±15.41c 57.918**2.71±0.64 39.26±5.17a 64.98±7.28ab 65.17±8.13 5.05±1.28c 191.004**
2.4 茶黄素对SCC-25 细胞迁移、侵袭的影响 与对照组相比,茶黄素低剂量组、茶黄素高剂量组细胞迁移率、侵袭数均降低(P<0.05)。与茶黄素高剂量组相比,茶黄素高剂量+空载组细胞迁移率、侵袭数差异无统计学意义;茶黄素高剂量+Snail 过表达组细胞迁移率、侵袭数升高(P<0.05)。见表4,图4、5。

Fig.4 Migration rate of SCC-25 cells in each group detected by cell scratch test(×200)图4 细胞划痕实验检测各组SCC-25细胞迁移率(×200)
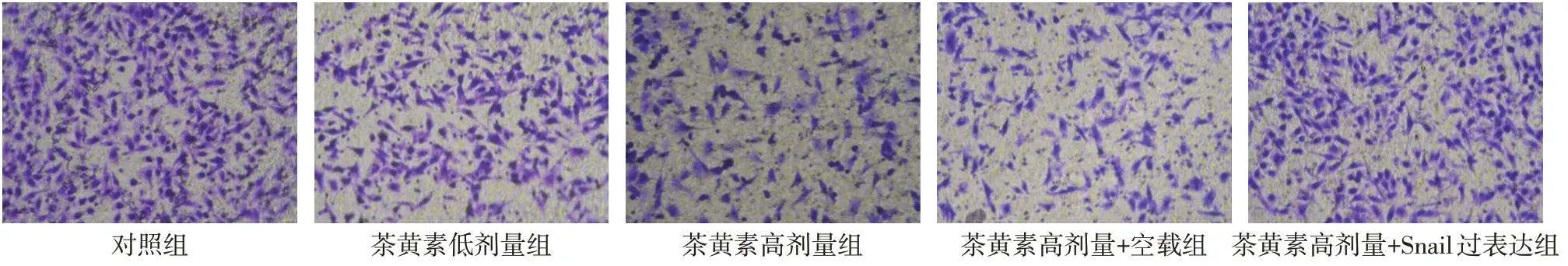
Fig.5 Invasion number of SCC-25 cells in each group detected by Transwell invasion test(crystal violet staining,×200)图5 Transwell侵袭实验检测各组SCC-25细胞侵袭数(结晶紫染色,×200)
Tab.4 Comparison of migration rate and invasion number of SCC-25 cells between the five groups表4 各组SCC-25细胞迁移率、侵袭数比较(n=6,)
Tab.4 Comparison of migration rate and invasion number of SCC-25 cells between the five groups表4 各组SCC-25细胞迁移率、侵袭数比较(n=6,)
组别对照组茶黄素低剂量组茶黄素高剂量组茶黄素高剂量+空载组茶黄素高剂量+Snail过表达组F迁移率/%83.70±12.35 52.53±6.37a 24.64±3.96ab 26.01±4.49 72.98±13.40c 52.681**侵袭数/(个/视野)342.13±45.63 219.25±24.18a 94.82±9.27ab 105.12±11.34 320.56±50.26c 74.663**
2.5 茶黄素对SCC-25细胞凋亡及上皮间质转化相关蛋白表达的影响 与对照组相比,茶黄素低剂量组、茶黄素高剂量组细胞Bcl-2、N-cadherin 蛋白表达均降低(P<0.05),Bax、ZO-1、E-cadherin 蛋白表达均升高(P<0.05)。与茶黄素高剂量组相比,茶黄素高剂量+空载组细胞Bcl-2、N-cadherin、Bax、ZO-1、E-cadherin 蛋白表达差异无统计学意义(P>0.05);茶黄素高剂量+Snail 过表达组细胞Bcl-2、N-cadherin 蛋白表达升高(P<0.05),Bax、ZO-1、E-cadherin蛋白表达降低(P<0.05),见表5、图6。
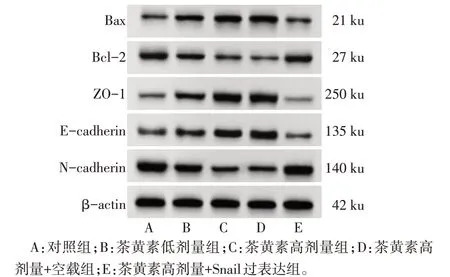
Fig.6 ImmunoblottingresultsofexpressionofSCC-25cellapoptosis and epithelial mesenchymal transformation related proteins in each group图6 免疫印迹检测各组SCC-25细胞凋亡及上皮间质转化相关蛋白表达
Tab.5 Comparison of relative expression levels of SCC-25 cell apoptosis and epithelial mesenchymal transformation related proteins between the five groups表5 各组SCC-25细胞凋亡及上皮间质转化相关蛋白相对表达水平比较(n=6,)
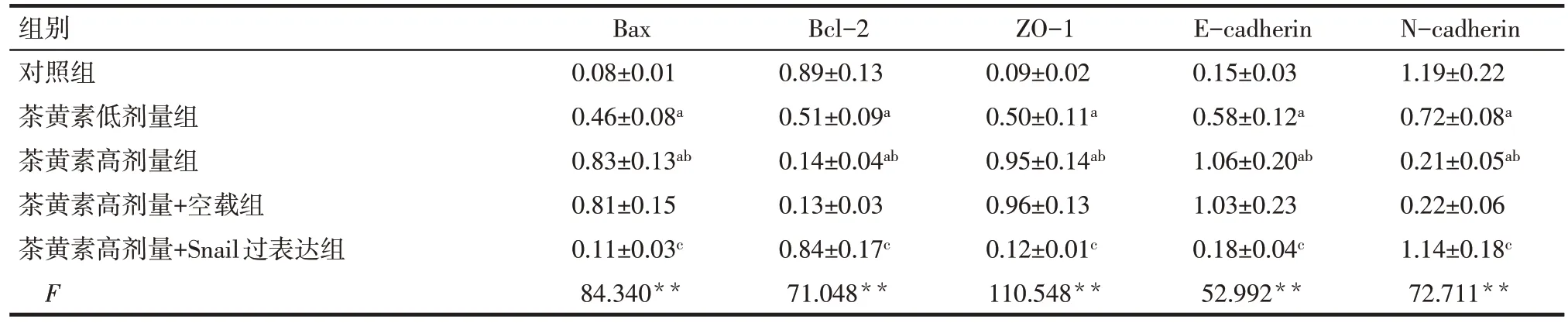
Tab.5 Comparison of relative expression levels of SCC-25 cell apoptosis and epithelial mesenchymal transformation related proteins between the five groups表5 各组SCC-25细胞凋亡及上皮间质转化相关蛋白相对表达水平比较(n=6,)
组别对照组茶黄素低剂量组茶黄素高剂量组茶黄素高剂量+空载组茶黄素高剂量+Snail过表达组F Bax 0.08±0.01 0.46±0.08a 0.83±0.13ab 0.81±0.15 0.11±0.03c 84.340**Bcl-2 0.89±0.13 0.51±0.09a 0.14±0.04ab 0.13±0.03 0.84±0.17c 71.048**ZO-1 0.09±0.02 0.50±0.11a 0.95±0.14ab 0.96±0.13 0.12±0.01c 110.548**E-cadherin 0.15±0.03 0.58±0.12a 1.06±0.20ab 1.03±0.23 0.18±0.04c 52.992**N-cadherin 1.19±0.22 0.72±0.08a 0.21±0.05ab 0.22±0.06 1.14±0.18c 72.711**
2.6 茶黄素对SCC-25 移植瘤裸鼠肿瘤质量、肿瘤体积的影响 与对照组相比,茶黄素低剂量组、茶黄素高剂量组裸鼠肿瘤质量、肿瘤体积均降低(P<0.05)。与茶黄素高剂量组相比,茶黄素高剂量+空载组裸鼠肿瘤质量、肿瘤体积差异无统计学意义(P>0.05),茶黄素高剂量+Snail 过表达组裸鼠肿瘤质量、肿瘤体积升高(P<0.05),见表6。
Tab.6 Comparison of tumor mass and tumor volume of SCC-25 transplanted tumor in nude mice between the five groups表6 各组SCC-25移植瘤裸鼠肿瘤质量、肿瘤体积比较(n=10,)
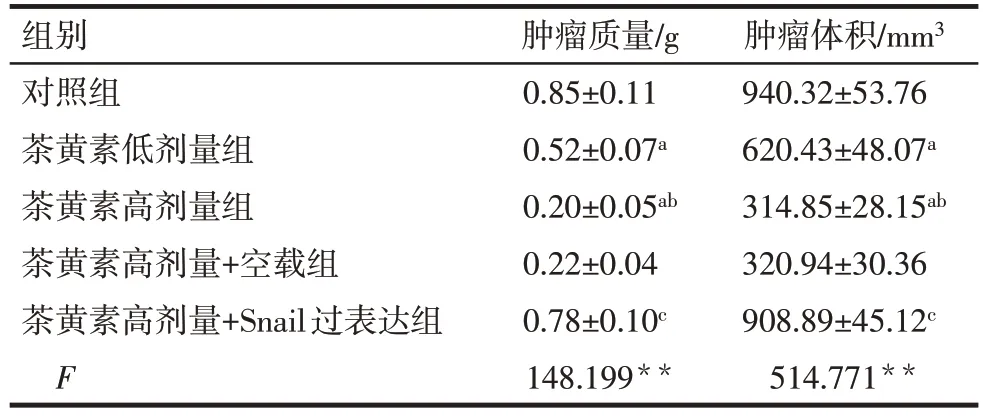
Tab.6 Comparison of tumor mass and tumor volume of SCC-25 transplanted tumor in nude mice between the five groups表6 各组SCC-25移植瘤裸鼠肿瘤质量、肿瘤体积比较(n=10,)
组别对照组茶黄素低剂量组茶黄素高剂量组茶黄素高剂量+空载组茶黄素高剂量+Snail过表达组F肿瘤质量/g 0.85±0.11 0.52±0.07a 0.20±0.05ab 0.22±0.04 0.78±0.10c 148.199**肿瘤体积/mm3 940.32±53.76 620.43±48.07a 314.85±28.15ab 320.94±30.36 908.89±45.12c 514.771**
3 讨论
OSCC 的临床治疗策略主要是手术切除辅以局部放疗、全身化疗等,但由于癌组织靠近上呼吸道、颅脑等重要器官,且易发生浸润和转移,手术难以完全清除肿瘤组织,易于复发,患者的生存率、生活质量和生命健康并不能达到理想预期,因此,还需探寻新型药物以改善OSCC 的治疗效果[12-14]。茶黄素是提取自红茶的多酚类物质,具有明显的抗肿瘤活性,可诱导活性氧生成,从而导致卵巢癌细胞凋亡[15],还可通过抑制人类乳头瘤病毒E6 癌蛋白表达对宫颈鳞状细胞癌起到潜在抗癌作用[16],并可抑制肺腺癌细胞的增殖和迁移[17]。本研究以25、50、100、150、175 mg/L 茶黄素处理人OSCC 细胞SCC-25,均可降低其存活率,呈剂量依赖性,表明茶黄素可抑制OSCC细胞生长,且浓度越高,其抑制作用越强;以不同剂量茶黄素处理SCC-25 细胞及其移植瘤裸鼠模型,可上调细胞Bax 及ZO-1、E-cadherin 蛋白表达,下调Slug 及Bcl-2、N-cadherin 蛋白表达,促进细胞凋亡,并抑制其增殖及上皮间充质转化,进而降低其迁移及侵袭能力;以不同剂量茶黄素处理SCC-25移植瘤裸鼠模型,可降低裸鼠肿瘤质量及体积,提示茶黄素可抑制OSCC 细胞在体内外的增殖并促进其凋亡,降低其迁移、侵袭能力及体内成瘤性,发挥抗癌功效,剂量越高,功效越强,揭示茶黄素在OSCC 临床治疗中具有应用前景。
上皮间充质转化是启动细胞进展、侵袭和转移的关键步骤之一,Snail/Slug 作为调控该过程的重要信号通路,参与包括乳腺癌在内的多种癌细胞的生长、运动、转移及侵袭,下调该通路蛋白表达可抑制肝细胞癌细胞上皮间质转化、生长和侵袭[18-19]。研究显示,Snail、Slug 在OSCC 患者肿瘤细胞中呈高表达[9],另外Slug 在犬OSCC 组织中表达上调,可促进其迁移和侵袭[20]。因此,Snail/Slug 可能成为OSCC的潜在治疗靶点。本文以100、150 mg/L茶黄素处理SCC-25 细胞,均可降低其Snail 及Slug 蛋白表达,表明Snail/Slug参与茶黄素对OSCC细胞上皮间充质转化、迁移、侵袭、增殖与裸鼠移植瘤体内生长的抑制过程;以茶黄素和Snail 过表达质粒联合处理SCC-25 细胞及其裸鼠移植瘤模型,相比茶黄素单独处理,过表达Snail 可减弱茶黄素对OSCC 细胞上皮间充质转化、迁移、侵袭与增殖的抑制作用,消除茶黄素对OSCC 细胞凋亡的促进作用,最终逆转茶黄素对OSCC的抗癌功效,揭示茶黄素抑制OSCC细胞增殖、迁移、侵袭和上皮间质转化,延缓裸鼠移植瘤的生长是通过下调Snail实现的。
综上所述,茶黄素可抑制OSCC 细胞上皮间质转化、增殖、迁移、侵袭及在裸鼠移植瘤生长,并促进其凋亡,发挥抗癌功效。
