乳腺癌细胞培养上清液促进人脂肪间充质干细胞迁移和增殖的机制探讨
2023-11-15刘丹阳王璐璐何军姜杨李永涛张晓东李鹏辉沈雷
刘丹阳,王璐璐,何军,姜杨,李永涛,张晓东,李鹏辉,沈雷△
乳腺癌是严重危害女性健康的恶性肿瘤,其中三阴性乳腺癌(TNBC)尚无针对性的治疗方案,具有高侵袭性、易复发的特点[1-2]。由细胞因子、趋化因子、干细胞和成纤维细胞等构成的肿瘤微环境是肿瘤生长和转移的基础,探讨TNBC 微环境的构成特点对遏制TNBC 的发生、发展具有重要意义。乳腺由腺泡及其周围丰富的脂肪组织构成。人体脂肪组织含有丰富的人脂肪间充质干细胞(hAdMSC),能够促进乳腺癌细胞形成肿瘤球,表现出较好的肿瘤趋向性,但其机制尚不明确[3]。干细胞既有抗肿瘤价值,也具有潜在的致癌风险[4]。源自前列腺癌细胞Du145的外泌体可促进骨髓间充质干细胞分化为肌成纤维细胞,并提高肌成纤维细胞的增殖和侵袭能力[5]。局部组织环境内的干细胞、血管内皮细胞能够向趋化因子浓度高的地方迁移[6]。白细胞介素(IL)-8 与膀胱癌、卵巢癌、结肠癌等恶性肿瘤的发生、转移及复发密切相关[7]。研究发现,肿瘤相关巨噬细胞表达IL-8,促进乳腺癌转移,IL-8 表达水平与肝癌细胞恶性程度呈正相关[8-9]。IL-8 等趋化因子和间充质干细胞在构成肿瘤微环境、调控肿瘤生长或转移中均发挥关键作用。目前,TNBC肿瘤细胞招募hAdMSC到肿瘤微环境并影响肿瘤进展的分子机制尚不明确。MDA-MB-231细胞是TNBC代表性细胞[10]。本实验以MDA-MB-231 细胞培养上清液刺激hAdMSC,观察趋化因子受体1/2(CXCR1/2)-Akt-mTOR信号轴对hAdMSC迁移、增殖及凋亡的影响,为遏制TNBC发生、发展提供参考。
1 材料与方法
1.1 主要材料 MDA-MB-231细胞购自美国细胞培养物收藏中心(ATCC),hAdMSC 购自广州赛业生物科技有限公司。胎牛血清购自美国Gibco 公司。Leibovitz's L-15 和RPMI-1640 培养基均购自美国Hyclone 公司。蛋白激酶B(Akt)抑制剂GSK690693 购自美国Selleck 公司,Reparixin(CXCR1/2抑制剂)购自美国Med Chem Express 公司。CCK-8试剂购自日本Dojindo 公司。聚偏二氟乙烯膜(PVDF)、BCA 蛋白检测试剂盒和Annexin V-FITC/PI 双标记流式细胞凋亡试剂盒购自上海碧云天生物科技公司。兔抗人哺乳动物雷帕霉素靶蛋白(mTOR)和磷酸化mTOR(p-mTOR)抗体、兔抗人Akt 和磷酸化Akt(p-Akt)抗体、兔抗人甘油醛-3-磷酸脱氢酶(GAPDH)抗体、辣根过氧化物酶(HRP)标记山羊抗兔IgG二抗购自英国Abcam 公司。SpectraMax iD3 酶标仪购自美国Molecular Devices公司;Tanon 6200型发光成像仪购自上海天能公司;FACSAriaⅡ流式细胞仪购自美国BD公司;IX53倒置荧光显微镜购自日本Olympus公司。
1.2 细胞培养 MDA-MB-231 细胞用含10%胎牛血清的Leibovitz's L-15 培养基培养。hAdMSC 用含10%胎牛血清、100 mg/L 链霉素与100 U/mL 青霉素的RPMI-1640 培养基培养。2 种细胞均采用对数生长期状态良好的细胞进行实验,实验期间细胞均没有出现污染或衰老等现象。
1.3 实验方法
1.3.1 hAdMSC 培养与分组 将5.5×106个MDA-MB-231 细胞37 ℃、5%CO2培养12 h 后吸出细胞培养上清液,800 r/min离心5 min 后提取上清液,针筒式滤器抽滤,于-80 ℃保存待用。将MDA-MB-231细胞上清液和不含胎牛血清的RPMI-1640培养基以1∶4的体积比混匀后培养的hAdMSC为MDAMB-231上清液组。向MDA-MB-231上清液组添加10µmol/L Reparixin 为CXCR1/2 抑制剂组;向MDA-MB-231 上清液组添加10 nmol/L GSK690693 为Akt 抑制剂组。无任何刺激进行培养的hAdMSC为对照组。
1.3.2 细胞划痕实验检测各组hAdMSC的迁移能力 将3.5×105个/孔hAdMSC 接种于6 孔细胞培养板中,37 ℃、5%CO2培养24 h。无菌200µL 移液器吸头进行划痕。0.05 mmol/L 磷酸盐缓冲液(PBS)清洗3 次,每次1 min。根据hAdMSC 实验分组添加相应试剂,37 ℃、5%CO2环境下培养。IX53 倒置显微镜拍摄0 h、24 h及48 h的划痕图像,实验重复3次。Image J 1.8.0图像软件测量细胞划痕闭合面积。
1.3.3 CCK-8实验检测各组hAdMSC增殖情况 将hAdMSC以5×103个/孔接种到96 孔细胞培养板,37 ℃、5%CO2培养48 h,每孔加入10µL CCK-8 试剂,继续培养4 h,实验重复3次。SpectraMax iD3酶标仪于450 nm波长处检测各组样品吸光度(A450)值[11],A450值代表细胞增殖水平。
1.3.4 Annexin V-FITC/PI 双标记流式细胞凋亡实验检测各组hAdMSC 的凋亡率 以0.25%胰酶消化各组hAdMSC。1 000 r/min离心5 min,弃上清液;冰浴下,195µL Annexin VFITC结合液重悬细胞,5µL Annexin V-FITC和10µL碘化丙啶(propidium iodide,PI)室温避光孵育20 min,实验重复3次。FACSAriaⅡ流式细胞仪测定各组细胞凋亡率。
1.3.5 Western blot 检测各组hAdMSC 的mTOR/p-mTOR 和Akt/p-Akt 蛋白表达 将4.5×106个/孔hAdMSC 于37 ℃、5%CO2培养12 h。4 ℃下RIPA 裂解液裂解各组hAdMSC,12 000 r/min 离心60 min。BCA 蛋白浓度测定试剂盒测定各组细胞裂解液蛋白浓度。80 V电泳30 min;120 V电泳45 min。75 V 转膜120 min 到PVDF 膜。5%脱脂奶粉封闭PVDF 膜120 min。分别添加兔抗人p-mTOR 抗体(1∶600)、mTOR 抗体(1∶550)、p-Akt 抗体(1∶500)、Akt 抗体(1∶350)和GAPDH抗体(1∶1 000),4 ℃孵育16 h。HRP 标记山羊抗兔IgG(1∶500)4 ℃孵育2 h。发光成像仪显影曝光,各实验重复3 次。Image J 1.8.0图像分析软件计算各蛋白条带灰度值。
1.4 统计学方法 采用GraphPad Prism 8.0.2 软件进行数据分析。符合正态分布的计量资料以表示,多组间比较采用单因素方差分析,组间多重比较采用Tukey-q检验。P<0.05为差异有统计学意义。
2 结果
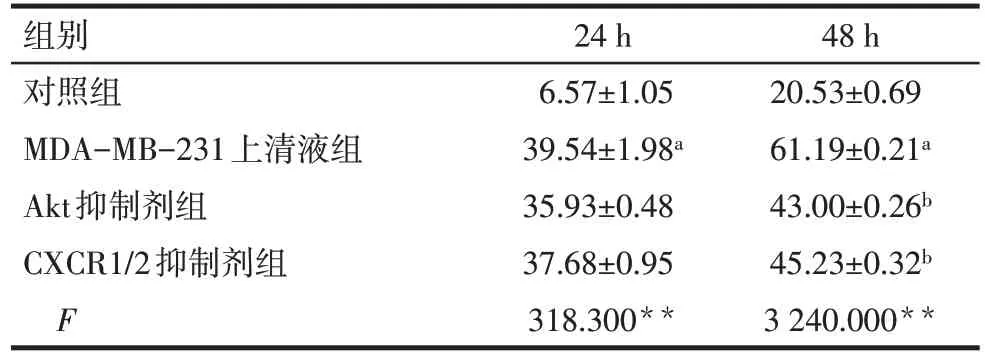
2.1 各组hAdMSC 迁移能力比较 与对照组比较,MDA-MB-231 上清液组24 h 和48 h 细胞划痕闭合面积增加(P<0.05);与MDA-MB-231 上清液组比较,Akt 抑制剂组和CXCR1/2 抑制剂组hAdMSC 的48 h细胞划痕闭合面积减少(P<0.05),见表1、图1。

Fig.1 Typical images of hAdMSC cell scratches in each group(Scale bar=100µm)图1 各组hAdMSC细胞划痕的典型图像(标尺=100µm)
Tab.1 Comparison of cell scratch closure area of hAdMSC between the four groups表1 各组hAdMSC的细胞划痕闭合面积比较(n=3,×104µm2,)
Tab.1 Comparison of cell scratch closure area of hAdMSC between the four groups表1 各组hAdMSC的细胞划痕闭合面积比较(n=3,×104µm2,)
**P<0.01;a 与对照组比较,b 与MDA-MB-231 上清液组比较,P<0.05;表2同。
组别对照组MDA-MB-231上清液组Akt抑制剂组CXCR1/2抑制剂组F 24 h 6.57±1.05 39.54±1.98a 35.93±0.48 37.68±0.95 318.300**48 h 20.53±0.69 61.19±0.21a 43.00±0.26b 45.23±0.32b 3 240.000**
2.2 各组hAdMSC 增殖情况比较 与对照组比较,MDA-MB-231 上清液组hAdMSC 的增殖水平升高(P<0.05);与MDA-MB-231 上清液组比较,Akt 抑制剂组和CXCR1/2抑制剂组hAdMSC的增殖水平均降低(P<0.05),见图2。
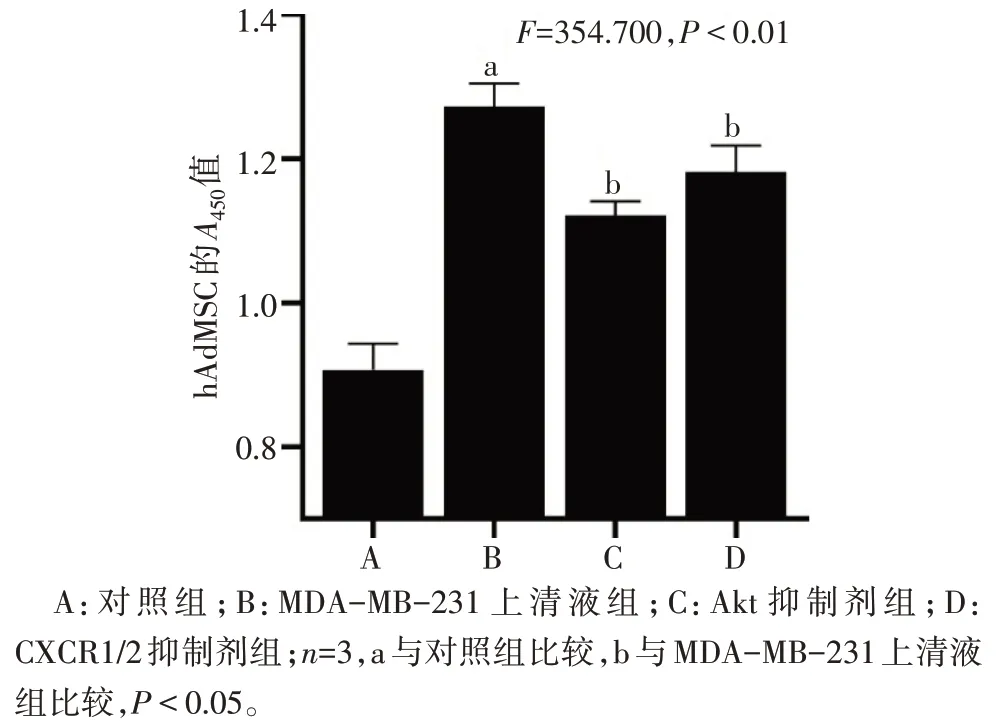
Fig.2 Histogram of hAdMSC A450 in each group图2 各组hAdMSC的A450比较柱状图
2.3 各组hAdMSC 凋亡率比较 与对照组比较,MDA-MB-231 上清液组hAdMSC 凋亡率降低(P<0.05);与MDA-MB-231 上清液组比较,Akt 抑制剂组和CXCR1/2抑制剂组hAdMSC凋亡率均增加(P<0.05),见图3、4。
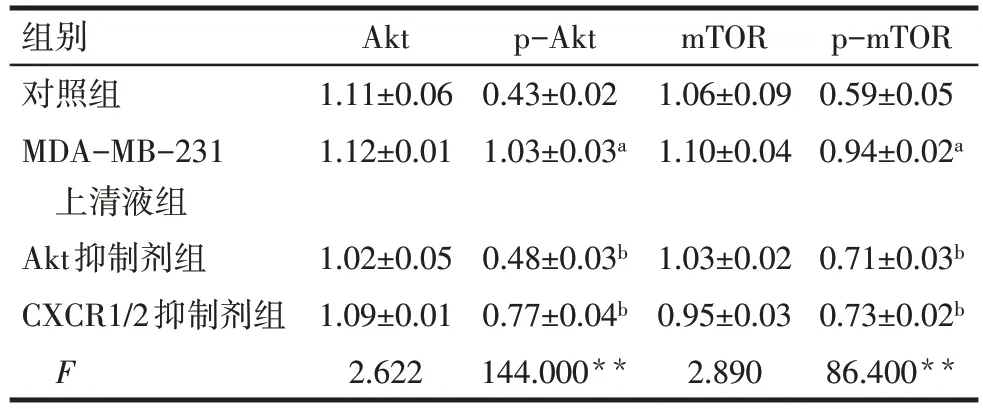
2.4 各组Akt、p-Akt、mTOR和p-mTOR蛋白表达比较 与对照组比较,MDA-MB-231 上清液组p-Akt和p-mTOR 蛋白相对表达量均增加(P<0.05);与MDA-MB-231 上清液组比较,Akt 抑制剂组和CXCR1/2 抑制剂组hAdMSC 的p-Akt 和p-mTOR 蛋白相对表达量均降低(P<0.05),见图5、表2。
Tab.2 Comparison of the relative expression levels of Akt,p-Akt,mTOR and p-mTOR hAdMSC between the four groups表2 各组hAdMSC的Akt、p-Akt、mTOR、p-mTOR蛋白相对表达量比较(n=3,)
Tab.2 Comparison of the relative expression levels of Akt,p-Akt,mTOR and p-mTOR hAdMSC between the four groups表2 各组hAdMSC的Akt、p-Akt、mTOR、p-mTOR蛋白相对表达量比较(n=3,)
组别对照组MDA-MB-231上清液组Akt抑制剂组CXCR1/2抑制剂组F Akt 1.11±0.06 1.12±0.01 p-Akt 0.43±0.02 1.03±0.03a mTOR 1.06±0.09 1.10±0.04 p-mTOR 0.59±0.05 0.94±0.02a 1.02±0.05 1.09±0.01 2.622 0.48±0.03b 0.77±0.04b 144.000**1.03±0.02 0.95±0.03 2.890 0.71±0.03b 0.73±0.02b 86.400**
3 讨论
具有多向分化特性的间充质干细胞迁移到肿瘤部位可分化为肿瘤相关成纤维细胞(CAF),从而促进肿瘤发展及转移[12-13]。干扰间充质干细胞归巢到肿瘤微环境可抑制乳腺癌发生、发展。IL-8 能够与细胞膜表面的CXCR1/2 受体结合,发挥促进血管生成、肿瘤干细胞存活等促肿瘤生长功能[14]。Fernando 等[15]发现,MCF-7、T47D、BT474、MDAMB-231和MDA-MB-436等多种乳腺癌细胞系高表达IL-8,可诱导肿瘤微环境的细胞发生上皮-间质转化(EMT)而促进肿瘤进展。Alraouji 等[16]发现,TNBC 细胞分泌高水平IL-8,活化血管内皮细胞IL-8/信号转导子和转录激活子3(STAT3)-核因子κB(NF-κB)通路,促进肿瘤组织血管生成并有利于TNBC 细胞的生长和转移。本研究结果亦显示,MDA-MB-231 上清液组hAdMSC 的24 h、48 h 细胞划痕闭合面积较对照组增加,而CXCR1/2 抑制剂组和Akt 抑制剂组hAdMSC 的48 h 细胞划痕闭合面积较MDA-MB-231上清液组减小,表明MDA-MB-231培养上清液可激活hAdMSC 的Akt-mTOR 信号通路,促进hAdMSC 迁移,从而促进hAdMSC 归巢到乳腺癌微环境。考虑其可能原因为不断生长的MDAMB-231 细胞高表达IL-8,活化Akt 信号通路,从而促进细胞微管或微丝收缩形成伪足,引起细胞定向迁移[17]。
Morein等[18]认为,IL-6、IL-8等趋化因子在乳腺癌等恶性肿瘤中高表达,具有促癌作用,能降解细胞外基质、促进间充质干细胞归巢和肿瘤血管生成。Jin等[19]发现,MDA-MB-231细胞的培养上清液富含IL-8、肿瘤坏死因子等趋化因子和细胞因子,可诱导成纤维细胞分化为CAF,促进TNBC 细胞迁移和增殖,降低肿瘤细胞凋亡,是肿瘤转移的关键步骤。本研究结果亦显示,MDA-MB-231上清液组较对照组hAdMSC 的增殖水平升高,细胞凋亡率降低,Akt 抑制剂组或CXCR1/2 抑制剂组较MDA-MB-231 上清液组上述指标均呈相反变化,表明MDA-MB-231细胞上清液中的IL-8 可激活Akt 信号通路,具有促进hAdMSC 增殖,减少hAdMSC 凋亡的能力,提示抑制IL-8表达或阻断CXCR1/2可成为靶向抗TNBC的潜在疗法。考虑原因为MDA-MB-231 细胞上清液中高表达的IL-8、CC 趋化因子配体2(CCL2)和CCL5等促癌趋化因子可缩短hAdMSC 细胞周期,促进hAdMSC 增殖[15,18]。另有一些研究认为,IL-8 与hAdMSC 表面的CXCR1/2 结合,通过激活磷脂酰肌醇3-激酶(PI3K)-AKT-mTOR 信号通路,诱导肿瘤微环境的细胞发生EMT 表型变化,从而促进TNBC血管生成、肿瘤细胞生长并加速其侵袭过程[20-21]。Habanjar等[22]研究发现,乳腺癌细胞分泌大量IL-8、IL-6、粒细胞集落刺激因子等细胞因子或趋化因子,这些因子间相互影响形成叠加效应,通过酪氨酸激酶(JAK)/信号转导子和转录激活子(STAT)、PI3K、Akt、mTOR、丝裂原活化蛋白激酶(MAPK)和NF-κB等诸多信号通路来增加肿瘤细胞与其微环境细胞的相互作用,共同维持癌细胞增殖和存活,减少肿瘤细胞凋亡。本研究结果亦显示,MDA-MB-231上清液组较对照组hAdMSC 的p-Akt 和p-mTOR 蛋白表达均升高,而Akt 抑制剂组或CXCR1/2 抑制剂组较MDA-MB-231上清液组上述指标均呈相反变化,表明MDA-MB-231细胞上清液可激活Akt及其下游的mTOR信号通路。
综上所述,MDA-MB-231 细胞上清液通过激活Akt-mTOR信号通路,促进hAdMSC的增殖和归巢到肿瘤微环境,这其中IL-8-CXCR1/2 轴在促进TNBC肿瘤细胞生长和侵袭中可能起关键作用。
