急性心肌梗死并发心力衰竭的风险预测模型构建及验证
2023-11-15马萌雪马萍徐清斌张世昌
马萌雪,马萍,徐清斌△,张世昌
急性心肌梗死(acute myocardial infarction,AMI)是在冠状动脉粥样硬化的基础上出现冠状动脉闭塞,致使血流中断,使部分心肌因严重的持久性缺血而发生局部坏死,是心血管疾病最严重、最凶险的表现形式。经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)作为AMI最有效的治疗手段,可以显著降低患者病死率,但AMI后发生心力衰竭(heart failure,HF)的风险仍较高。有研究显示,约18.7%的AMI 患者住院期间出现HF 或发展为HF,且其发生率随年龄的增长而增加[1-2]。一些新的生物标志物已被证实可用于HF的诊断、危险分层及预后评估,如生长分化因子-15、心型脂肪酸结合蛋白、半乳糖凝集素3等[3],这些新的生化指标的预测价值尚未明确,难以应用于临床。鉴于AMI 患者仍有较高的HF 发生率,本研究通过分析AMI 患者发生HF的影响因素,构建基于列线图的AMI后发生HF的预测模型,为制定此类患者的早期筛查策略提供参考。
1 对象与方法
1.1 研究对象 选取2019年1月—2021年12月宁夏医科大学总院收治AMI患者的临床资料。将符合纳入、排除标准的1 061 例患者随机分为训练集(786 例,75%)和测试集(275例,25%)。纳入标准[4](必须至少具备下列3 条标准中的2条):(1)缺血性胸痛的临床病史。(2)心电图的动态演变。(3)心肌坏死血清心肌标志物浓度的动态改变。急性HF诊断标准[5]:(1)有急性HF 的病因或诱因。(2)新发生或恶化的HF症状和体征。(3)血浆利钠肽水平升高。训练集和测试集根据患者是否合并HF分为HF组和非HF组。
1.2 方法
1.2.1 一般临床信息 收集患者的一般临床信息,包括年龄、性别、吸烟史、2型糖尿病史、高血压病史、陈旧性心肌梗死病史,以及入院时的收缩压(SBP)、舒张压(DBP)、心率(HR)、心功能Killip分级。
1.2.2 实验室指标 收集患者入院时的实验室检查结果,包括白细胞计数(WBC)、中性粒细胞(NEU)、淋巴细胞(LYM)、血小板压积(PCT)、血小板计数(PLT)、平均血小板体积(MPV)、血小板体积分布宽度(PDW)、红细胞体积分布宽度(RDW)、血红蛋白(Hb)、红细胞计数(RBC)、红细胞压积(HCT)、N 端脑利钠肽前体(NT-proBNP)、心肌肌钙蛋白I(cTnI)、超敏-C 反应蛋白(hs-CRP)、血糖(Glu)、尿素氮(BUN)、肌酐(Cr)、天冬氨酸转氨酶(AST)、尿酸(UA)、血钠(Na)、γ-谷氨酰转移酶(GGT)、总胆红素(Tbil)、同型半胱氨酸(Hcy)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、D-二聚体(DD)、纤维蛋白原(Fib)。计算中性粒细胞与淋巴细胞比值(NLR)、血小板计数与淋巴细胞比值(PLR)及平均血小板体积与淋巴细胞比值(MPVLR)。
1.2.3 其他检查指标 收集患者入院时的心电图和超声检查等指标,包括心电图中ST段偏移,超声心动图中左室射血分数(LVEF)、左室舒张末期内径(LVEDD),以及冠状动脉造影术中罪犯血管及数量。
1.3 统计学方法 采用SPSS 26.0 和RStudio 软件进行数据分析。正态分布定量资料用均数±标准差()表示,2 组间比较采用独立样本t检验;偏态分布资料用M(P25,P75)表示,组间比较采用非参数检验;定性资料用例(%)表示,组间比较采用χ2检验。应用Lasso 回归分析筛选出影响HF 发生的变量。多因素Logistic 回归构建预测模型并绘制列线图。绘制受试者工作特征(ROC)曲线和校准曲线评价预测模型发生HF的区分度及校准度。采用Bootstrap法对预测模型进行内部检验。以P<0.05为差异有统计学意义。
2 结果
2.1 HF组与非HF组临床资料的比较 2组间的年龄、性别、高血压、吸烟史、ST 段偏移、Killip 分级、HR、WBC、NEU、LYM、NLR、MPVLR、PDW、Hb、cTnI、NT-proBNP、hs-CRP、Glu、BUN、AST、Na、Hcy、TG、D-D、Fib、LVEF、LVEDD 比较,差异均有统计学意义(P<0.05);2 组的2 型糖尿病、心肌梗死、多支病变、PCI、SBP、DBP、PCT、PLT、PLR、MPV、RDW、RBC、HCT、Cr、UA、GGT、Tbil、TC、HDL-C、LDL-C 比较,差异无统计学意义(P>0.05)。见表1。
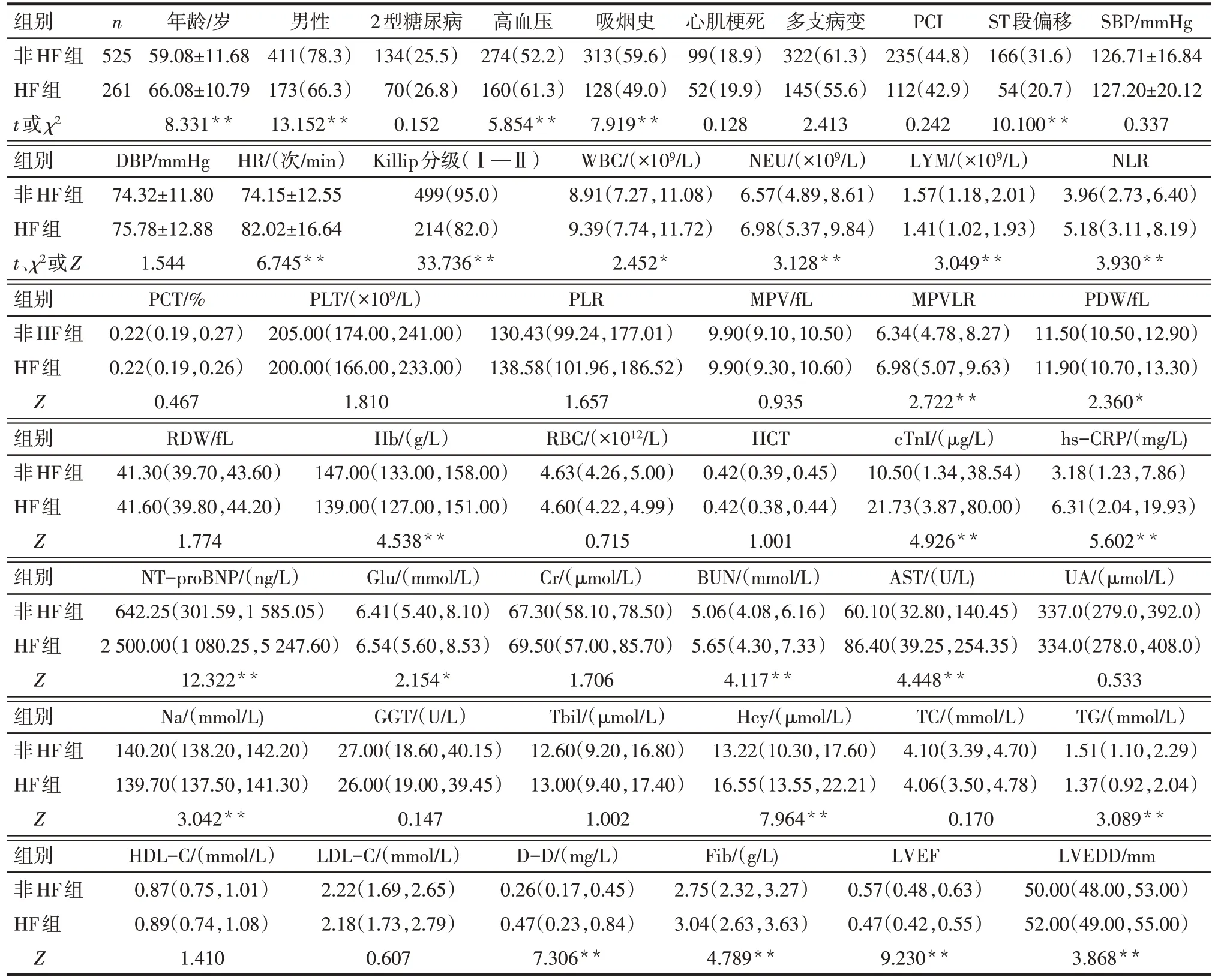
Tab.1 Comparison of clinical data between the HF group and the non-HF group表1 HF组与非HF组临床资料比较
2.2 影响AMI患者发生HF的变量筛选 为避免变量间共线性的影响,将47个变量进行单因素回归分析得到26 个差异有统计学意义的变量,纳入Lasso回归分析,筛选出纳入模型的最佳变量。基于Lasso回归得到13 个变量,见图1。后通过多因素Logistic回归进一步筛选出7 个有临床意义的变量(ST 段偏移、年龄、HR、NT-proBNP、Hcy、Fib、LVEF)纳入预测模型中。
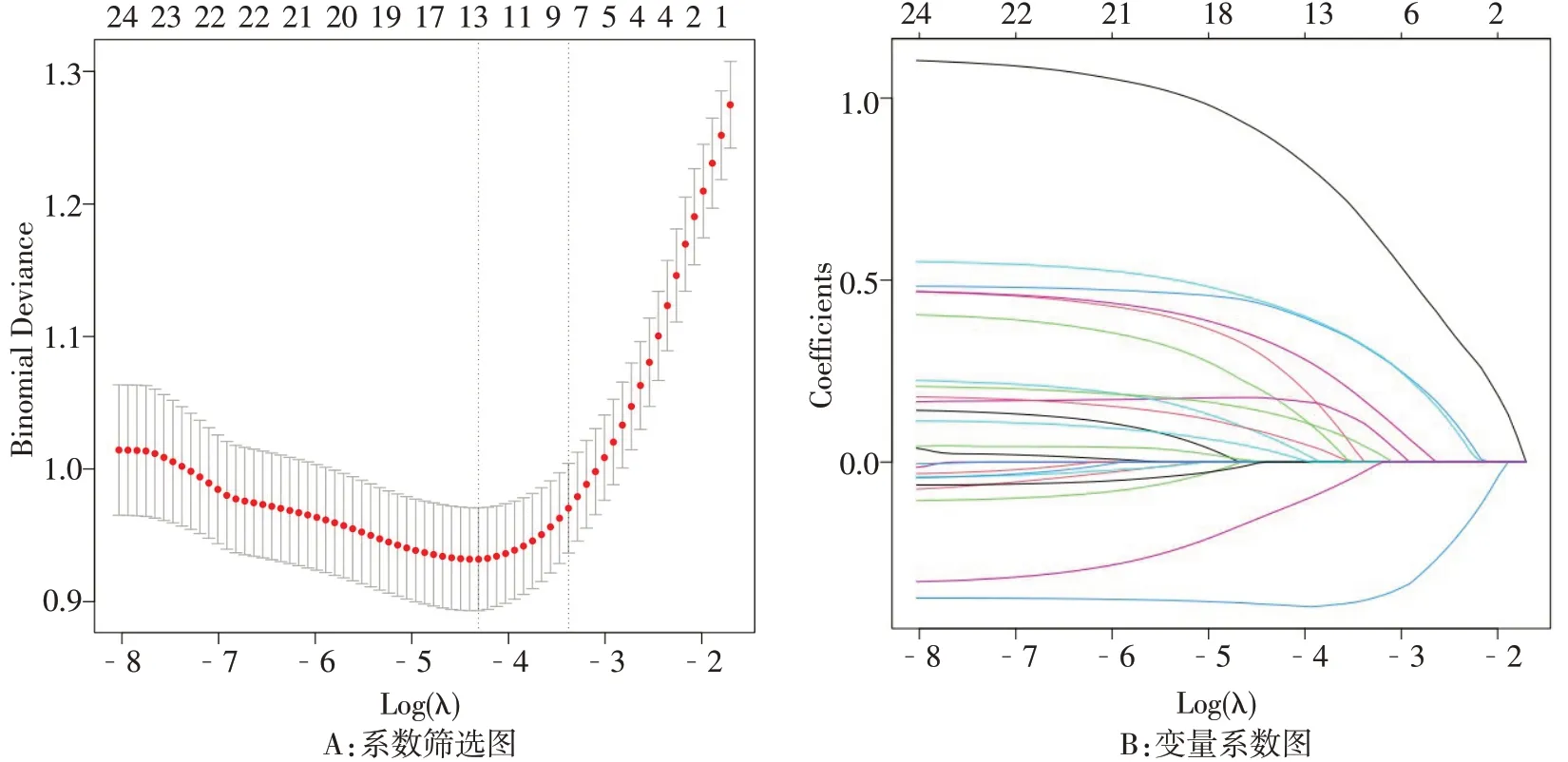
Fig.1 Lasso regression analysis of HF in AMI patients图1 AMI患者发生HF的Lasso回归分析结果
2.3 AMI 患者发生HF 的预测模型构建 多因素Logistic 回归分析结果显示:ST 段偏移、年龄、HR、NT-proBNP、Hcy、Fib、LVEF 是影响AMI 患者发生HF 的预测因素(P<0.05),见表2。基于此结果,构建预测模型的回归方程为Logit(P)=0.718×ST 段偏移+0.042×年龄+0.037×HR+0.000 294×NT-proBNP+0.040×Hcy+0.220×Fib-5.617×LVEF-5.781。根据预测变量绘制AMI患者发生HF的列线图,见图2。
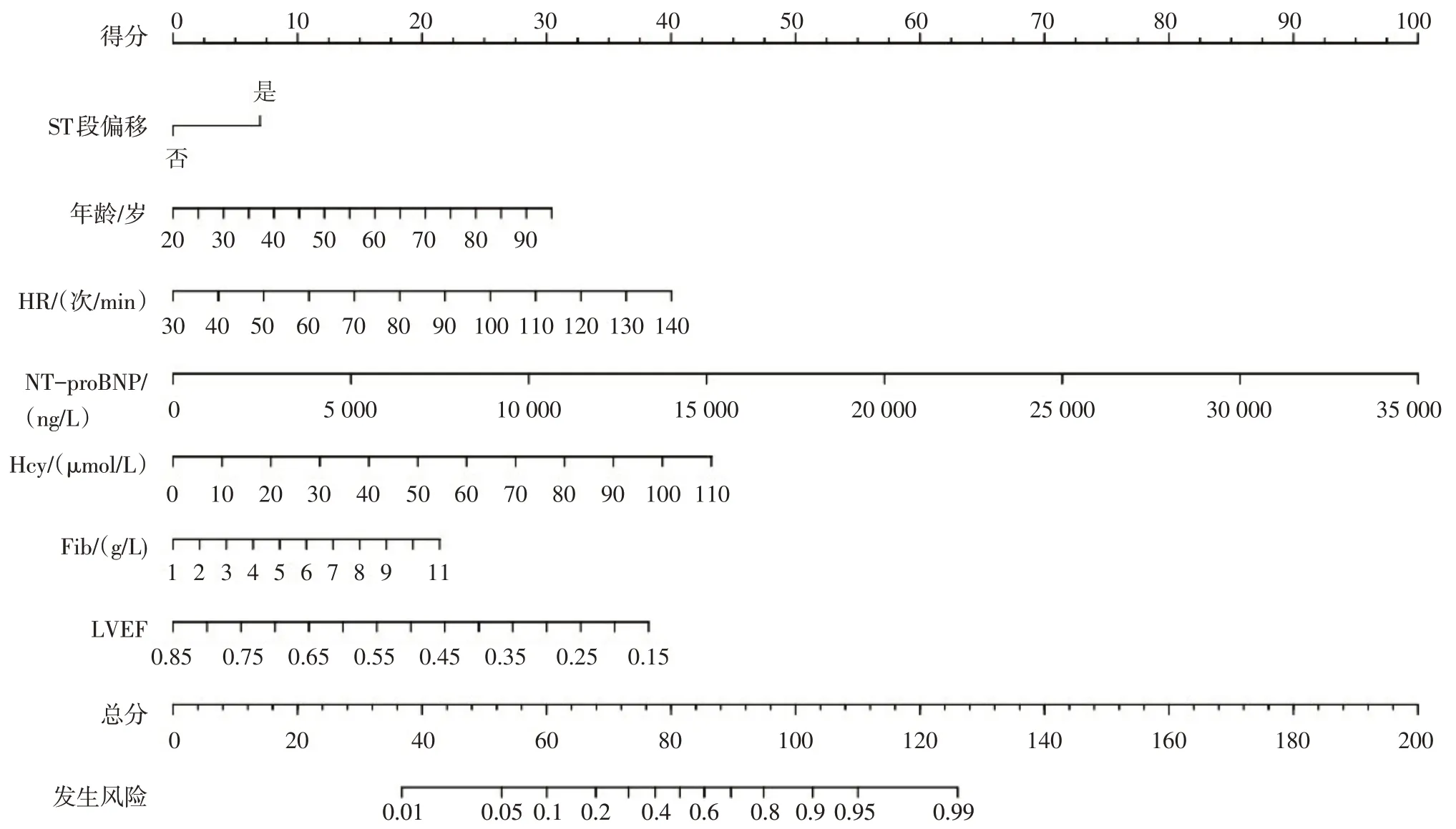
Fig.2 Nomogram of prediction model for HF in AMI patients图2 AMI患者发生HF预测模型的列线图
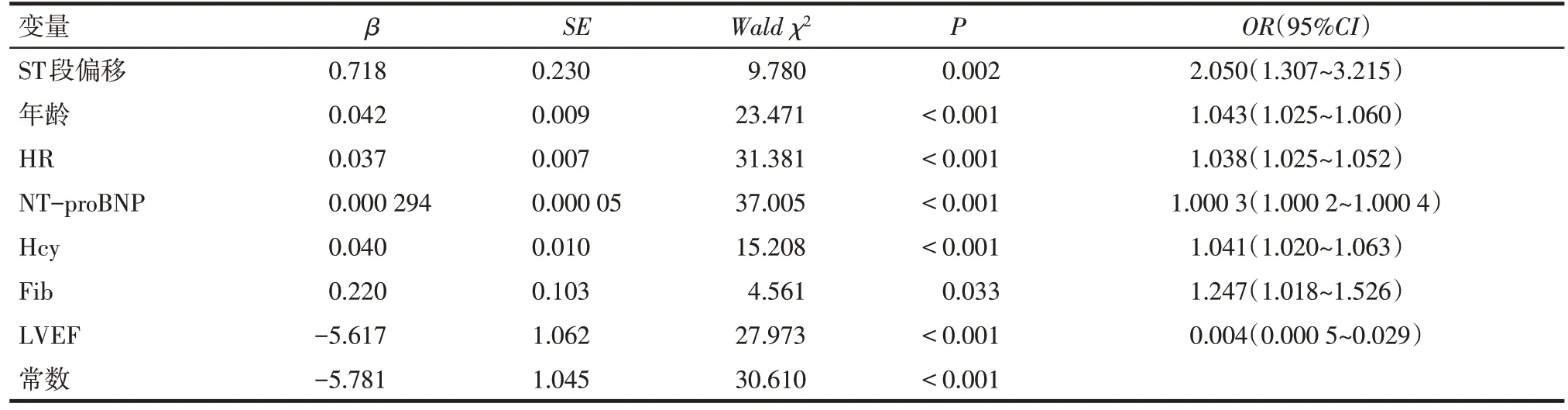
Tab.2 Multivariate Logistic regression analysis for the occurrence of HF in AMI patients表2 AMI患者发生HF的多因素Logistic分析
2.4 AMI患者发生HF预测模型的评价与验证
2.4.1 预测模型的评价 结果显示,预测模型的ROC 曲线下面积(AUC)为0.846,95%CI:0.817~0.875,敏感度为78.50%,特异度为76.60%,提示该模型具有良好的区分度。见图3。校准曲线与理想曲线相近,Brier 得分为0.145,提示模型的预测能力较好,见图4。
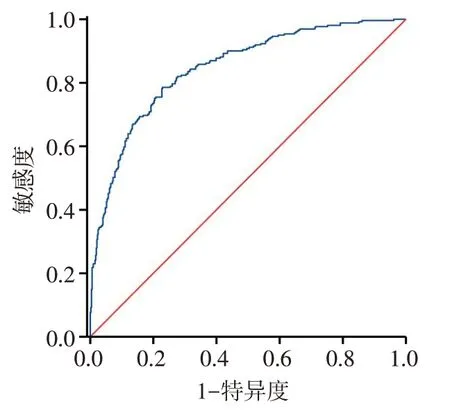
Fig.3 ROC curve of prediction model for HF in AMI patients图3 AMI患者发生HF预测模型的ROC曲线
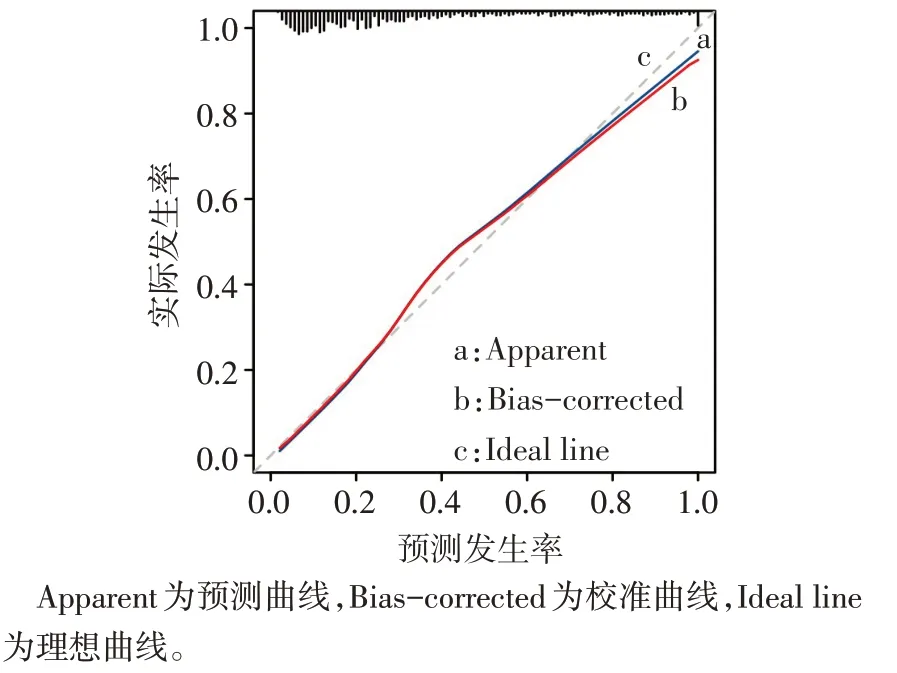
Fig.4 Calibration curve of prediction model for HF in AMI patients图4 AMI患者发生HF预测模型的校准曲线
2.4.2 预测模型的内部验证 利用Bootstrap法对预测模型进行内部验证,模型内部验证的AUC 为0.842,95%CI:0.813~0.871,提示该模型具有良好的区分度及校准度。
2.4.3 预测模型的外部验证 测试集共纳入275例AMI 患者,其中HF 组89 例,非HF 组186 例,根据训练集建立的预测模型进行评分,并绘制ROC 曲线,计算测试集的AUC为0.848,95%CI:0.801~0.896,敏感度为76.40%,特异度为78.00%,提示该模型可以识别发生HF的AMI患者,见图5。
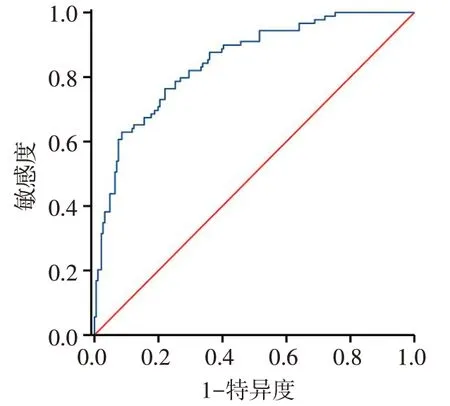
Fig.5 ROC curve of HF in AMI patients in the test set图5 测试集中AMI患者发生HF的ROC曲线
3 讨论
AMI 是HF 常见的病因之一。虽然随着药物和非药物治疗手段的发展,AMI并发HF患者的结局得到一定改善,但AMI 仍具有较高的发病率[6]。“CREATE”研究证实,ST 段抬高型心肌梗死(STEMI)患者7 d 内HF 的发生率约为19.3%[7]。鉴于此,本研究通过分析AMI 患者发生HF 的影响因素,构建AMI患者发生HF的临床预测模型。
3.1 AMI 患者发生HF 的影响因素分析 本研究结果显示,年龄、心电图ST 段偏移、HR、NT-proBNP、Hcy、Fib、LVEF 是AMI 患者发生HF 的影响因素,与既往研究结论相似[8-10]。因此,选取以上指标构建的预测模型具有较强的可信度。
年龄是AMI后发生HF的危险因素。“CVDNOR”研究显示,约25.6%的老年AMI 患者住院期间出现HF,且老年AMI 合并HF 具有较高的病死率(男性60.4%,女性80.1%)[2]。
心电图ST段改变提示存在心肌缺血,不同导联ST段的改变对AMI患者的罪犯血管均有提示作用。研究显示,伴有ST段抬高的AMI患者不良心脑血管事件的发生率为6.7%,住院死亡率为5.6%[11]。另一项纳入非ST段抬高型心肌梗死患者的研究显示,入院ST段压低程度与住院期间的病死率呈正相关[12]。
某些急性或严重疾病后的心率变异性和波动能够直接反映脏器功能障碍的严重和复杂程度,尤其是心血管系统疾病。心率增加会加重左心室后负荷,使室壁僵硬度升高,导致左心室舒张功能和心功能受损严重;相反,心率降低可以降低心肌耗氧量,使心室舒张期延长而维持冠状动脉灌注,缓解AMI患者的临床症状[9]。一项对2 571 例STEMI 患者并随访568 d的研究显示,入院时心率升高与患者住院期间/远期高病死率显著相关[13]。
NT-proBNP 可以反映患者心功能状态,广泛用于诊断HF 和心功能不全。脑钠肽主要由左心室中的心肌细胞合成和分泌。应激、机体缺血缺氧、神经体液因素等均可诱导其合成与分泌。急性缺血性心脏病与脑钠肽水平升高相关,能够反映左心室功能障碍的严重程度[14]。一项前瞻性队列研究显示,较高的NT-proBNP 是新发HF 和急性失代偿性HF 患者1年全因死亡率的预测因素[15]。
Hcy 是一种非必需含硫氨基酸,是蛋氨酸的中间代谢产物。研究证实Hcy是心血管疾病的危险因素,其水平升高可以损伤血管壁,加速动脉粥样硬化,同时还能损伤血管内皮,诱导心脏收缩和抑制冠脉血流[10]。发生HF 时,Hcy 通过使心肌细胞增大、肥大细胞增殖及心肌纤维化介导心脏重塑[16]。研究证实,Hcy对老年STEMI患者预后具有预测价值[17]。荟萃分析显示,高Hcy 与HF 的发生显著相关,并与纽约心脏病协会心功能分级的提高呈正相关[16]。
Fib 由肝细胞合成,通过增加血液黏度、促进炎症和动脉硬化形成及增加血小板聚集、血栓黏附等促进血栓形成,是血栓形成和炎症发生的生物标志物[18]。Jiang等[19]通过对6 293例患者随访2年发现,Fib 是接受PCI 治疗患者全因死亡率的危险因素。荟萃分析显示,Fib与心血管疾病的全因死亡率显著相关[18]。
LVEF是评估心脏结构和功能的一项重要指标。LVEF 下降是AMI 预后不良的预测因素。荟萃分析显示,心肌梗死合并HF或左心室功能不全患者的死亡风险随LVEF 的降低而增加,当LVEF 降低0.05,猝死风险增加23%,HF死亡风险增加26%[20]。
3.2 AMI 患者发生HF 风险预测模型的构建与验证 预防HF 是一项重大的公共卫生需求。AMI 人群是发生HF 的高风险群体。研究者选取了不同的风险因素建立了急性HF 预后的风险评分模型,如GWTG-HF 评分、ADHERE 评分、ADHF/NT-proBNP评分、OPTIME-CHF 评分等,这些评分仅对HF 患者的短期或长期死亡率具有预测价值[21]。目前,针对AMI 患者发生HF 预测模型的研究有限。本研究利用Lasso 回归筛选出AMI 患者发生HF 的危险因素,基于以上变量构建的预测模型对AMI 并发HF 具有较高的预测效能,并有助于临床医师早期识别此类患者,避免漏诊或延迟诊断而影响预后和增加治疗成本。然而,本研究为单中心回顾性研究,仅利用少量样本对模型进行外部验证,今后需扩大样本进行多中心验证,进一步评价该模型的临床应用效能。
