依达拉奉右莰醇通过铁死亡-脂质过氧化通路对脑出血大鼠神经保护的作用机制
2023-11-15毛权西李作孝
毛权西,李作孝
脑出血是指非外伤性脑实质内血管破裂引起的出血,具有致残率和致死率高的特点,目前治疗主要以减轻血肿以及抑制血肿周围脑组织水肿为主[1],但治疗效果较差。脑出血后血肿周围脑组织继发病理生理损害是脑出血致残、致死的重要因素。近年来研究发现,铁死亡在脑出血后血肿周围脑组织继发病理生理损害中具有重要作用[2]。其特征为铁沉积、谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)活性下降、活性氧(ROS)大量产生和脂质过氧化[3]。依达拉奉具有清除氧自由基作用而用于脑梗死、脑出血治疗,依达拉奉右莰醇具有清除氧自由基和抗炎双重作用,用于治疗缺血性脑卒中疗效显著[4],但其用于脑出血的治疗研究尚鲜见。本研究应用依达拉奉右莰醇干预脑出血动物模型,检测脑出血大鼠氧化应激、炎性免疫、铁死亡、脂质过氧化等指标变化,探讨其对脑出血的保护作用及相关机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 128 只SPF 级成年健康雄性SD 大鼠,6~9周龄,体质量250~300 g,购自西南医科大学实验动物中心,动物生产许可证号:SCXK(川)2018-17。大鼠以常规条状颗粒饲料喂养,自由饮水,定时清理鼠笼,更换垫料,保持动物房清洁卫生。实验及操作符合动物实验伦理要求(伦理编号:2021-0601-1)。
1.1.2 主要试剂与仪器 依达拉奉注射液(国药准字H20031342)、依达拉奉右莰醇注射用浓溶液(国药准字H20200007)购自南京先声药业有限公司;胶原酶Ⅶ购自Sigma 公司。GPX4 抗体、长链脂酰辅酶A 合成酶4(ACSL4)抗体、磷脂胆碱酰基转移酶3(LPCAT3)抗体、抗GAPDH抗体购自英国Abcam 公司;ROS 试剂盒、总谷胱甘肽(T-GSH)试剂盒购自南京建成生物工程研究所。大脑立体定位仪(型号:464601,RWD 公司),微板法酶标仪(型号:DR-200Bs,Diatek公司),倒置显微镜(型号:CX33,OLYMPUS公司)。
1.2 方法
1.2.1 造模与分组给药 采用随机数字表法将128只大鼠分为假手术组、脑出血组、依达拉奉组和依达拉奉右莰醇组,每组32只。各组分别设术后1、3、7和14 d各4个时间点,每个时间点分配8只大鼠。除假手术组外,其余组大鼠构建急性脑出血模型。大鼠适应性喂养2 周,术前大鼠禁食禁水8 h,天平称质量后,使用10%水合氯醛(腹腔注射,300 mg/kg)进行麻醉。麻醉大鼠常规消毒、备皮后将其置于立体定位仪,并于大鼠顶部行正中切口,充分暴露头骨,定位右侧尾状核,以前囟为原点,右侧旁开3.0 mm,向前0.5 mm将颅骨钻直径为1 mm的孔。接下来对立体定向仪做调整,将0.1 U胶原酶Ⅶ沿钻孔进针至颅骨下5.5 mm 处的尾壳核缓慢注射,于5 min 内缓慢注入,注射完毕后针头保持原位10 min 防止回流;缓慢退出针头后用医用骨蜡封闭骨孔,无出血后消毒并缝合皮肤持续饲养,并对大鼠进行标记[5]。假手术组进行相同手术操作,经颅骨钻孔后注入等体积生理盐水。术后死亡大鼠被剔除,并及时补足相应数量的大鼠。造模2 h后,依达拉奉组腹腔注射依达拉奉6 mg/kg,每12 h注射1次。依达拉奉右莰醇组腹腔注射依达拉奉右莰醇7.5 mg/kg,每12 h注射1 次,假手术组和脑出血组腹腔注射等量生理盐水。造模后各组每个时间点随机抽取8 只大鼠进行神经功能评分,3 只麻醉后用4%组织固定液灌注固定,断头后取出完整脑组织置于组织固定液中,其余5只于各组预定时间点麻醉后将大鼠进行常规灌注,断头后取出完整脑组织,迅速转运至-80 ℃冰箱保存备用。造模成功判断标准:造模后可见大鼠立即出现神经功能异常表现,主要为左侧肢体出现瘫痪,提起其尾巴时,可见左侧前肢屈曲,右侧前肢伸展正常;当推大鼠时,其向左侧旋转爬行。
1.2.2 神经功能评分 根据改良Garcia评分标准[6]对各实验组大鼠在相应时间点进行神经功能评分。评估内容:自主运动、体态对称性、前肢伸展运动、爬网能力、身体触觉反射及胡须碰触反应6个项目,每项0~3分,总分18分,神经功能评分越低,神经损伤程度越重。
1.2.3 HE染色观察血肿周围脑组织病理变化 将大鼠血肿周围脑组织标本用4%多聚甲醛固定24 h 以上,然后用梯度乙醇脱水后石蜡包埋,将蜡块切片(片厚4µm)后脱蜡,进行HE 染色,脱水后封片,应用400倍光学显微镜观察脑组织病理变化。
1.2.4 化学荧光法检测血肿周围脑组织ROS 含量 将各组大鼠脑组织从冰箱取出放在培养皿上,沿进针点冠状面切开脑组织,用眼科剪沿血肿周围区域取脑组织,称取脑组织质量,冰水浴条件下将脑组织机械匀浆,离心10 min 后取上清液,加入荧光探针,避光孵育后进行荧光检测,严格按照试剂盒说明书具体步骤操作。
1.2.5 微量酶标法检测血肿周围脑组织GSH 含量 各组大鼠脑组织从冰箱取出后用眼科剪沿血肿周围区域取脑组织,采用微量酶标法检测GSH含量,按照测试盒说明操作。
1.2.6 Western blot 检测血肿周围脑组织相关蛋白ACSL4、LPCAT3、GPX4 的表达 各组大鼠脑组织从冰箱中取出后,用眼科剪取大鼠血肿周围脑组织约10 mg,用预冷的PBS 缓冲液漂洗后,加入组织蛋白提取剂200µL(每1 mL蛋白提取剂:960 µL RIPA 总蛋白裂解液+10 µL PMSF+10 µL 蛋白酶抑制剂+10µL 磷酸酶抑制剂A+10µL 磷酸酶抑制剂B),冰浴彻底匀浆,4 ℃条件下以12 000 r/min 离心5 min 后取上清液,应用BCA试剂盒检测总蛋白浓度,电泳分离蛋白后转膜。将封闭液加入转好的膜,1 h 后漂洗并加入一抗[兔源抗ASCL4 抗体(1∶3 000)、LPCAT3 抗体(1∶1 000)、GPX4 抗体(1∶1 000)、GAPDH抗体(1∶10 000)],于4 ℃孵育过夜。洗膜后加入HRP 标记的山羊抗兔二抗(1∶10 000)室温孵育30 min,用ECL 化学发光显影,AlphaEaseFC 软件处理系统分析目标带的光密度值。
1.3 统计学方法 采用SPSS 17.0 软件进行数据分析,计量资料均符合正态分布,以均数±标准差()表示,多组间比较采用单因素方差分析,组间多重比较行LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组神经功能变化 组内比较:假手术组各时间点神经功能评分差异无统计学意义(P>0.05)。脑出血组、依达拉奉组和依达拉奉右莰醇组神经功能评分均在术后3 d 时最低,术后7 d、14 d 逐渐升高,差异有统计学意义(P<0.05)。组间比较:术后各时点脑出血组神经功能评分低于假手术组,依达拉奉组、依达拉奉右莰醇组神经功能评分高于脑出血组,依达拉奉右莰醇组神经功能评分高于依达拉奉组(P<0.05),见表1。
Tab.1 Comparison of neurological function scores between the four groups of rats表1 各组大鼠神经功能评分比较(分,)
*P<0.05;组间比较:a与假手术组比较,b与脑出血组比较,c与依达拉奉组比较,P<0.05;组内比较:A与1 d比较,B与3 d比较,C与7 d比较,P<0.05;表2—4同。
组别假手术组脑出血组依达拉奉组依达拉奉右莰醇组F n8 8 8 8神经功能评分1 d 17.75±0.46 11.88±1.13a 13.25±1.28b 14.25±0.89bc 55.514*3 d 17.75±0.46 9.50±0.93aA 11.63±1.06bA 13.38±0.74bcA 142.848*7 d 17.88±0.35 13.38±0.92aAB 14.75±1.04bAB 15.88±0.64bcAB 47.331*14 d 18.00±0.00 14.75±0.89aABC 16.00±0.76bABC 17.50±0.53bcABC 42.507*F 0.828 43.110*25.950*52.234*
2.2 血肿周围脑组织病理变化 假手术组大鼠各时点脑组织未见明显病理改变。脑出血组大鼠在术后1 d时血肿周围脑组织出现红细胞浸润,少量炎性细胞聚集;术后3 d时血肿周围脑组织大量红细胞浸润,细胞排列不规则、疏松,细胞间隙变大,神经细胞变性,大量炎性细胞聚集;术后7 d 时血肿周围脑组织红细胞浸润减少,水肿减轻;术后14 d时脑组织病理改变较7 d 时进一步减轻。依达拉奉组和依达拉奉右莰醇组各时点神经细胞肿胀、变性坏死、炎性细胞浸润较脑出血组减轻。依达拉奉右莰醇组病理损伤程度明显轻于依达拉奉组。见图1。
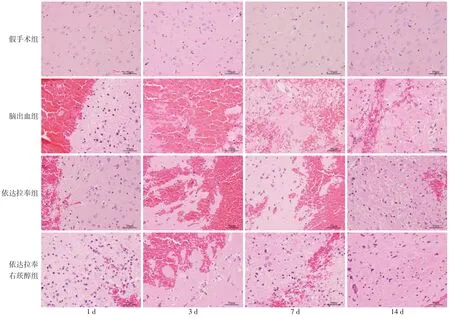
Fig.1 Histopathological changes of rat brain in each group(HE staining,×400)图1 各组大鼠脑组织病理学变化(HE染色,×400)
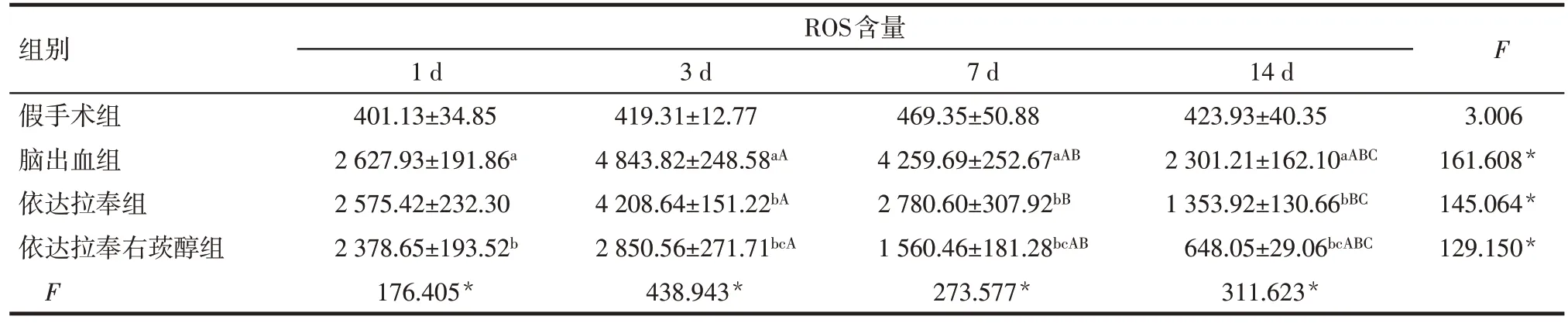
2.3 各组大鼠血肿周围脑组织ROS 含量变化 组内比较:假手术组大鼠各时间点血肿周围脑组织ROS 含量差异无统计学意义。脑出血组、依达拉奉组和依达拉奉右莰醇组大鼠血肿周围脑组织ROS含量均在术后3 d 时最高,术后7 d、14 d 逐渐降低,差异有统计学意义(P<0.05)。组间比较:术后各时点脑出血组大鼠血肿周围脑组织ROS含量高于假手术组,1 d 时依达拉奉组与脑出血组血肿周围脑组织ROS 含量差异无统计学意义,其余各时间点依达拉奉组、依达拉奉右莰醇组血肿周围脑组织ROS 含量均低于脑出血组,依达拉奉右莰醇组血肿周围脑组织ROS含量低于依达拉奉组(P<0.05)。见表2。
Tab.2 Changes of ROS content in brain tissue around hematoma of rats in each group表2 各组大鼠血肿周围脑组织ROS含量变化(n=5,RFU/mgprot,)
Tab.2 Changes of ROS content in brain tissue around hematoma of rats in each group表2 各组大鼠血肿周围脑组织ROS含量变化(n=5,RFU/mgprot,)
组别假手术组脑出血组依达拉奉组依达拉奉右莰醇组F ROS含量1 d 401.13±34.85 2 627.93±191.86a 2 575.42±232.30 2 378.65±193.52b 176.405*3 d 419.31±12.77 4 843.82±248.58aA 4 208.64±151.22bA 2 850.56±271.71bcA 438.943*7 d 469.35±50.88 4 259.69±252.67aAB 2 780.60±307.92bB 1 560.46±181.28bcAB 273.577*14 d 423.93±40.35 2 301.21±162.10aABC 1 353.92±130.66bBC 648.05±29.06bcABC 311.623*F 3.006 161.608*145.064*129.150*
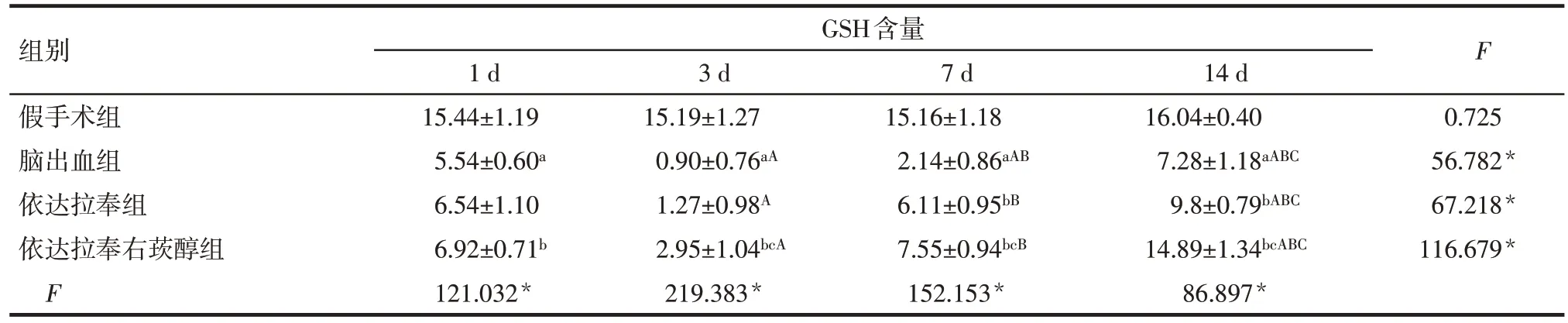
2.4 各组大鼠血肿周围脑组织GSH 含量变化 组内比较:假手术组大鼠各时间点血肿周围脑组织GSH含量差异无统计学意义(P>0.05)。脑出血组、依达拉奉组和依达拉奉右莰醇组大鼠血肿周围脑组织GSH含量均在术后3 d时最低,术后7 d、14 d逐渐升高,差异有统计学意义(P<0.05)。组间比较:术后各时点脑出血组大鼠血肿周围脑组织GSH 含量低于假手术组,1 d 时依达拉奉组血肿周围脑组织GSH 含量与脑出血组差异无统计学意义,其余各时间点依达拉奉组、依达拉奉右莰醇组大鼠血肿周围脑组织GSH含量均高于脑出血组,依达拉奉右莰醇组大鼠血肿周围脑组织GSH 含量高于依达拉奉组(P<0.05)。见表3。
Tab.3 Changes of GSH content in brain tissue around hematoma of rats in each group表3 各组大鼠血肿周围脑组织GSH含量变化(n=5,µmol/g,)
Tab.3 Changes of GSH content in brain tissue around hematoma of rats in each group表3 各组大鼠血肿周围脑组织GSH含量变化(n=5,µmol/g,)
组别假手术组脑出血组依达拉奉组依达拉奉右莰醇组F GSH含量1 d 15.44±1.19 5.54±0.60a 6.54±1.10 6.92±0.71b 121.032*3 d 15.19±1.27 0.90±0.76aA 1.27±0.98A 2.95±1.04bcA 219.383*7 d 15.16±1.18 2.14±0.86aAB 6.11±0.95bB 7.55±0.94bcB 152.153*14 d 16.04±0.40 7.28±1.18aABC 9.8±0.79bABC 14.89±1.34bcABC 86.897*F 0.725 56.782*67.218*116.679*
2.5 各组大鼠血肿周围脑组织铁死亡相关蛋白表达 组内比较:假手术组大鼠各时间点血肿周围脑组织GPX4、LPCAT3、ACSL4表达差异无统计学意义(P>0.05)。脑出血组、依达拉奉组和依达拉奉右莰醇组大鼠血肿周围脑组织GPX4 表达均在术后3 d时最低,术后7 d、14 d 逐渐升高;LPCAT3、ACSL4 表达均在术后3 d 时最高,术后7 d、14 d 逐渐降低,差异有统计学意义(P<0.05)。组间比较:术后各时点脑出血组大鼠血肿周围脑组织GPX4表达低于假手术组,LPCAT3、ACSL4 表达高于假手术组(P<0.05);1 d时依达拉奉组血肿周围脑组织LPCAT3表达与脑出血组差异无统计学意义,其余各时间点依达拉奉组、依达拉奉右莰醇组血肿周围脑组织GPX4表达高于脑出血组,ACSL4、LPCAT3 表达低于脑出血组(P<0.05);依达拉奉右莰醇组血肿周围脑组织GPX4表达高于依达拉奉组,LPCAT3、ACSL4表达低于依达拉奉组(P<0.05)。见图2、表4。
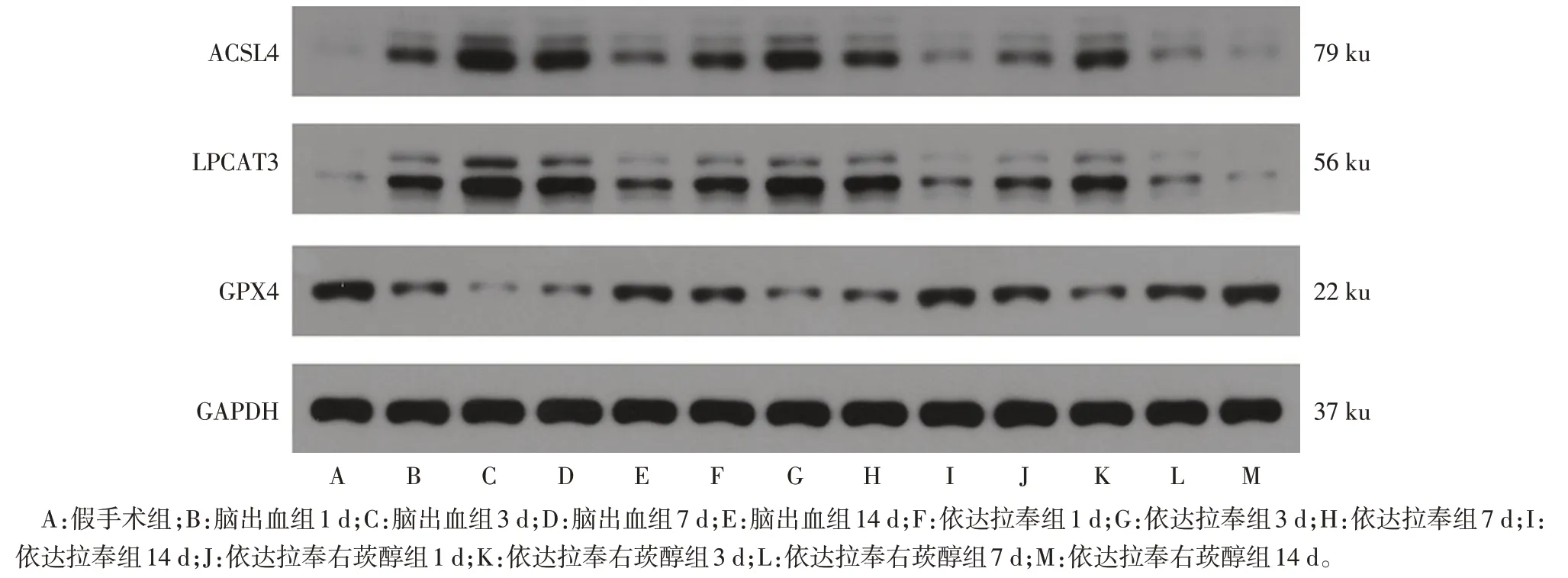
Fig.2 Changes in expression of ferroptosis-related proteins in brain tissue around hematoma of rats in each group图2 各组大鼠血肿周围脑组织铁死亡相关蛋白表达变化
Tab.4 Changes of ACSL4,LPCAT3 and GPX4 expression in brain tissue around hematoma of rats in each group表4 各组大鼠血肿周围脑组织ACSL4、LPCAT3和GPX4表达变化(n=5,)
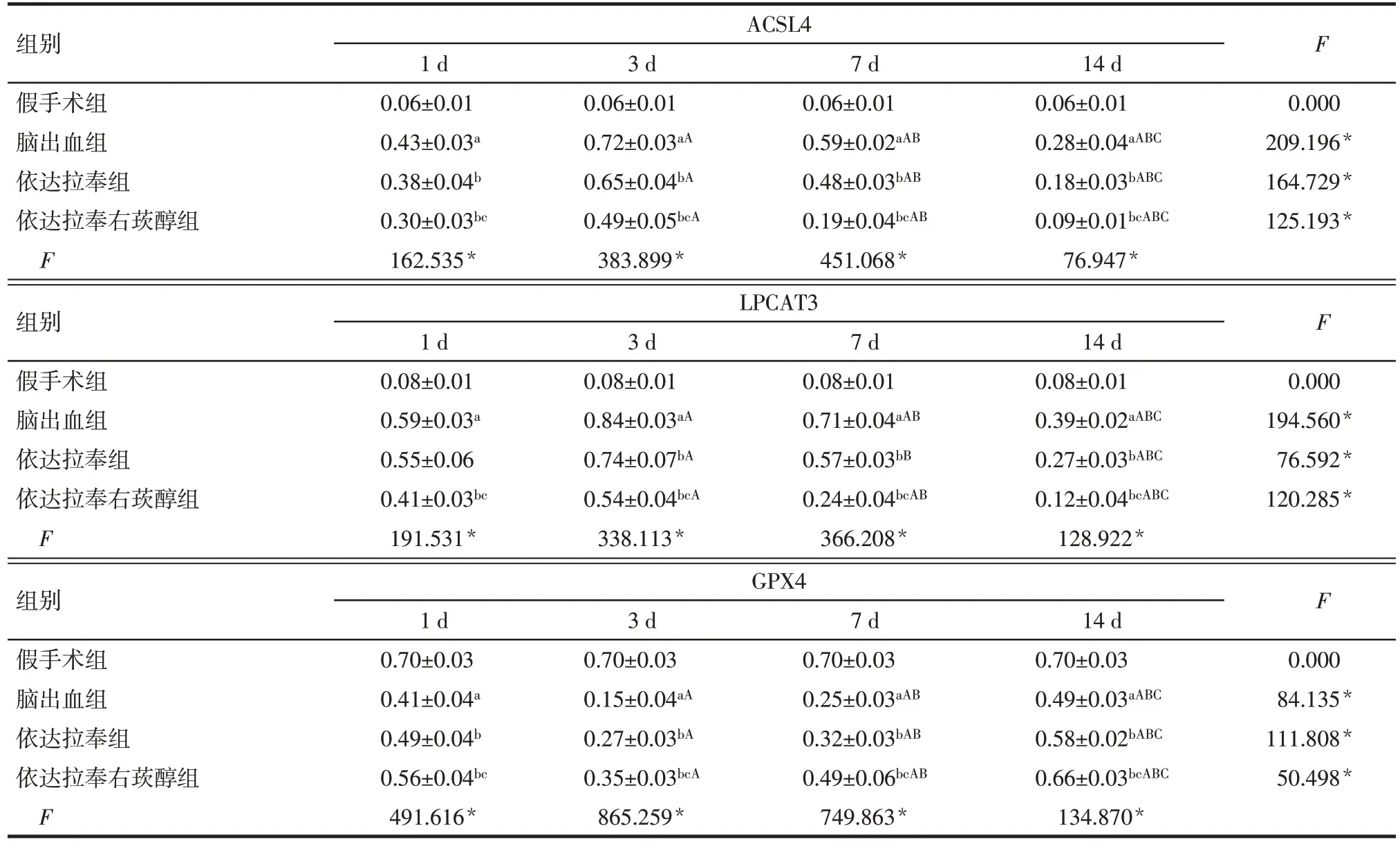
Tab.4 Changes of ACSL4,LPCAT3 and GPX4 expression in brain tissue around hematoma of rats in each group表4 各组大鼠血肿周围脑组织ACSL4、LPCAT3和GPX4表达变化(n=5,)
组别假手术组脑出血组依达拉奉组依达拉奉右莰醇组F ACSL4 1 d 0.06±0.01 0.43±0.03a 0.38±0.04b 0.30±0.03bc 162.535*3 d 0.06±0.01 0.72±0.03aA 0.65±0.04bA 0.49±0.05bcA 383.899*7 d 0.06±0.01 0.59±0.02aAB 0.48±0.03bAB 0.19±0.04bcAB 451.068*14 d 0.06±0.01 0.28±0.04aABC 0.18±0.03bABC 0.09±0.01bcABC 76.947*F 0.000 209.196*164.729*125.193*组别假手术组脑出血组依达拉奉组依达拉奉右莰醇组F LPCAT3 1 d 0.08±0.01 0.59±0.03a 0.55±0.06 0.41±0.03bc 191.531*3 d 0.08±0.01 0.84±0.03aA 0.74±0.07bA 0.54±0.04bcA 338.113*7 d 0.08±0.01 0.71±0.04aAB 0.57±0.03bB 0.24±0.04bcAB 366.208*14 d 0.08±0.01 0.39±0.02aABC 0.27±0.03bABC 0.12±0.04bcABC 128.922*F 0.000 194.560*76.592*120.285*组别假手术组脑出血组依达拉奉组依达拉奉右莰醇组F GPX4 1 d 0.70±0.03 0.41±0.04a 0.49±0.04b 0.56±0.04bc 491.616*3 d 0.70±0.03 0.15±0.04aA 0.27±0.03bA 0.35±0.03bcA 865.259*7 d 0.70±0.03 0.25±0.03aAB 0.32±0.03bAB 0.49±0.06bcAB 749.863*14 d 0.70±0.03 0.49±0.03aABC 0.58±0.02bABC 0.66±0.03bcABC 134.870*F 0.000 84.135*111.808*50.498*
3 讨论
脑出血是脑卒中的一种亚型,脑出血后血肿周围脑组织可产生一系列继发性损伤,包括自由基释放,神经细胞的凋亡、坏死、自噬及炎症等[7]。Zille等[8]研究发现,脑出血后神经细胞出现铁死亡相关特征,抑制细胞铁死亡可改善脑出血后神经元损伤。提示铁死亡与脑出血后继发性损伤密切相关。
铁死亡是一种受调节的非凋亡细胞死亡方式。研究表明铁死亡与脑梗死、阿尔茨海默病、帕金森病等多种神经系统疾病密切相关[9]。Bao 等[10]研究发现,铁死亡相关信号通路在脑出血后铁沉积和神经元死亡中起关键作用。脑出血后过量铁离子可以通过芬顿反应产生羟基自由基,促进不饱和脂肪酸在细胞膜上的氧化[11]。有研究发现,ACSL4和LPCAT3参与不饱和脂肪酸的转化,在脂质代谢过程中发挥重要作用[12-13]。下调ACSL4 和LPCAT3 表达可减少细胞内脂质过氧化作用底物的积累,抑制细胞铁死亡[14]。GSH是合成GPX4的底物,是GPX4发挥抗氧化功能的辅助因子,也是铁死亡的关键调节因子[15]。GPX4 可将磷脂氢过氧化物还原为无毒的脂醇,GPX4表达上调能减少脂质氢过氧化物的积累,抑制ROS 的形成[16]。ROS 可导致氧化应激的产生,引发脂质过氧化,诱导细胞铁死亡[17]。本研究结果显示,脑出血大鼠血肿周围脑组织神经细胞出现不同程度受损,在1 d 时开始出现损伤,3 d 时最为严重;脑出血组大鼠各时间点血肿周围脑组织ACSL4、LPCAT3蛋白表达水平升高,GSH 含量降低,GPX4 蛋白表达水平降低,ROS含量增高,提示脑出血大鼠血肿周围脑组织出现明显脂质代谢紊乱,脂质过氧化水平升高,神经细胞出现铁死亡,表明铁死亡参与脑出血后血肿周围脑组织继发病理生理损害。
依达拉奉作为一种抗氧化剂和自由基清除剂,能透过血脑屏障抑制脑细胞膜的氧化[18],上调GPX表达,抑制炎症和氧化反应,治疗创伤性脑损伤的效果显著[19]。研究显示,依达拉奉在脑出血急性期可减少炎性因子释放、清除自由基、减轻脑水肿[20]。Zhang 等[21]研究发现,依达拉奉可减轻脑室内出血引起的脑水肿和神经功能损伤,其机制可能是依达拉奉减轻了铁诱导的氧化应激,发挥神经保护作用。Homma等[22]研究发现依达拉奉能有效清除自由基、减少脂质过氧化物的沉积和ROS 的产生,抑制细胞铁死亡。右莰醇是一种具有抗炎作用的双环单萜类化合物,可轻松穿透血脑屏障,抑制细胞内ROS 生成,并帮助其他药物顺利通过血脑屏障[23]。Wu等[24]研究发现,在缺血性脑损伤中,依达拉奉和右莰醇两种组分相互协同,对神经细胞的保护作用优于两者单独使用。在脑出血模型中,依达拉奉联合右莰醇能减轻血肿周围脑水肿、维持血脑屏障完整性,其神经功能保护作用优于依达拉奉[25]。本研究结果显示,依达拉奉右莰醇可改善脑出血模型大鼠神经功能障碍,减轻血肿周围脑组织炎性细胞浸润及神经细胞变形,在脑出血后3 d、7 d和14 d血肿周围脑组织LPCAT3、ACSL4 蛋白表达水平降低,GSH 含量和GPX4 蛋白表达水平升高,ROS 沉积减少,且依达拉奉右莰醇的干预效果优于依达拉奉。其机制可能是依达拉奉联合右莰醇抑制了ACSL4、LPCAT3蛋白的表达,增强了GPX4的活性,同时增加了GSH的生成,抑制了ROS 的产生,降低了脂质过氧化水平,抑制神经细胞铁死亡,减轻了神经细胞损伤。提示依达拉奉和依达拉奉右莰醇可通过调控脂质代谢途径抑制脑出血神经细胞铁死亡,对神经细胞具有保护作用,且依达拉奉右莰醇作用优于依达拉奉。
综上所述,依达拉奉右莰醇对脑出血大鼠具有神经保护作用,其原因可能是通过调节脑出血大鼠神经细胞脂质过氧化相关蛋白的表达,减少ROS 的产生,减少脑组织脂质过氧化,从而抑制神经细胞铁死亡,发挥脑保护作用。脂质过氧化通路并非神经细胞铁死亡的唯一因素,依达拉奉右莰醇还可能通过其他途径抑制神经细胞铁死亡而发挥脑保护作用,这还有待进一步研究。
