线粒体自噬-NLRP3炎症小体通路在新生大鼠缺血性脑损伤中的作用研究
2023-11-15林永文陈巧媚敖当黄炳龙骆成珠李承燕
林永文,陈巧媚,敖当,黄炳龙,骆成珠,李承燕
新生儿缺氧缺血性脑病(hypoxic ischemic encephalopathy,HIE)是指缺氧或窒息导致的新生儿大脑缺氧缺血性损伤,发达国家的发病率为1‰~8‰,发展中国家则高达26‰,是足月新生儿致残的主要疾病[1]。脑缺血-再灌注损伤(CIRI)是新生儿HIE主要病理生理学改变,线粒体自噬-炎症小体在其中发挥重要作用[2-3]。研究发现,缺血可导致神经元中NOD样受体热蛋白结构域相关蛋白3(NLRP3)炎症小体活化[4],抑制NLRP3 炎症小体活化可减轻炎症反应和脑缺血-再灌注损伤[5]。NLRP3 炎症小体的活化常伴随线粒体自噬调控的紊乱,同时线粒体损伤是NLRP3 炎症小体过度激活的重要原因[6]。抑制线粒体复合物Ⅰ或复合物Ⅲ会增加线粒体内活性氧(ROS)生成,进而触发NLRP3炎症小体激活[7]。激活Parkin依赖的线粒体自噬可抑制NLRP3炎症小体的活化,减轻肾脏及肝脏的缺血-再灌注损伤[8-9]。目前鲜见有关新生大鼠CIRI 后线粒体自噬与NLRP3炎症小体相互作用的研究。本研究旨在探讨线粒体自噬与NLRP3 炎症小体途径在改善CIRI 中的作用过程和机制。
1 材料与方法
1.1 主要材料 1 周龄新生SD 大鼠42 只,体质量(15±3)g。由SPF级成年健康SD大鼠(雌鼠10只,雄鼠5只)配种所生,体质量(220±30)g,购自北京斯贝福生物技术有限公司[动物生产许可证号:SCXK(京)2019-0010]。本实验通过广东医科大学实验动物福利伦理委员会批准(审批号:GDY2102087)。 BCA 蛋白浓度测定试剂盒、Mdivi-1(Dynamin 抑制剂)、Western 一抗稀释液(中国碧云天公司),MCC950(选择性的NLRP3 抑制剂)和Ac-YVAD-cmk(选择性caspase-1 抑制剂,美国MedChemExpress 公司),胱天蛋白酶(caspase)-1 兔单克隆抗体、caspase-8 兔单克隆抗体、LC3Ⅱ/Ⅰ兔单克隆抗体、二甲亚砜(DMSO,美国CST公司),凋亡相关微粒蛋白(ASC)、NLRP3、anti-SQSTM1/P62、PTEN 诱导激酶1(PINK1)、Parkin、甘油醛-3-磷酸脱氢酶(GAPDH)、线粒体外膜转位酶20(TOMM20)兔单克隆抗体(英国Abcam公司),β-actin抗体(中国弗德生物公司),过氧化物酶标记山羊抗小鼠IgG(H+L,中国oster 公司)。化学发光凝胶成像系统(上海天能公司),OLYMPUS显微照相系统、普通光学显微镜(日本Olympus 公司),JEM-1400120V型透射电子显微镜(日本电子株式会社)。
1.2 动物模型构建及分组 42 只新生SD 大鼠按照随机数字表法分为Sham 组、CIRI 组、CIRI+DMSO 组、CIRI+Mdivi-1组、CIRI+MCC950 组及CIRI+Ac-YVAD-cmk 组,每组7 只。除Sham 组外,其他各组采用单侧颈总动脉阻断法建立新生大鼠缺氧缺血性脑损伤(HIBD)模型[10]。Sham 组:仅暴露左颈总动脉,不予夹闭。CIRI 组:暴露左颈总动脉,用血管夹夹闭左侧颈总动脉60 min 后恢复血流。CIRI+DMSO 组:造模后立即腹腔注射10%DMSO溶液(0.2 mL)。CIRI+Mdivi-1组:术前30 min 给予Mdivi-1 25 mg/kg 腹腔注射(0.2 mL)。CIRI+MCC950 组:术前30 min 给予MCC950 10 mg/kg 腹腔注射(0.2 mL)。CIRI+Ac-YVAD-cmk 组:术前30 min 给予Ac-YVAD-cmk 2 mg/kg腹腔注射(0.2 mL)。
1.3 主要观察指标 (1)神经行为障碍评分:HIBD模型制备后24 h,Londa法进行神经行为障碍评分[10]。(2)苏木精-伊红染色法(HE)检测海马CA1区细胞形态:组织置于4%多聚甲醛中固定24 h,梯度乙醇脱水。将乙醇置换为二甲苯进行标本透明、浸蜡及石蜡包埋。选取海马体最大切面,3µm连续切片。用二甲苯脱蜡,梯度乙醇复水后,将切片置于中性树胶封片。使用普通光学显微镜观察各组海马CA1 区细胞形态。(3)透射电子显微镜观察神经元超微结构:完整剥离海马体,取约1 mm3海马CA1区组织,用3%戊二醛固定(4 ℃,24 h),继续予后固定、脱水、包埋等处理,透射电子显微镜观察海马神经元细胞形态、肿胀线粒体数及突触数。(4)Western blot检测线粒体自噬和NLRP3炎症小体通路相关蛋白表达:将新鲜组织放入RIPA 裂解液中研磨后于4 ℃12 000 r/min 离心10 min。SDS-PAGE电泳(恒压60 V 30 min后120 V 60 min),使用0.22µm PDVF 膜在转膜液中进行转膜(300 mA 60 min及250 mA 60 min)。用TBST洗膜后分别加入一抗稀释液(均1∶1 000)4 ℃孵育过夜;TBST 漂洗后加用相应种属稀释二抗(1∶5 000)孵育2 h,洗涤后ECL显影及曝光,使用化学发光凝胶成像系统Tanon-5200检测,采用Image J软件分析灰度值。以β-actin 或GAPDH 作为内参照,检测PINK1、Parkin、TOMM20、LC3Ⅱ/Ⅰ、P62 及NLRP3、ASC、caspase-1、caspase-8蛋白表达情况,每组取1只,重复3次。
1.4 统计学方法 采用Graph Prism 8.0.2 统计软件分析数据。符合正态分布的计量资料用表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 神经行为障碍评分 与Sham 组比较,CIRI 组神经行为障碍评分均增加(P<0.05);与CIRI+DMSO 组比较,CIRI+Mdivi-1 组神经行为障碍评分增加(P<0.05);与CIRI+Mdivi-1 组比较,CIRI+MCC950组及CIRI+Ac-YVAD-cmk 组神经行为障碍评分降低(P<0.05),见图1。
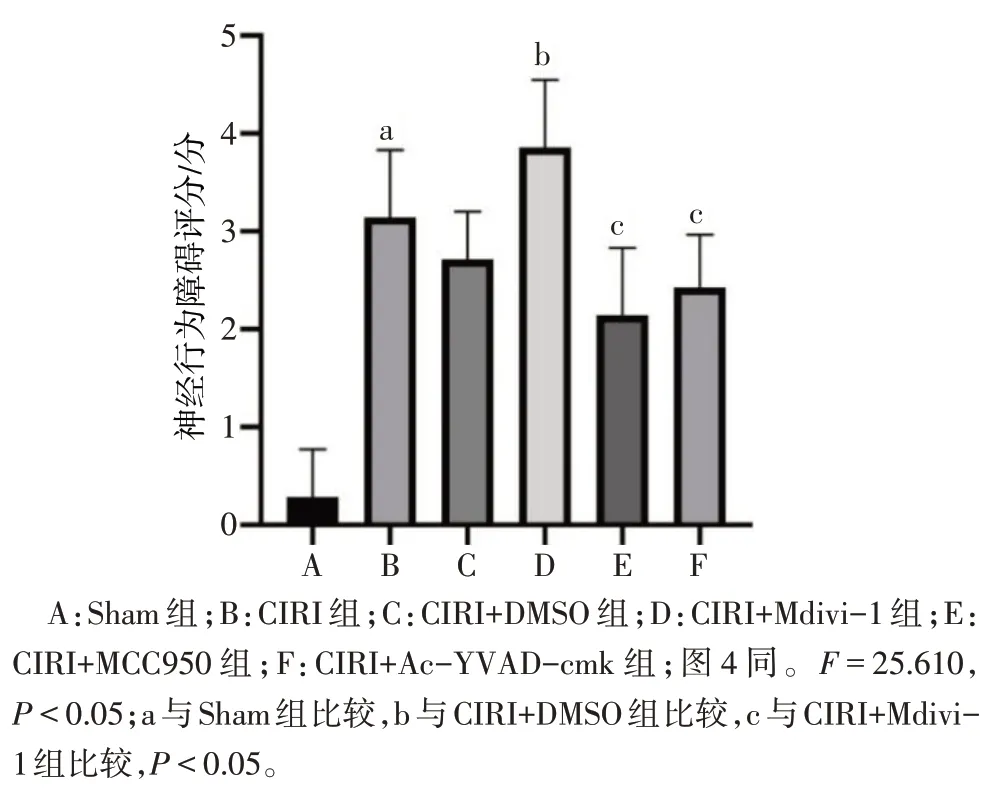
Fig.1 Statistical chart of neurobehavioral disorder scores in each group图1 各组神经行为障碍评分统计图
2.2 海马CA1 区细胞形态 在新生大鼠海马CA1区,Sham 组神经元排列整齐紧密,无细胞核固缩及核碎裂;CIRI 组及CIRI+DMSO 组神经元均排列疏松、紊乱,出现空泡化及水肿,可见较多核固缩及核碎裂;CIRI+Mdivi-1 组可见明显神经元空泡化及水肿,细胞排列杂乱、疏松,可见较多核固缩;CIRI+MCC950组细胞排列整齐,无空泡化,有少量核固缩及核碎裂;CIRI+Ac-YVAD-cmk 组细胞分布疏松、排列紊乱,核固缩及核碎裂多见,见图2。
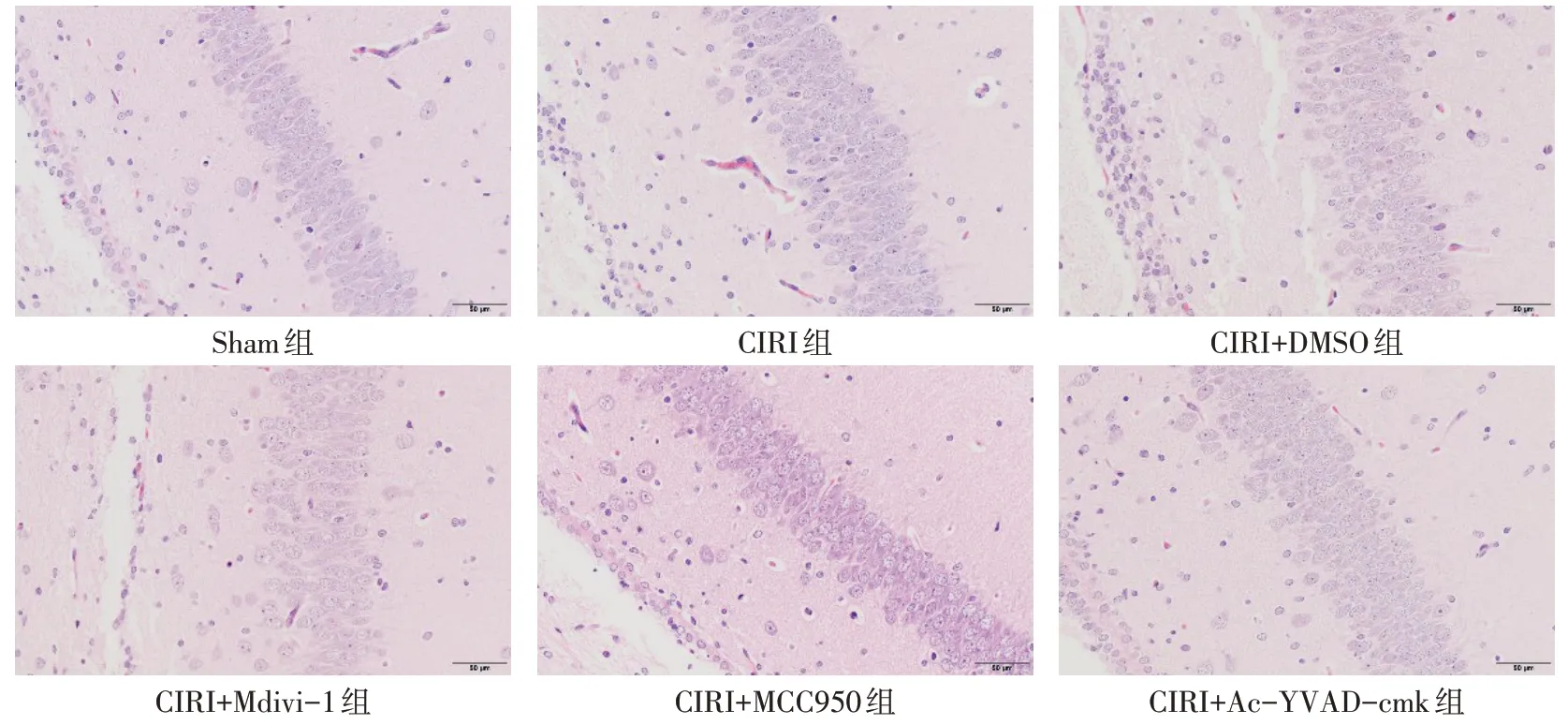
Fig.2 Morphological manifestations of hippocampal CA1 tissue in each group of newborn rats(HE staining,×400)图2 各组新生大鼠海马CA1区形态学表现(HE染色,×400)
2.3 神经元细胞超微结构 在新生大鼠海马CA1区,Sham 组神经元核膜完整,线粒体及突触结构清晰,突触小泡数量较多、排列紧密;与Sham 组比较,CIRI组与CIRI+DMSO组部分神经元核膜断裂,线粒体嵴断裂,肿胀线粒体数增多,突触小泡稀疏且数量减少,突触前膜结构模糊,后膜肿胀;与CIRI+DMSO组比较,CIRI+Mdivi-1 组神经元核膜断裂,胞核碎裂,线粒体嵴中断或消失,肿胀线粒体数增多,突触小泡数量明显减少,突触后膜水肿,可见凋亡神经元;CIRI+MCC950 组神经元核膜清晰,部分线粒体呈空泡样改变,可见线粒体自噬体及突触小泡,突触结构完整,与CIRI+DMSO 组和CIRI+Mdivi-1 组比较,突触数增多,肿胀线粒体数减少;CIRI+Ac-YVAD-cmk组神经元核膜模糊,部分线粒体嵴中断,线粒体及突触小泡数量减少,突触后膜肿胀,线粒体自噬体少见,与CIRI+DMSO组和CIRI+Mdivi-1组比较,突触数增多,肿胀线粒体数减少,见表1、图3。
Tab.1 Comparison of synapses and swelling mitochondrias observed by transmission electron microscopy in the hippocampus CA1 tissue between six groups of neonatal rats表1 各组新生大鼠海马CA1区透射电镜观察结果比较(n=7,个/视野,)
Tab.1 Comparison of synapses and swelling mitochondrias observed by transmission electron microscopy in the hippocampus CA1 tissue between six groups of neonatal rats表1 各组新生大鼠海马CA1区透射电镜观察结果比较(n=7,个/视野,)
**P<0.01,*P<0.05;a与Sham组比较,b与CIRI+DMSO组比较,c与CIRI+Mdivi-1组比较,P<0.05;表2—3同。
组别Sham组CIRI组CIRI+DMSO组CIRI+Mdivi-1组CIRI+MCC950组CIRI+Ac-YVAD-cmk组F突触数4.143±0.690 2.286±0.756a 2.286±0.951a 0.857±0.378b 5.286±0.756bc 4.429±0.535bc 39.570**肿胀线粒体数0.857±0.378 3.714±0.488a 4.000±0.817a 6.143±0.900b 1.714±0.756bc 2.857±0.690bc 50.250**
2.4 各组新生大鼠海马组织中线粒体自噬-NLRP3炎症小体相关蛋白表达情况 与Sham组比较,CIRI组PINK1、Parkin、LC3Ⅱ/Ⅰ及NLRP3、ASC、caspase-1、caspase-8 蛋白表达增加,TOMM20、P62 蛋白表达降低(P<0.05);与CIRI+DMSO组比较,CIRI+Mdivi-1 组PINK1、Parkin、LC3 Ⅱ/Ⅰ蛋白表达下调,TOMM20、P62、NLRP3、caspase-8、caspase-1 蛋白表达增加(P<0.05)。与CIRI+Mdivi-1 组比较,CIRI+MCC950 组及 CIRI+Ac-YVAD-cmk 组 PINK1、Parkin、LC3Ⅱ/Ⅰ蛋白表达增加,CIRI+MCC950 组NLRP3、caspase-1、caspase-8 蛋白及CIRI+Ac-YVAD-cmk 组caspase-1、caspase-8 蛋白表达下调(P<0.05),见图4,表2、3。
Tab.2 Comparison of mitophagy protein relative expression levels in hippocampal CA1 tissue of newborn rats between the groups表2 各组大鼠新生大鼠海马CA1区线粒体自噬相关蛋白相对表达水平比较(n=3,)
Tab.2 Comparison of mitophagy protein relative expression levels in hippocampal CA1 tissue of newborn rats between the groups表2 各组大鼠新生大鼠海马CA1区线粒体自噬相关蛋白相对表达水平比较(n=3,)
组别Sham组CIRI组CIRI+DMSO组CIRI+Mdivi-1组CIRI+MCC950组CIRI+Ac-YVAD-cmk组F PINK1 0.583±0.149 1.114±0.293a 1.096±0.283a 0.581±0.073b 1.628±0.395c 1.388±0.341ac 6.860**Parkin 0.373±0.056 0.867±0.125a 0.864±0.126a 0.413±0.027b 1.263±0.256c 0.903±0.168c 15.740**TOMM20 1.508±0.325 0.861±0.195a 0.895±0.143a 1.874±0.275b 0.746±0.092c 0.854±0.166c 13.670**LC3Ⅱ/Ⅰ0.177±0.062 0.345±0.103a 0.365±0.128a 0.183±0.047b 0.530±0.163c 0.377±0.081c 4.830*P62 1.284±0.238 0.719±0.037a 0.723±0.032a 1.425±0.099b 0.623±0.067c 0.685±0.079c 27.510**
Tab.3 Comparison of NLRP3 inflammasome protein relative expression levels in hippocampal CA1 tissue of newborn rats between the groups表3 各组大鼠新生大鼠海马CA1区NLRP3炎症小体蛋白相对表达水平比较(n=3,)
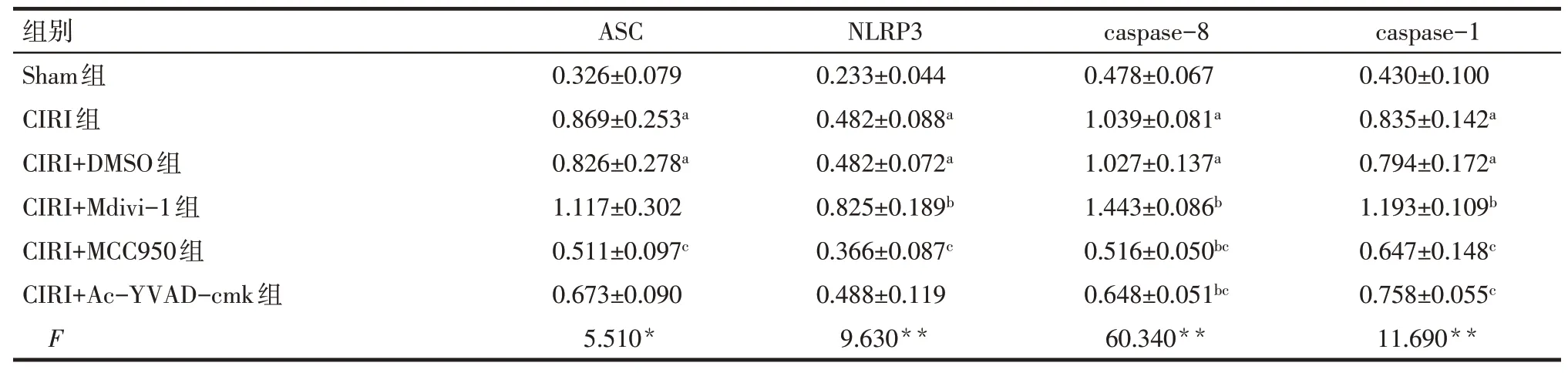
Tab.3 Comparison of NLRP3 inflammasome protein relative expression levels in hippocampal CA1 tissue of newborn rats between the groups表3 各组大鼠新生大鼠海马CA1区NLRP3炎症小体蛋白相对表达水平比较(n=3,)
组别Sham组CIRI组CIRI+DMSO组CIRI+Mdivi-1组CIRI+MCC950组CIRI+Ac-YVAD-cmk组F 0.326±0.079 0.869±0.253a 0.826±0.278a 1.117±0.302 0.511±0.097c 0.673±0.090 5.510*0.233±0.044 0.482±0.088a 0.482±0.072a 0.825±0.189b 0.366±0.087c 0.488±0.119 9.630**0.478±0.067 1.039±0.081a 1.027±0.137a 1.443±0.086b 0.516±0.050bc 0.648±0.051bc 60.340**0.430±0.100 0.835±0.142a 0.794±0.172a 1.193±0.109b 0.647±0.148c 0.758±0.055c 11.690**ASCNLRP3caspase-8caspase-1
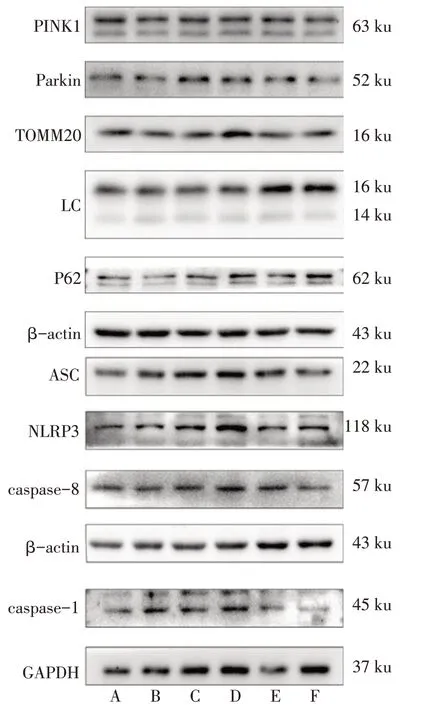
Fig.4 Western blot bands of mitophagy-NLRP3 inflammasome protein in hippocampal CA1 tissue in each group of newborn rats图4 各组新生大鼠海马CA1区线粒体自噬-NLRP3炎症小体蛋白Western blot条带
3 讨论
目前,有关NLRP3炎症小体激活与线粒体自噬在新生大鼠CIRI 中的相互作用和调控机制尚未完全阐明[11]。NLRP3 炎症小体是在脑缺血中研究较多的炎症小体,其介导的脑缺血损伤与炎症反应密切相关[4]。Gong 等[12-13]发现,NLRP3 炎症小体在CIRI后主要在神经元中表达。在脑缺血体外神经元模型中,缺血导致神经元中NLRP3炎症小体各组成蛋白表达增加及活化后产物增多,提示脑缺血导致神经元NLRP3 炎症小体的活化。而抑制NLRP3 炎症小体可抑制星形胶质细胞和小胶质细胞激活,降低炎症因子的水平,从而减轻脑缺血后的炎症反应[14-15]。线粒体保护剂可抑制脑缺血-再灌注后NLRP3 炎症小体的活化[12]。本研究结果显示,在CIRI 组NLRP3 炎症小体各组成蛋白(NLRP3、ASC)表达增加,活化后产物(caspase-1、caspase-8)增多,表明新生大鼠CIRI 可导致NLRP3 炎症小体活化。使用NLRP3 炎症小体抑制剂MCC950 后,新生乳鼠的神经行为障碍评分、海马CA1 区神经元形态学表现及超微结构均较CIRI+DMSO 组改善,提示抑制NLRP3 炎症小体的活化可改善新生乳鼠的CIRI。同时,透射电镜发现,加入MCC950后线粒体自噬体增多,线粒体自噬相关蛋白表达水平增加,提示抑制NLRP3 炎症小体活化可以激活线粒体自噬,改善神经元突触结构改变,改善新生大鼠CIRI 的神经损伤。
线粒体自噬作为一种选择性自噬,可消除功能失调或多余的线粒体,从而微调线粒体的数量,维持能量代谢[16]。激活线粒体自噬可清除过度聚集和受损的线粒体,从而减少CIRI 引起的神经元损伤[17]。受损线粒体及其释放的线粒体信号在调节NLRP3炎症小体活化中起关键作用[9]。He等[18]发现,激活Parkin途径依赖的线粒体自噬可抑制NLRP3炎症小体激活,减少CIRI。本研究结果显示,加入Mdivi-1后NLRP3 炎症小体相关蛋白表达水平较CIRI+DMSO组明显增加。同时CIRI+Mdivi-1组新生乳鼠的神经行为障碍评分较CIRI+DMSO 组增加,海马CA1 区神经元形态学表现及超微结构明显损伤,提示抑制线粒体自噬可激活NLRP3炎症小体,加重新生乳鼠的CIRI。
NLRP3 炎症小体和caspase-1 介导细胞焦亡通路的激活是脑出血后神经功能缺损的最常见原因[19]。活化的caspase-1引起细胞膜穿孔,从而诱导细胞凋亡并诱发强烈的炎症反应[20]。Ac-YVAD-cmk 是caspase-1 选择性抑制剂,已被证明对缺血性脑损伤及脑出血有神经保护作用[21-22]。本研究结果显示,CIRI+Ac-YVAD-cmk 组的海马CA1 区神经元形态学表现及超微结构较CIRI+DMSO组改善,提示抑制caspase-1活化有神经保护作用。
综上所述,抑制线粒体自噬可引起NLRP3 活化,加重新生大鼠缺血性脑损伤;而抑制NLRP3 活化可激活线粒体自噬,神经损伤减轻。增强线粒体自噬或抑制NLRP3 炎症小体活化可能是治疗HIE的药物研究方向。
