湿法磷酸中脱除重金属的工艺研究
2023-11-15李荣杰徐金桥杨培发李志刚
严 山,李荣杰,赵 军,徐金桥,杨培发,李志刚
(中国五环工程有限公司,湖北 武汉 430223)
伴随着磷酸生产过程的精细化,无论热法磷酸[1]或湿法磷酸,电子级磷酸还是医药级磷酸,都对净化技术提出了越来越高的要求。作为净化技术的一个重要分支,磷酸脱砷也得到了发展。磷酸中的砷(以As计)是以亚砷酸(HAsO2)或砷酸(HAsO3)的形式存在,脱砷的主要方法有化学法[2]、电化学法、萃取法和结晶法[3]等。
1 脱砷的主要方法
化学法脱砷是将磷酸中的砷以As2S3、As2S5的形式沉淀分离,通常是向磷酸中加入Na2S水溶液、P2S5固体以及H2S气体,气-液-固三相的处理各具特色,无论是加入哪种形式的硫化物,通常认为起作用的是H2S,即以下反应进行脱砷:

传统的Na2S溶液脱重金属工艺流程见图1。
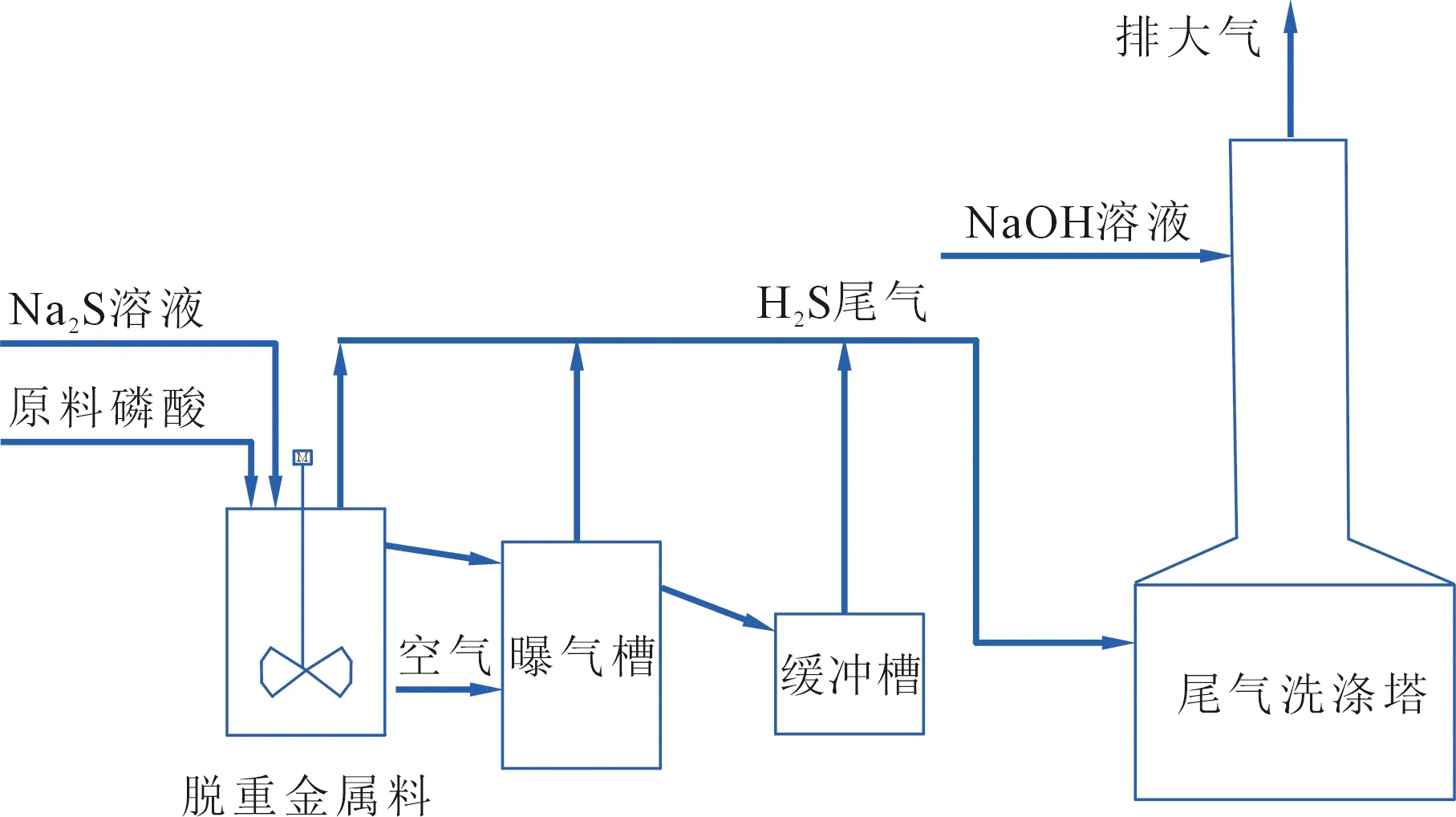
图1 传统的Na2S溶液脱重金属工艺流程
传统的Na2S溶液脱重金属工艺采用Na2S与原料湿法磷酸在带有搅拌器的反应槽中进行反应,首先是Na2S与磷酸反应产生H2S,H2S溶解于磷酸中,与As发生反应生成As2S3、As2S5,而由于H2S在磷酸中溶解度较小[4],大量H2S迅速解析出来进入到气相中,最终进入尾洗系统,通过碱性尾洗液吸收。

电化学法、萃取法和结晶法目前在湿法磷酸领域尚未实现工业化应用,还处于基础理论研究阶段。
2 湿法磷酸脱重金属新工艺
湿法磷酸脱重金属新工艺是采用Na2S溶液与稀磷酸反应,制备得到湿H2S气体,经过滤除水后得到较纯净的H2S气体,将H2S气体通入到原料湿法磷酸中,过量H2S与原料湿法磷酸中的HAsO2/HAsO3反应形成As2S3/As2S5沉淀,脱As的同时,过量H2S还会与原料湿法磷酸中的Mn2+、Zn2+、Cu2+、Hg2+、Pb2+等金属离子发生反应,生成MnS、ZnS、CuS、HgS等硫化物难溶沉淀,反应方程式如下:




优化汽轮机回热系统的目的在于提高锅炉给水温度,减少锅炉传质温差,降低温差传热产生的不可逆传热损失,提高机组的热经济性。同时,通过提高锅炉给水温度来抬升锅炉脱硝装置入口烟气温度,扩展SCR脱硝装置运行负荷区间[5]。回热系统优化的实质是提升以朗肯循环为基础的蒸汽动力循环效率,提升汽水工质在锅炉内吸热过程的平均温度降低蒸汽在汽轮机内放热过程的平均温度

在H2S气体与原料湿法磷酸中的重金属反应后,过量的H2S气体通过循环返回到气体H2S入口,再次与原料湿法磷酸中的重金属反应。脱重金属之后,溶解在原料湿法磷酸中的饱和H2S通过曝气吹出脱砷磷酸液相,进入尾气系统。在尾气系统汇总后,通过NaOH溶液吸收得到Na2S溶液,Na2S溶液循环使用,返回H2S制备系统与稀磷酸继续反应制备H2S,Na2S溶液与稀磷酸反应后的磷酸氢钠溶液通过曝气,将溶解在磷酸氢钠溶液中的过量H2S解析出来,进入到尾气洗涤系统中,与脱砷磷酸曝气出来的尾气汇总。工艺流程见图2。


3 脱砷理论计算
按照溶度积理论,假设硫化砷在磷酸溶液中的溶度积近似等于其在水中的溶度积。

当25℃是上述反应达到平衡的温度时,
Ksp=[c(H2S)]3·[c(HAsO2)]2=2.1×1022
食品级磷酸(85%H3PO4)中As的指标为≤0.5mg/kg,则c(HAsO2)≤1.0×10-5mol/L,故要求平衡时,c(H2S)≥1.2×10-4mol/L。
85%H3PO4在75kPa H2S分压,60℃条件下,摩尔分数x(H2S)为3.0×10-4[4],计算得到溶解在85%H3PO4中的H2S浓度为0.008mol/L,该浓度为As浓度为0.5 mg/kg平衡下c(H2S)浓度的63倍。
85%H3PO4稀释至55%H3PO4,折55%H3PO4中As的浓度为0.32mg/kg,则c(HAsO2)≤0.66×10-6mol/L,故要求平衡时,c(H2S)≥1.68×10-4mol/L。在75kPa H2S分压,60℃条件下,摩尔分数x(H2S)为5.5×10-4,计算得到溶解在55%H3PO4中的H2S浓度为0.026mol/L,该溶解浓度为As浓度为0.32mg/kg平衡下c(H2S)浓度的155倍。因此,通过H2S脱砷在理论上是可行的。
由于H2S在磷酸中的溶解度处于饱和溶解状态,其在磷酸中的摩尔分数为10-4数量级,温度越高,越有利于脱H2S,因此采用热空气曝气可以将磷酸中溶解的H2S充分脱除。
4 H2S脱重金属新工艺与传统工艺对比
脱重金属以脱砷为例,从脱砷效率、工艺安全性、循环经济性对比分析H2S循环脱重金属新工艺与传统Na2S溶液脱重金属工艺。
4.1 脱砷效率
使用传统的Na2S溶液脱重金属,由于其反应过程中大量的Na2S首先与磷酸反应生成H2S,H2S在磷酸中的溶解度较低,且气相的H2S分压较低,大量的H2S在微负压的工况下迅速从磷酸中解析出来,进入气相,导致脱砷磷酸中的As含量>1mg/kg,达不到精脱重金属的目的。而采用新工艺,在同样的磷酸指标情况下,过量的H2S气体以较高浓度循环进入磷酸中与重金属反应,磷酸中的H2S始终处于饱和状态,反应时间较传统工艺更长,H2S在磷酸中的浓度更高,使得脱重金属后的磷酸中As指标可以达到0.32mg/kg,折85%H3PO4达到0.5mg/kg,达到精脱重金属的目的。
4.2 工艺安全性
H2S循环脱重金属新工艺与传统Na2S溶液脱重金属工艺在安全性方面的对比分析见表2。
4.3 循环经济性
新工艺包含两个H2S循环利用圈。第一个循环圈是在脱砷过程中,过量气体H2S循环脱砷,将H2S的消耗量降到最低,同时在原料磷酸中H2S相对磷酸中的As等重金属显著过量,又保证了脱重金属的效率。在第一个循环圈中,S元素的利用率为14.5%。
第二个循环圈是在尾气洗涤系统中,将尾气洗涤下来的Na2S溶液再次返回到制备H2S系统中,使得原料Na2S和NaOH的消耗量大大降低,在第二个循环圈中,S元素的利用率为99.9%。
通过两个循环利用圈,使S元素最大限度地在脱砷过程中发挥作用,从而使得S元素的利用率显著提高。传统Na2S溶液脱重金属工艺由于H2S显著过量,导致大量的H2S未参与脱除重金属而直接进入尾气系统,因此H2S利用率只有30%;而采用新工艺后,脱砷反应过程中的H2S的利用率可以达到95.8%以上,新工艺S元素的总利用率较传统工艺提高3.2倍。两种工艺的循环经济性总结见表3。
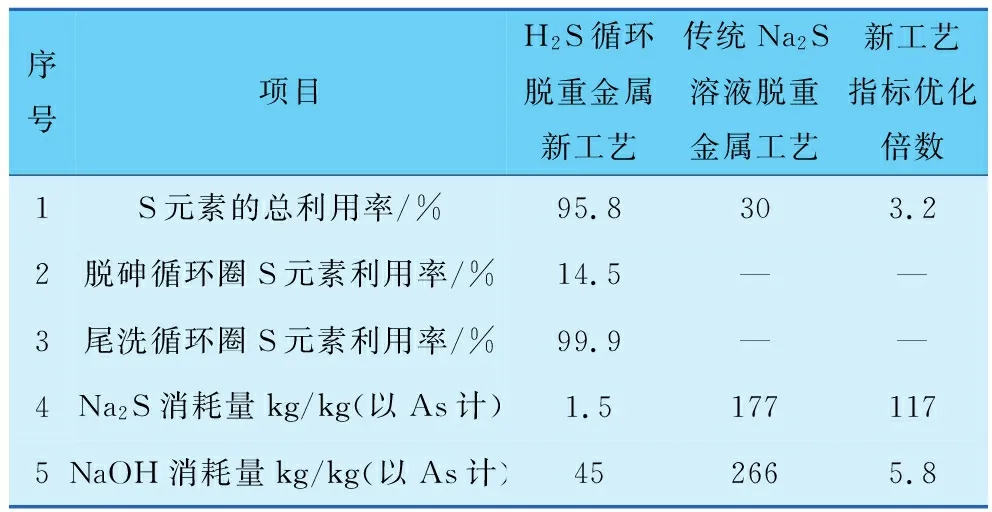
表3 H2S循环脱重金属新工艺与传统Na2S溶液脱重金属工艺的循环经济性对比

表4 H2S循环脱重金属新工艺与传统Na2S溶液脱重金属工艺尾气排放指标对比
4.4 尾气排放指标
在传统Na2S溶解脱重金属工艺中,大量的H2S未参与而直接进入尾洗,导致尾洗的尾气量达到10 400m3/kg(以As计),同时消耗的NaOH量达到了266kg/kg(以As计)。
新工艺由于只有脱砷磷酸和磷酸氢钠溶液曝气过程中产生的H2S进入尾洗,进入尾洗的H2S显著减少,可以减少NaOH的使用量。同时,尾洗抽气量也可以大幅减少至4 800m3/kg(以As计),尾洗不产生废水,尾洗液进入到制备H2S系统中循环利用。
5 经济分析
由于本新工艺在脱砷效率及循环经济性上有诸多优势,例如产品质量升级,在生产中所使用的辅助原料消耗量也有大幅下降,其直接经济影响见表5。除产品及原材料带来的直接经济影响外,由于本工艺的尾气流量小、工艺安全性高,在设计建造以及生产过程中对于安全、环保等方面的支出亦可相应减少。综合计算,以3万t/a磷酸(85%H3PO4)为例,通过新工艺,可创造效益865.4万元/a。
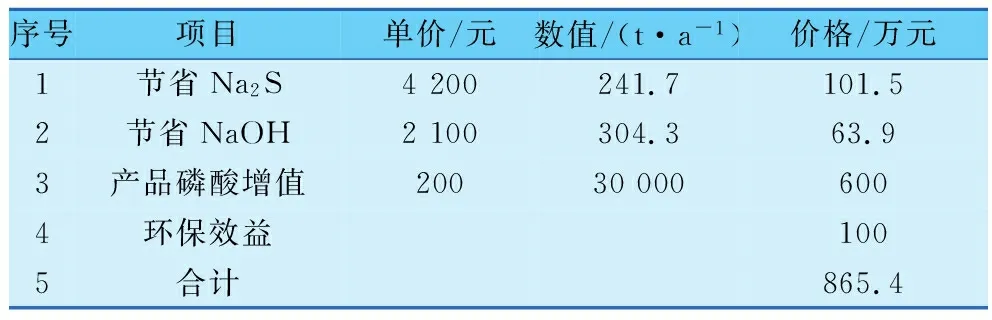
表5 新工艺创造效益(以3万t/a磷酸(85%H3PO4)为例)
6 结语
(1)本文所介绍的H2S循环脱湿法磷酸重金属的新工艺,采用Na2S与稀磷酸反应制取H2S气体,制得的H2S气体在一定压力下过量通入湿法磷酸中进行脱砷,反应结束后过量的H2S气体可被收集,送至H2S气体入口进行循环利用。脱砷酸中溶解的少量H2S气体通过热空气曝气去除。
(2)相对于传统工艺,本新工艺拥有更好的脱除效率、工艺安全性、循环经济性以及技术经济性,在废气排放方面也有较大优势;可以实现脱As后,(折85%H3PO4)As指标降至0.5mg/m3;同时,使得原料Na2S和NaOH的消耗量大大降低,分别由传统工艺的177kg/kg(以As计)、266kg/kg(以As计)下降到1.5kg/kg(以As计)、45kg/kg(以As计),优化倍数达到了117倍、5.8倍。在第二个循环圈中,S元素的利用率为99.9%。H2S循环脱重金属新工艺的尾气量由传统工艺的10 400 m3/kg(以As计)减至4 800 m3/kg(以As计)。
