放血和刮痧疗法单一及联合应用对全身炎症反应综合征模型大鼠炎症的影响
2023-11-14林丽莉李一纯汤文政吴丽华
林丽莉,李一纯,汤文政,吴丽华,林 栋*
(1.福建省中医药科学院,福建 福州 350003;2.福建中医药大学针灸学院,福建 福州 350122;3.福建省立医院,福建 福州 350001)
在针灸临床干预体系中,大多采用多种干预方式的联合应用,但是不同干预方式联合应用会产生增效性或等效性,抑或是减效性,却常常被忽略[1]。针灸疗法不同的干预方式之间存在协同或拮抗的可能,已有研究提示体表干预的物理刺激方式对机体产生最大效应与其干预次序存在相关性[1-2]。全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)属于中医外感热病学及温病学的范畴,以“热毒”“痰”“瘀”“虚”为基本证候特征[3]。基于经络腧穴理论为指导的刮痧、放血干预方式属于针灸临床干预体系的一部分,具有开腠理、行气血、散邪毒的功效。本研究通过制备SIRS模型大鼠,以大鼠血清、肺组织关键炎性因子含量与肺病理组织形态学的改变作为主要观察指标,探究刮痧和放血疗法单一和联合应用对SIRS 模型大鼠炎症反应的效应,以期为临床干预及SIRS 等相关感染性疾病的救治策略提供借鉴。
1 材料与方法
1.1 试验动物 选用SPF 级健康成年雌性Wistar大鼠42 只,6~8 周龄,体质量(200±20)g,购自上海斯莱克实验动物有限责任公司,生产许可证号:SCXK(沪)2017-0005,饲养于福建中医药大学实验动物中心SPF 级动物实验室,实验动物使用许可证号:SYXK(闽)2019-0007。动物饲养于恒温、恒湿环境,恒定温度(22±1)℃,湿度为50%,光照明暗时间各12 h 交替,大鼠自由进食与饮水。本实验经福建中医药大学动物实验伦理委员会批准(批件号:FJTC-MIACUC2020059)。
1.2 试剂与器材 酵母多糖(美国Sigma 公司,型号:Z4250-5G);注射用乌司他丁(广东天普生化医药股份有限公司);医用液体石蜡(南昌华鑫医药化工有限公司);大鼠肿瘤坏死因子-α(TNF-α)、大鼠白细胞介素-6(IL-6)、大鼠γ 干扰素(IFN-γ)ELISA检测试剂盒均购自武汉博士德生物工程有限公司;一次性使用末梢采血针(天津华鸿科技股份有限公司);小型刮痧板(重庆谭木匠工艺品有限公司);全自动动物血液分析仪(日本Sysmex 公司);RM2235石蜡切片机(德国LEICA 公司);ZT-14V1 生物组织自动脱水机(孝感亚光医用电子技术有限公司)。
1.3 酵母多糖-石蜡油混悬液的制备 首先在磁力搅拌器上放置已准确量取100 mL 液体石蜡的玻璃量杯,接着手持20 mL 注射器针头,将5 g 酵母多糖粉剂逐渐少量拨入液体石蜡中,混匀后换装至EP 管中高频振荡15 min;而后使用100 ℃水浴进行灭菌80 min,待冷却后放置于4 ℃冰箱储存备用。使用前需使用恒温水浴锅中加热至40 ℃,并充分摇匀,继而制备出50 mg/mL 酵母多糖-石蜡油混悬液以待使用。
1.4 实验分组与造模方法 将42 只SPF 级Wistar雌性大鼠依照随机数字表法分成空白组、模型组、放血组、刮痧组、刮痧+放血组、放血+刮痧组、乌司他丁组,每组6 只。空白组不予造模,以大鼠体质量500 mg/kg 腹腔注射灭菌石蜡,其余6 组参照Goris 法[4]并结合参考文献[5-7]建立SIRS 大鼠模型。造模前18 h 大鼠禁食,不禁水,自由活动。造模时测直肠温度,以大鼠体质量500 mg/kg 腹腔注射50 mg/mL 酵母多糖-石蜡油混悬液,当造模大鼠的直肠温度较正常或造模前升高1 ℃、白细胞总数大于正常值2 倍时,即判定SIRS 大鼠模型造模成功[8]。
1.5 干预方法 参考《实验针灸学》[9]及人体相关穴位的解剖标志,采用拟人对照法取穴,放血部位取大鼠双侧少商穴,定位和取穴方法参考文献[10-11],取第1 指桡侧、爪根角旁开0.1 cm 处;刮痧部位取大鼠双侧肺俞穴(第3 胸椎下两旁肋间)和大椎穴(背部正中第7 颈椎与第1 胸椎之间)。① 刮痧操作:轻按大鼠头部进行固定,持小型刮痧板与皮肤夹角约在45°~60°,自头部向尾部方向进行刮痧,操作频次为2 次/s,持续60 s。② 放血操作:在大鼠双侧少商穴处使用一次性无菌末梢采血针,固定大鼠前肢,直刺穴位后迅速出针,出血量约4~6滴(约0.2~0.3 mL)。③ 乌司他丁给药:根据注射用乌司他丁的临床使用说明[12],结合《实验针灸学》中“实验动物与人用药量的换算方法”[9],本实验中乌司他丁组的给药剂量定为2.7 万U/kg。④ 各组具体干预方法:空白组和模型组仅模拟抓取动作;乌司他丁组分别于造模后2、24 h 进行腹腔注射乌司他丁;放血组分别于造模后2、24 h 进行放血;刮痧组分别于造模后2、24 h 进行刮痧;放血+刮痧组于造模后2 h 进行放血,于造模后24 h 进行刮痧;刮痧+放血组于造模后2 h 进行刮痧,于造模后24 h进行放血。
1.6 取材
1.6.1 收集血清 采集大鼠腹主动脉血3~4 mL,将血液标本置于一次性真空采血管中静置1~2 h,使其血清与血浆初步分层;而后使用高速冷冻离心机以4 ℃、3 000 r/min 离心15 min,将血清从采血管移置EP 管内,进行二次离心操作;最后将所得血清样本分装,并放入-80 ℃冰箱保存备用。
1.6.2 肺组织取材 在采集完腹主动脉血后按大鼠体质量0.5 mL/100 g 腹腔注射20%乌拉坦对大鼠进行麻醉,解剖大鼠取出肺组织,并使用预冷的0.9% NaCl 洗涤,去除水分;取大鼠左肺组织置于提前装有4%多聚甲醛固定液的EP 管中用于HE 染色;取大鼠右肺下叶组织放置于EP 管中并即刻放入干冰,短时间内转移至-80 ℃冰箱保存,用于检测炎症因子含量。
1.7 观察指标
1.7.1 肺组织病理形态学观察 左肺组织在4%多聚甲醛固定液中固定24 h 后,使用流水冲洗清除组织上的多聚甲醛残留液体,随后放置于70%乙醇中过夜后进行梯度脱水、透明及浸蜡、石蜡包埋、HE染色,HE 染色后的载玻片放置于干燥通风的橱窗内自然风干封片后,在光镜下观察肺组织病理学变化。1.7.2 大鼠血清TNF-α、IL-6和INF-γ含量检测 取出保存在-80 ℃冰箱的血清样本,取上清液加样于酶标本孔,余下操作严格按照相应指标ELISA 检测试剂盒说明书进行,用酶标仪测定吸光度后绘制标准曲线,计算TNF-α、IL-6 和INF-γ 含量。
1.7.3 大鼠肺组织TNF-α、IL-6 和INF-γ 含量检测 在一次性研磨管内加入1 mL 增强型RIPA 裂解液、10 μL PMSF 蛋白酶抑制剂及一次性研磨磁珠,称取100 mg 右肺组织,剪碎后放入各研磨管内;研磨管置于研磨机中已提前预冷的金属槽内,并以64 Hz 频率研磨50 s,共运行2 次使其充分匀浆;研磨后使用移液枪将上清液抽取至新的EP 管内,并置于高速冷冻离心机中以4 ℃、12 000 r/min 离心10 min;取上清液加样于酶标本孔,余下操作严格按照相应指标ELISA 检测试剂盒说明书进行,用酶标仪测定吸光度后绘制标准曲线,计算TNF-α、IL-6 和INF-γ 含量。
1.8 统计学方法 采用SPSS 23.0 软件进行实验数据处理和分析。计量资料符合正态分布以(±s)表示,多组间比较采用单因素方差分析,组间两两比较若方差齐采用LSD-t检验,若方差不齐则采用Games-Howell 检验。P<0.05 表示差异具有统计学意义。
2 结 果
2.1 7 组大鼠血清TNF-α、IL-6、IFN-γ含量比较 见表1。
表1 7 组大鼠血清TNF-α、IL-6、IFN-γ 含量比较(±s) pg/mL

表1 7 组大鼠血清TNF-α、IL-6、IFN-γ 含量比较(±s) pg/mL
注:与空白组比较,1) P<0.05;与模型组比较,2) P<0.05;与乌司他丁组比较,3) P<0.05;与刮痧组比较,4) P<0.05。
IFN-γ 64.81±16.32 198.19±33.231)132.16±30.09 153.72±36.47 103.16±23.962)107.63±14.972)124.39±31.08组别空白组模型组乌司他丁组刮痧组放血组放血+刮痧组刮痧+放血组n6 6 6 6 6 6 6 TNF-α 4.37±1.79 29.29±2.181)14.29±2.452)16.63±1.662)11.56±3.392)12.72±3.412)12.18±6.372)IL-6 65.82±20.12 238.68±46.421)209.39±14.31 203.90±29.47 184.65±28.282)141.17±39.132)3)4)174.84±60.092)
2.2 7 组大鼠肺组织TNF-α、IL-6、IFN-γ 含量比较 见表2。
表2 7 组大鼠肺组织炎性因子TNF-α、IL-6、IFN-γ 含量比较(±s) pg/mL
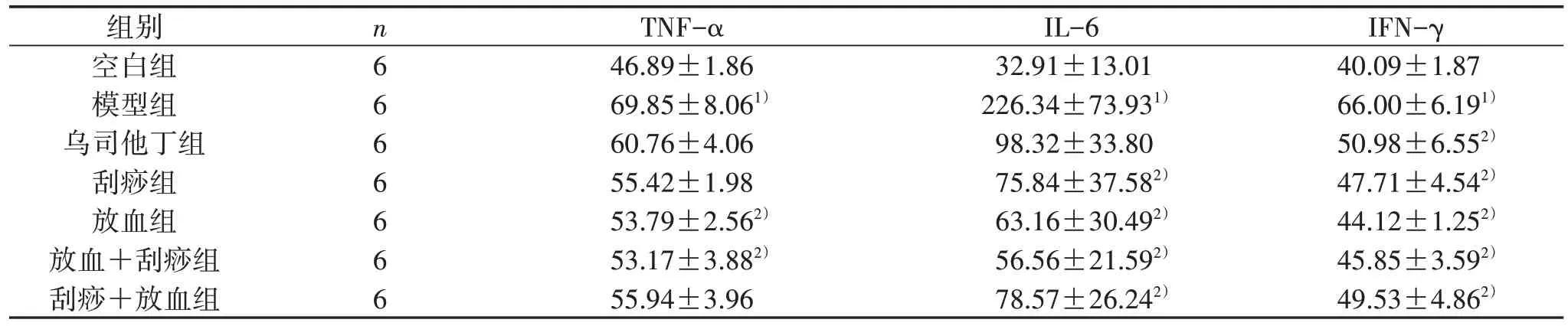
表2 7 组大鼠肺组织炎性因子TNF-α、IL-6、IFN-γ 含量比较(±s) pg/mL
注:与空白组比较,1) P<0.05;与模型组比较,2) P<0.05。
IFN-γ 40.09±1.87 66.00±6.191)50.98±6.552)47.71±4.542)44.12±1.252)45.85±3.592)49.53±4.862)组别空白组模型组乌司他丁组刮痧组放血组放血+刮痧组刮痧+放血组n6 6 6 6 6 6 6 TNF-α 46.89±1.86 69.85±8.061)60.76±4.06 55.42±1.98 53.79±2.562)53.17±3.882)55.94±3.96 IL-6 32.91±13.01 226.34±73.931)98.32±33.80 75.84±37.582)63.16±30.492)56.56±21.592)78.57±26.242)
2.3 7 组大鼠肺组织病理形态学比较 7 组大鼠肺组织HE 染色结果显示:空白组肺泡结构正常、清晰且完整,无明显病理改变,肺泡之间无明显融合,肺泡壁无增厚,肺泡腔内及肺泡壁未见明显的炎症细胞渗出、浸润及透明膜形成等情况;模型组存在明显肺组织结构破坏,肺泡壁明显增厚,肺泡腔塌陷、缩小、变狭长,肺间质以炎症改变为主,在肺间质及肺泡腔内明显可见有大量中性粒细胞、单核巨噬细胞等炎症细胞浸润,部分肺间质区域有红细胞渗出、充血、水肿、肺实变等病理改变;而各干预组大鼠肺组织仍有部分肺泡融合、肺泡壁增厚情况,但已有明显改善,与模型组比较,肺泡结构较为明晰,肺泡腔及肺间质仍见有少量炎症细胞聚集。见图1。

图1 7 组大鼠肺组织病理形态学HE 染色图(×200)
3 讨 论
根据SIRS 炎症急性反应期所表现出“热”“毒”的病机与临床特征,SIRS 属中医温病学的范畴,因此SIRS 也常被辨为“痧证”[13-15]。清初瘟疫派医家郭志邃所著《痧胀玉衡》有言:“血肉痧,看青紫筋刺之,则痧毒有所泄”“痧在肌肤者,刮之而愈;痧在血肉者,放之而愈”“满则泻之,菀陈则除之”,可见具有开腠理、行气血和散邪毒功效的放血与刮痧疗法在古代温病急救中已得到了广泛应用。在针灸临床干预中,大多采用刮痧和放血联合应用的治疗策略[16-17],然而放血与刮痧单一或联合应用,在SIRS炎症急性反应期的干预过程中是否会带来不同的治疗效应?以及联合应用产生的效应是否具有增效性,或仅仅具有等效性,抑或是减效的作用,这些问题目前尚未有系统的研究与解释。
本研究结果表明刮痧和放血疗法能够抑制促炎因子的释放,从而对SIRS 所导致的大鼠急性肺部炎症反应能够起到一定的缓解和保护作用。刮痧所导致的表皮轻度促炎反应,可激活抗原提呈细胞及皮肤免疫反应,促使皮肤肥大细胞释放组胺等物质,从而诱导体液免疫应答[18],最终降低TNF-α、IL-6、INF-γ 的表达。另有研究表明:放血可以使颅脑创伤后的大鼠脑干IL-1β、TNF-α 的表达降低,并能够抑制JNK/p38MAPK 信号通路,改善炎症反应[19];手十二井穴放血能够使大鼠血浆IL-6 水平降低[20]。本研究发现多数干预组对炎症因子均有影响,但多数干预组血清和肺组织各炎症因子含量组间比较,差异均无统计学意义,表明放血和刮痧疗法单一和联合应用对SIRS 模型大鼠的治疗效应相当,不同次序的放血和刮痧联合应用对SIRS 模型大鼠炎症反应的抑制作用亦无差别。
