肠润方对慢传输型便秘小鼠肠道传输功能的影响及机制研究
2023-11-14洪燕秋林金荣魏晓玲肖秋平
洪燕秋,林金荣,魏晓玲,肖秋平*
(1.福建中医药大学附属厦门中医院,福建 厦门 361009;2.厦门市盆底动力学重点实验室,福建 厦门 361009)
慢传输型便秘(slow transit constipation,STC)是慢性便秘最常见的类型,发病率高,约占慢性便秘的46%~74%[1]。结肠动力障碍是STC 最为重要的病理因素,也是目前研究的重点。多数研究认为STC 发生与肠神经系统异常、神经递质改变、结肠Cajal 细胞功能异常、自身免疫功能破坏、肠内微生态环境失衡等多种因素相关[2-4],结肠动力不足引起肠道传输功能减退是其重要的病理机制。肠润方是厦门市中医院耿学斯教授治疗便秘的经验方,前期研究显示本方治疗功能性便秘近期有效率达90.0%,随访3 个月有效率达67.5%[5-6],疗效显著,但作用机制尚不明确。本实验采用肠润方干预STC小鼠,探讨其对肠道传输功能的影响和作用机制,为进一步临床研究提供实验依据。
1 实验材料
1.1 实验动物 SPF 级健康雄性C57BL/6J 小鼠60 只,5~6 周龄,体质量(20±2)g,购自北京维通利华实验动物科技有限公司,许可证号:SCXK(闽)2018-0003。动物饲养于厦门大学实验动物中心,实验动物使用许可证号:SYXK(闽)2018-0009。将小鼠置于独立通风笼具系统(IVC)饲养,室温22~24 ℃,相对湿度50%~60%,光暗周期各12 h,经灭菌的全价配合饲料喂养,自由采食水。本实验由厦门大学实验动物伦理委员会审核批准(批件号:XMULAC20210057)。
1.2 实验药物 肠润方由生白术20 g、枳实15 g、槟榔15 g、玄参15 g、麦冬15 g、火麻仁15 g 组成,药材购自康美药业股份有限公司。将上药以蒸馏水浸泡30 min 后,煎煮2 次,每次用纱布过滤,将2 次滤液合并即为肠润方水煎液。将肠润方水煎液旋蒸浓缩,高、中、低剂量分别浓缩至含生药浓度为0.5、1.0、2.0 g/mL,药物灭菌后于-4 ℃冰箱保存,每周制备1 次。复方地芬诺酯片(新乡市常乐制药有限责任公司,产品批号:H41020205),用研钵研碎后加生理盐水配制成所需浓度的复方地芬诺酯混悬液。
1.3 实验试剂 印度墨汁(福州飞净生物科技有限公司,批号:20210520);蛋白质定量试剂盒(美国Thermo Fisher 公司,批号:QB214754);1∶1 000 稀释的蛋白基因产物9.5(PGP9.5)抗体(批号:14730)、受体酪氨酸激酶(c-kit)抗体(批号:18696)、干细胞因子(SCF)抗体(批号:26582)、β-actin 抗体(批号:20536)均购自武汉三鹰生物技术有限公司。
1.4 实验仪器 高速低温冷冻离心机(美国Scilogex公司,批号:D3024R);GloMax 酶标仪(美国Promega公司,批号:GM3030);旋转蒸发仪(上海民仪电子有限公司,批号:N-1100V);电热恒温鼓风干燥箱(上海森信实验仪器有限公司,批号:DGG-9070A);电泳仪(美国Bio-Rad 公司,批号:041BR126545);凝胶成像分析系统(上海培清科技有限公司,批号:JS-682D)。
2 实验方法
2.1 动物造模与分组 将60 只C57BL/6J 雄性小鼠随机分为正常组15 只和造模组45 只。造模组按体质量12.5 mg/(kg·d)灌胃复方地芬诺酯混悬液制备STC 小鼠模型,正常组予等剂量生理盐水灌胃,每日1 次,造模2 周。2 周后每组各随机抽取5 只小鼠,禁食不禁水16 h,按体质量0.2 mL/20 g 灌胃灭菌处理的印度墨汁,记录小鼠首粒黑便排出时间。收集小鼠6 h 粪便,称重(湿重)后放入电热恒温干燥箱中75 ℃干燥8 h,称量干燥后的粪便重量(干重),计算粪便含水率[粪便含水率=(湿重-干重)/(湿重)×100%]。禁食不禁水16 h,按体质量0.2 mL/20 g 灌胃灭菌处理的印度墨汁,40 min 后颈椎脱臼处死,迅速剖腹摘除从幽门到盲肠末端的全部肠管,在无张力状态下记录肠道全长及墨汁前端到幽门的距离,计算墨汁推进率[墨汁推进率=墨汁末端到幽门的距离/肠道总长度×100%]。与正常组比较,造模组首粒黑便排出时间延长、粪便含水率降低、墨汁推进率升高(P<0.05),则判定造模成功,见表1。将剩余40 只造模组小鼠分为模型组、高剂量组、中剂量组、低剂量组,每组10 只。
表1 造模后2 组小鼠首粒黑便排出时间、粪便含水率、墨汁推进率比较(±s)

表1 造模后2 组小鼠首粒黑便排出时间、粪便含水率、墨汁推进率比较(±s)
注:与正常组比较,1) P<0.05。
墨汁推进率/%61.95±7.51 42.23±6.221)组别正常组造模组n5 5首粒黑便排出时间/min 54.70±7.20 167.80±17.711)粪便含水率/%51.73±6.06 43.53±7.271)
2.2 给药 给药剂量根据人和动物间按体表面积折算的等效剂量系数9.1 倍换算[7],高、中、低剂量组按体质量24.7、12.35、6.175 g/(kg·d)灌胃肠润方水煎液,模型组、正常组按体质量12.5 mL/(kg·d)灌胃生理盐水,连续干预2 周。
2.3 取材 末次给药结束后,小鼠禁食不禁水16 h,脱颈椎处死后切开腹部取出幽门到直肠末端肛管上方的全部肠管组织,截取结肠,取出肠道内容物,剪开肠壁,用0.9%生理盐水将肠管冲洗干净后用OTC 保鲜剂固定,放置于冻存管,液氮速冻后保存于-80 ℃冰箱。
2.4 观察指标
2.4.1 首粒黑便排出时间、粪便含水率、墨汁推进率 操作和计算方法同“2.1”项下方法。
2.4.2 Western blot 检测PGP9.5、c-kit、SCF 蛋白表达量 称取结肠组织100 mg,裂解后取上清,采用BCA 试剂盒测定蛋白浓度。蛋白样品进行SDS 聚丙烯酰胺凝胶电泳;转膜,封闭,一抗(PGP9.5、ckit、SCF)孵育;添加对应的辣根过氧化物酶标记的二抗溶液孵育,ECL 化学发光显色,曝光显影。采用ImageJ 软件进行灰度分析,结果与内参β-actin 灰度比值进行相对定量分析。
2.4.3 qPCR 检测PGP9.5、c-kit、SCF mRNA 相对表达水平 称取约100 mg 结肠组织样品,加液氮研磨,加入裂解液后匀浆,提取总RNA,微量酶标仪测定RNA 浓度。将样品RNA 逆转录为cDNA,以此为 模板,β-actin 为内参,进行qPCR 检测:预变性94 ℃ 5 min,35 个循环,94 ℃ 30 s,56 ℃ 30 s,72 ℃30 s。反应结束后根据2-ΔΔCt计算目标基因的mRNA表达水平。引物序列见表2。

表2 引物序列
2.5 统计学方法 使用SPSS 22.0 进行统计学分析。计量资料属正态分布以(±s)表示,2 组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较方差齐采用LSD-t检验。P<0.05表示差异有统计学意义。
3 结 果
3.1 5 组小鼠首粒黑便排出时间、粪便含水率、墨汁推进率比较 见表3。
表3 5 组小鼠首粒黑便排出时间、粪便含水率、墨汁推进率比较(±s)

表3 5 组小鼠首粒黑便排出时间、粪便含水率、墨汁推进率比较(±s)
注:与正常组比较,1) P<0.05;与模型组比较,2) P<0.05;与低剂量组比较,3) P<0.05。
墨汁推进率/%83.00±10.74 27.75±7.771)77.32±10.372)3)80.55±14.482)3)60.73±14.092)组别正常组模型组高剂量组中剂量组低剂量组n 10 10 10 10 10首粒黑便排出时间/min 95.80±11.20 265.00±45.051)128.50±42.362)135.10±30.802)136.50±43.372)粪便含水率/%50.46±5.81 39.47±5.731)45.46±4.692)3)47.71±8.362)43.11±3.42
3.2 5 组小鼠结肠PGP9.5、c-kit、SCF 蛋白表达量比较 见表4、图1。

图1 5 组小鼠结肠PGP9.5、c-kit、SCF 蛋白条带图
表4 5 组小鼠结肠PGP9.5、c-kit、SCF 蛋白表达量比较(±s)

表4 5 组小鼠结肠PGP9.5、c-kit、SCF 蛋白表达量比较(±s)
注:与正常组比较,1) P<0.05;与模型组比较,2) P<0.05;与低剂量组比较,3) P<0.05;与中剂量组比较,4) P<0.05。
组别正常组模型组高剂量组中剂量组低剂量组SCF 1.00±0.15 0.16±0.041)0.57±0.052)4)0.42±0.032)3)0.54±0.202)n 10 10 10 10 10 PGP9.5 1.00±0.07 0.60±0.051)0.84±0.072)3)0.70±0.02 0.64±0.03 c-kit 1.00±0.05 0.34±0.131)0.99±0.042)3)4)0.70±0.112)0.60±0.012)
3.3 5 组小鼠结肠PGP9.5、c-kit、SCF mRNA 相对表达水平比较 见表5。
表5 5 组小鼠结肠PGP9.5、c-kit、SCF mRNA相对表达水平比较(±s)
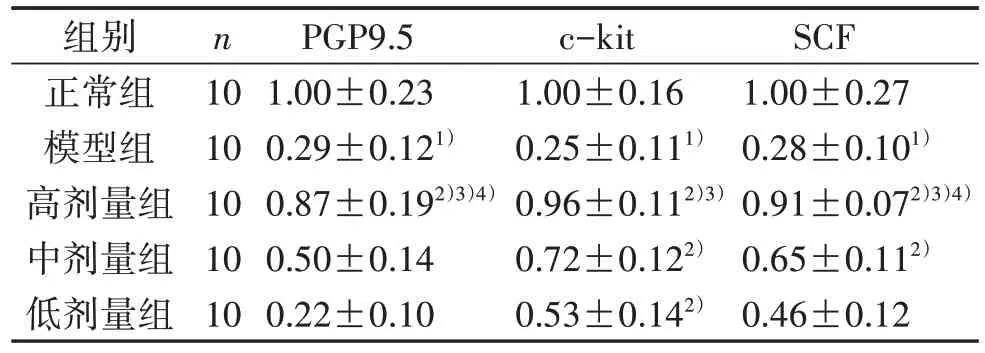
表5 5 组小鼠结肠PGP9.5、c-kit、SCF mRNA相对表达水平比较(±s)
注:与正常组比较,1) P<0.05;与模型组比较,2) P<0.05;与低剂量组比较,3) P<0.05;与中剂量组比较,4) P<0.05。
组别正常组模型组高剂量组中剂量组低剂量组SCF 1.00±0.27 0.28±0.101)0.91±0.072)3)4)0.65±0.112)0.46±0.12 n 10 10 10 10 10 PGP9.5 1.00±0.23 0.29±0.121)0.87±0.192)3)4)0.50±0.14 0.22±0.10 c-kit 1.00±0.16 0.25±0.111)0.96±0.112)3)0.72±0.122)0.53±0.142)
4 讨 论
STC 属于中医“便秘”的范畴,患者病程长,以老年人居多。年老虚损或长期使用泻药导致脾胃功能受损,脾虚失运,一则气机升降失常,肠腑推动不足,二则脾虚无法为胃行其津液,脾阴不足,气血津液失于合降而不能濡润大肠,最终导致肠腑传导失职,糟粕滞结,酿生便秘,因此,脾虚兼有气滞不运是STC 的病机关键。STC 以脾虚为本,气滞为标,属虚实夹杂之证,可兼有血虚、津亏等。肠润方是我院耿学斯教授治疗便秘的经验方,具有运脾行气、养阴润肠的功效,应用临床疗效显著。
STC 的发病机制复杂,其关键病理机制是肠道动力不足。肠道动力涉及肠肌的收缩运动、肠壁敏感性、肠道的生物力学功能和内容物的腔内流动等一系列复杂的生理问题[8]。肠道运动受中枢神经系统、肠神经系统(ENS)和自主神经系统共同支配,其中ENS 通过广泛分布、联系密切的神经丛对肠道运动、分泌进行独立调控,在三者中起关键作用。PGP9.5 是神经纤维中的特异性泛素羟基水解酶,对神经纤维特异性强。对PGP9.5 进行定位发现:STC 患者肌间及黏膜下层神经元数量减少50%,神经节之间的距离增大,并出现神经元肿胀和轴突变性,其病理改变与症状严重程度相关[9]。另一方面,结肠Cajal 间质细胞(ICC)被认为是胃肠运动的起搏器,ICC 接受神经信号后产生去极化电流,将产生的慢波以及兴奋性或抑制性神经递质传递至平滑肌细胞,引起平滑肌的舒张和收缩,调控肠道运动。STC 患者结肠组织中ICC 数量与体积较正常人明显降低[10-11],并伴见ICC 发育不全[12]。ICC 的发育、分化及表型维持由受体酪氨酸激酶c-kit 及SCF调控[13]。
本研究中模型组小鼠首粒黑便排出时间延长,粪便含水率和墨汁推进率均下降,表明造模成功。肠润方高、中、低剂量组干预均能明显缩短首粒黑便排出时间,提高粪便含水率及墨汁推进率,表明肠润方可改善STC 小鼠肠道传输功能。模型组小鼠结肠组织PGP9.5、c-kit、SCF 蛋白表达量和mRNA 相对表达水平明显降低,表明STC 小鼠存在肠神经受损、ICC数量与功能异常。肠润方干预后可提高小鼠结肠组织PGP9.5、c-kit、SCF 蛋白表达量和mRNA 相对表达水平,其中高剂量组干预效果更为显著,表明肠润方对肠道神经元及ICC 的表达具有促进作用。现代药理学研究表明:白术、枳实可兴奋性神经元,调节脑肠肽、ICC 表达等从而促进胃肠道排空和推进[14-15];槟榔有效成分槟榔碱可兴奋M 型受体,刺激肠道平滑肌收缩,促进肠道运动[16];火麻仁富含油脂和膳食纤维,有利于润滑肠道,增强肠道蠕动[17];麦冬中含有多种多糖和甾体皂苷,可保护黏膜屏障、促进血液循环[18];玄参中含有的环烯醚萜类、苯丙素类成分,具有抗氧化、抗细胞凋亡、促进血流动力学恢复的作用[19]。
综上所述,肠润方治疗可显著缩短STC 小鼠首粒黑便排出时间,提高粪便含水率和墨汁推进率,对肠道传输功能具有促进作用,其机制可能通过提高PGP9.5、c-kit、SCF 蛋白表达量和mRNA 相对表达水平,恢复肠神经损伤,提高ICC 的数量和功能,从而恢复肠道动力,有效治疗STC。
