雷公藤甲素柔性纳米脂质体的体外抗炎活性及透皮性能研究
2023-11-14刘美秀付林可袁晓峰韩江帆叶威良
刘美秀,付林可,周 丹,袁晓峰,韩江帆,叶威良*
1.空军军医大学药学系药剂学与药事管理学教研室,西安 710032;2.空军军医大学第一附属医院消化内科,西安 710032;3.西安市第九医院药剂科,西安 710054
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的自身免疫性疾病,易引起关节畸形及运动功能丧失,给患者带来巨大痛苦,从而降低患者的生活质量[1-2]。我国RA患者多达480万,且患病率呈逐年上升的趋势[3]。虽然临床上对RA的治疗手段在不断地更新,但是RA的临床致残率依然较高。因此,探寻新的RA治疗手段是临床的迫切需求。
雷公藤甲素(triptolide,TP)又称雷公藤内酯醇,属于二萜内酯类。中药雷公藤治疗RA具有确切的疗效,而TP是中药雷公藤抗RA最主要的活性成分[4]。RA患者单核巨噬细胞异常活化,分泌大量炎症因子,直接导致炎症损伤。白细胞介素-1(interleukin-1,IL-1)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)在RA发病中的主要作用是促进滑膜纤维母细胞和软骨细胞产生前列腺素E2(prostaglandin E2,PGE2)和胶原酶,进而导致关节软骨和骨质的破坏。白细胞介素-6(interleukin-6,IL-6)能增强IL-1和TNF-α的局部效应,增加B细胞产生类风湿因子的量。研究表明,TP能显著抑制体外培养的巨噬细胞中炎症因子TNF-α、IL-6、环氧合酶2(cyclooxygenase-2,COX-2)的表达[5]。此外,有研究发现TP能降低关节炎大鼠外周血中TNF-α的水平,推测TP可能通过促进破骨细胞凋亡,降低RA患者的骨损失,从而缓解RA的症状[6-7]。但TP在体内的非特异性分布,使其在正常组织中有大量分布,而在炎症关节部位药物浓度有限,造成药物的高毒低效现象。因此,构建合适的药物载体将TP选择性地递送到RA炎症部位,对提高TP治疗RA的效果具有重要意义。
透皮给药是一种十分有发展前景的给药方式,它能够克服传统口服和静脉给药方式的缺陷,但皮肤的天然屏障作用极大地降低了药物的透皮性能。目前,化学促透剂(如醇类、氮酮类等)和物理方法(如微针法和超声等)常用于提高皮肤的药物渗透性能,但这些透皮方法极易造成皮肤的不可逆损伤,且药物的皮肤渗透率依旧不高[8]。柔性纳米脂质体(flexible nanoliposomes,FNLs)是一种多功能的药物载体,与传统脂质体相比,具有高度可变形性,可有效促进药物进入皮肤,并将大量的药物储留在皮肤组织内,形成药物储库,使药物在局部发挥持久的治疗作用[9]。FNLs以水合梯度为驱动力,借助自身的高度变形能力,穿过比自身粒径小得多的皮肤孔道,可高效地将药物递送至皮肤组织[10-12]。本文拟利用薄膜分散法制备TP-FNLs,并对其进行表征。用荧光显微镜观察RAW 264.7细胞对TP-FNLs的摄取情况。用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)测定TP-FNLs对RAW 264.7细胞炎症因子分泌的影响。用离体大鼠皮肤考察TP-FNLs的体外透皮性能。本研究旨在开发一种新的TP新型透皮制剂,从而为RA的治疗奠定基础。
1 仪器与材料
1.1 仪器
LC-20A型高效液相色谱仪(日本岛津公司);5804R型冷冻离心机(德国Eppendorf公司);DHG-914A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);JEM-1200EX型透射电子显微镜(日本电子株式会社);AR2140型电子天平(瑞士梅特勒-托利多仪器有限公司);旋转蒸发仪、超声波清洗仪均购自河南省巩义市予华仪器有限责任公司;Delso Nano C型纳米粒度/Zeta电位分析仪(美国Beckman Coulter公司);RYJ-6B型药物透皮扩散实验仪(上海黄海药检仪器有限公司)。
1.2 试药
(2,3-二油酰基-丙基)-三甲基氯化铵(N-[1-(2,3-dioleoyloxy) propyl]-N,N,N-trimethylammonium methyl-sulfate,DOTAP,美国Avanti Polar Lipids公司);胆固醇(北京金客隆生物技术有限公司);甲氨蝶呤、去氧胆酸钠、吐温80、胆酸钠均购自百灵威科技有限公司;甲醇、氯仿均为色谱级,均购自广东省汕头市西陇化工股份有限公司;去离子水为自制。
1.3 细胞与动物
小鼠单核白血病巨噬细胞RAW 264.7,购自武汉普诺赛生命科技有限公司;雄性SD大鼠,体质量约为200 g,购自空军军医大学实验动物中心。
2 方法
2.1 TP-FNLs的制备及评价
2.1.1TP-FNLs的制备 取一定量的DOTAP、CHOL、TP置于茄形瓶内,用6 mL甲醇-三氯甲烷(3∶1)超声溶解,于40 ℃条件下旋蒸1 h,去除有机溶剂,待瓶壁上形成均匀薄膜后,真空干燥1 h,置于-20 ℃冰箱中过夜。加入5 mL磷酸盐缓冲液(phosphate buffered saline,PBS)与一定量的膜软化剂,水化2 h,随后反复4次,过0.22 μm滤膜,即得。
2.1.2包封率的计算 取1 mL TP-FNLs,置于10 mL量瓶中,加入甲醇破乳、定容,超声15 min后,测定TP的总质量浓度(Mt)。另取1 mL TP-FNLs置于透析袋中,透析12 h后,取透析液置于10 mL量瓶中,用甲醇定容,超声15 min破乳,测定TP的质量浓度(My)。计算TP-FNLs的包封率(Me)。Me=(My/Mt)×100%。
2.2 TP-FNLs的表征
2.2.1粒径分布及Zeta电位 取TP-FNLs适量,加水稀释,用Delso Nano C型纳米粒度/Zeta电位分析仪测定其粒径、Zeta电位和PDI,平行测定3次。
2.2.2透射电镜观察 取TP-FNLs,加水稀释后,用20 mg·mL-1磷钨酸溶液负染,滴于铜网上,自然晾干,置于透射电镜下观察。
2.2.3变形性考察 取TP-FNLs,加水稀释后,在一定压力和时间下挤压通过50 nm微孔滤膜,测定滤液体积以评估FNLs的变形性。
2.3 TP-FNLs稳定性的考察
分别用去离子水、pH 7.4的PBS以及含有100 mg·mL-1胎牛血清的PBS溶解一定量的TP-FNLs,随后将各纳米粒溶液分别置于37 ℃保存。于1、12、24、48 h测定TP-FNLs溶液的粒径和Zeta电位。
2.4 TP-FNLs释药性的考察
分别配制pH 7.4和pH 6.0的PBS缓冲液。称取5 mg TP-FNLs溶于1 mL释放介质中,随后加入透析袋(截留相对分子质量5 000)中,并将透析袋放入装有20 mL相同释放介质的离心管中,置于37 ℃水浴中孵育。在不同时间点,取出1 mL释放介质,同时补加新的、相同的释放介质。将取出的溶液经0.22 μm微孔滤膜过滤后,用HPLC法测定TP的释放量,计算TP的累积释放量。
2.5 TP-FNLs的细胞摄取研究
为了观察TP-FNLs在巨噬细胞内的摄取情况,用Rho B标记TP-FNLs。取12孔细胞培养板,铺上圆形盖玻片,将RAW 264.7细胞接种于12孔板中,接种密度为3×104个·孔-1。在细胞培养箱中放置24 h后,加入TP-FNLs,继续培养30 min或2 h,用pH 7.4的PBS洗涤3次,用体积分数4%多聚甲醛固定15 min,加入100 ng·mL-1的4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)溶液染色5 min,用pH 7.4的PBS洗涤3次,用甘油封片后,置于荧光显微镜下观察FNLs的分布情况。
2.6 细胞炎症因子的检测
将RAW 264.7细胞接种于6孔板中,细胞密度为2×106个·孔-1,置于细胞培养箱中培养24 h后,弃去培养基,加入2 mL含有脂多糖(lipopolysaccharide,LPS)的新鲜培养基培养24 h。随后弃去培养基,加入2 mL含有游离TP或TP-FNLs的新鲜培养基。24 h后取培养基上清,用ELISA测定IL-1β、IL-6和TNF-α等细胞炎症因子的水平。
2.7 体外透皮实验
2.7.1体外皮肤累积渗透量 取适宜的大鼠离体皮肤(有效皮肤面积为0.636 cm2),固定于Franz池中,放入接收液[生理盐水-乙醇(4∶1)混合液],接收池保持(32±1) ℃恒温水浴,搅拌速度为400 r·min-1,平衡15 min后,更换新的接收液。随后取500 μg·mL-1的TP-FNLs溶液1 mL分2次均匀涂布于大鼠皮肤表面,并于1、4、8、12、24、36 h取200 μL接收池液体,及时补加等体积的新鲜接收液。以TP水溶液作为参比制剂。
2.7.2体外皮肤滞留量 取2.7.1项下经过36 h体外透皮实验后的离体皮肤,用生理盐水冲洗皮肤的内、外表面,吸干皮肤表面的水分,剪碎后制备皮肤匀浆;加入3 mL提取溶剂(丙酮∶甲醇=3∶1),涡旋2 min,以1 500 r·min-1离心10 min,将上清液转移至具塞塑料离心管中。此提取过程重复2次,合并2次提取液,用氮气吹干。用甲醇复溶,涡旋2 min,离心后吸取上清,用HPLC法测定皮肤中药物的滞留量[12]。
3 结果
3.1 TP-FNLs的表征结果
3.1.1包封率、粒径及Zeta电位 TP-FNLs的粒径为(178±13) nm,PDI为(0.237±0.021),Zeta电位为(12.39±1.8) mV,包封率为(56.3%±4.1%)。TP-FNLs的粒径分布较窄,见图1。
3.1.2透射电镜观察 TP-FNLs的透射电镜图见图2。由图2可见,TP-FNLs呈梭形,大小均一,且无聚集现象。
3.1.3变形性考察 TP-FNLs混悬液在一定压力下经一定时间可顺利地通过50 nm微孔滤膜,而作为对照的等粒径正常脂质体在相同压力和时间下则很少通过50 nm微孔滤膜,表明TP-FNLs具有较好的变形性。结果见图3。
3.2 TP-FNLs稳定性的研究结果
将TP-FNLs置于不同的介质中孵育,测定粒径及Zeta电位,考察其体外稳定性。结果见图4。在48 h内,TP-FNLs的粒径在水中、PBS中及含有100 mg·mL-1FBS的PBS中均未发生明显变化,表明在48 h内,TP-FNLs能稳定存在于3种不同的介质中,见图4A。在48 h内,TP-FNLs在水中、PBS中及含有100 mg·mL-1FBS的PBS中的Zeta电位均未发生明显改变,表明在48 h内,3种介质对TP-FNLs的Zeta电位没有影响,见图4B。
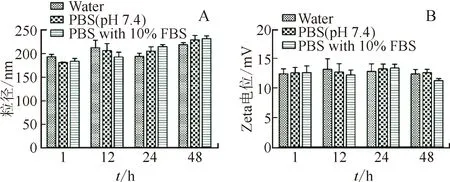
注:A.粒径的变化;B.Zeta电位的变化。
3.3 TP-FNLs释药性的研究结果
TP-FNLs在不同pH值介质中TP的累积释放率见图5。由图5可见,在释药1 h后,TP-FNLs在2种介质中都有轻微的突释现象,药物突释率分别为15.6%、21.6%,导致突释的主要原因是部分药物存在于纳米粒表面,由于TP在酸性环境中具有更好的溶解性,故TP-FNLs在pH 6.0的环境中,突释率比在pH 7.4中性介质中更高。在释放12 h后,TP-FNLs在2种介质中持续释放,在48 h后,TP-FNLs中TP的释放基本达到平台期,几乎不再释放。最终,TP-FNLs中TP的释放量在pH 6.0和pH 7.4介质中分别为91.4%、72.6%。在整个释放过程中,TP-FNLs中的TP在酸性介质中的释放率均高于在pH 7.4中性介质中的释放率。这是由于脂质材料DOTAP在酸性环境中具有更好的溶解性,使FNLs具有酸敏释药特性。
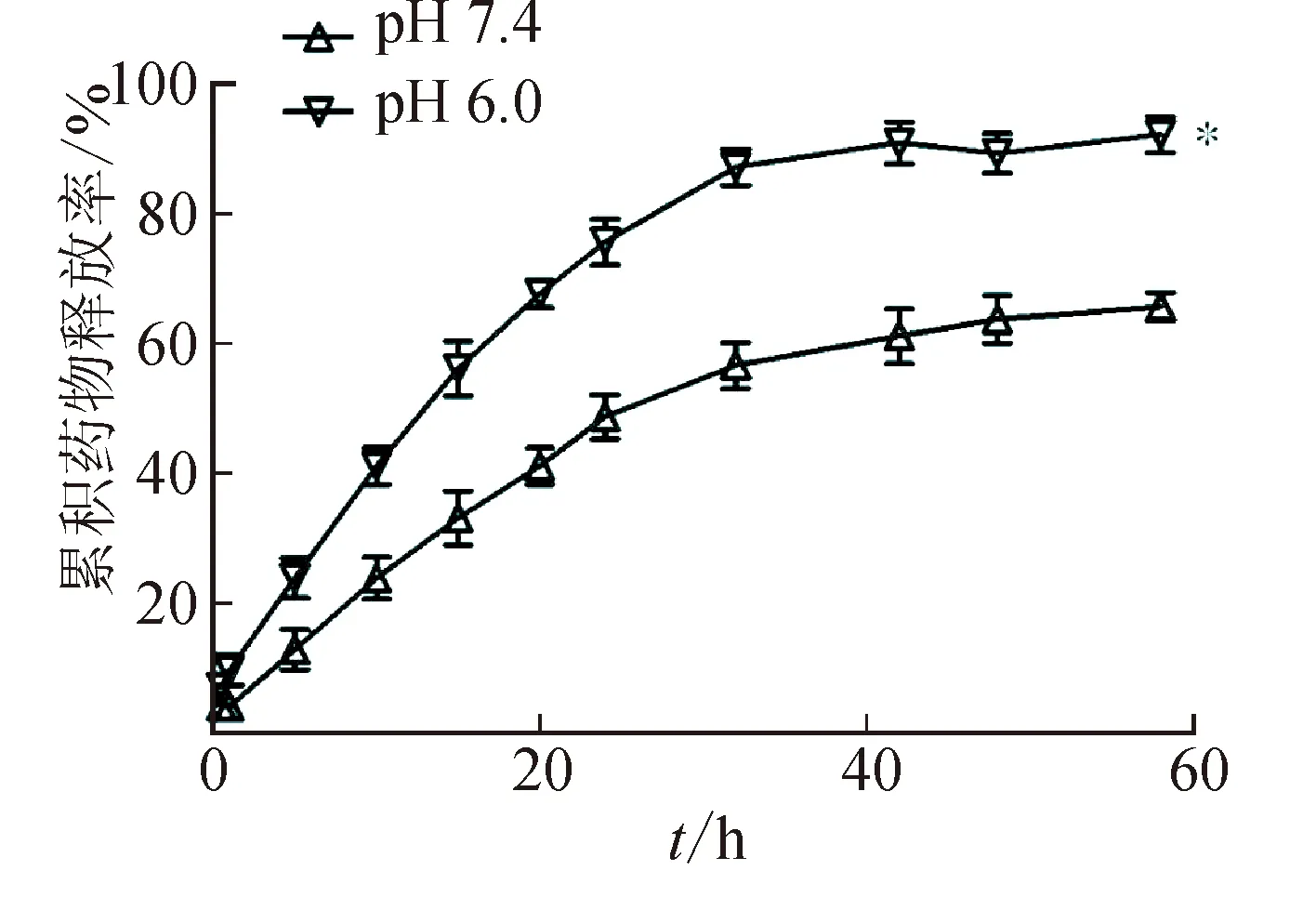
注:与pH7.4相比,*P<0.01。
3.4 TP-FNLs细胞摄取的研究结果
用荧光显微镜观察TP-FNLs的细胞摄取行为,见图6。由图6可见,随着药物与细胞共孵育时间的延长,细胞内的红色荧光强度逐渐增强,表明RAW 264.7细胞对TP-FNLs能够时间依赖性地有效内吞。
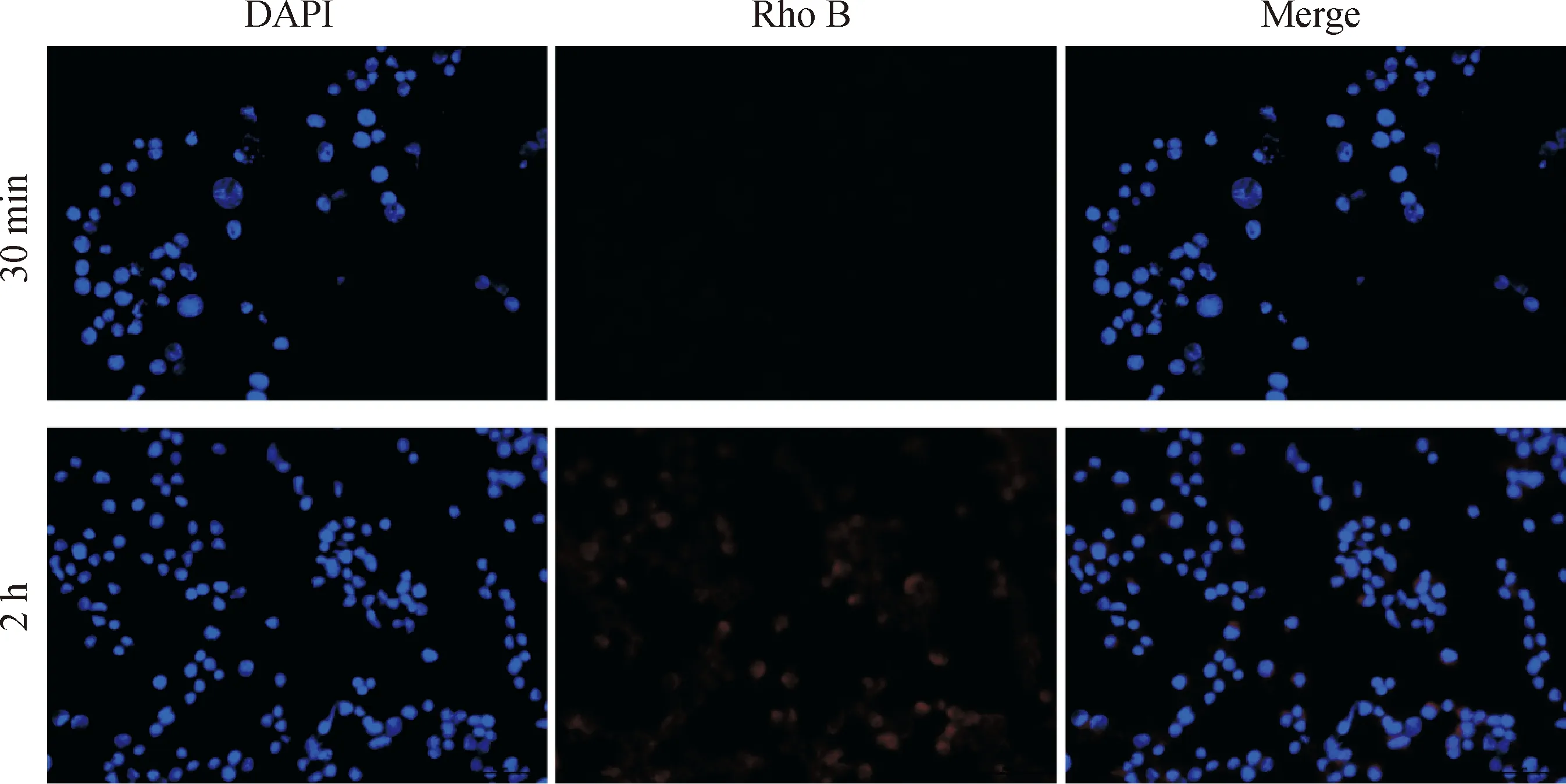
图6 荧光显微镜观察RAW 264.7细胞对Rho B标记的TP-FNLs的摄取情况
3.5 TP-FNLs抗炎活性的研究结果
用ELISA检测游离TP和TP-FNLs抑制活化巨噬细胞炎症因子的表达,见图7。由图7可见,当用LPS刺激RAW 264.7细胞后,TNF-α、IL-6、IL-1β的表达水平均上调,当给予游离TP和TP-FNLs后,TNF-α、IL-6、IL-1β的表达水平均明显降低,且TP-FNLs的抑制效果显著优于TP。
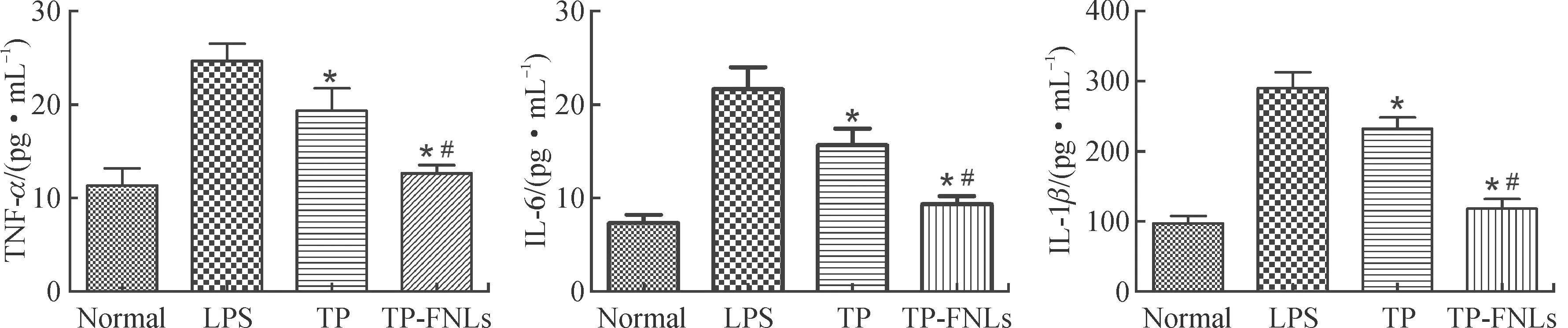
注:与LPS相比,*P<0.01;与TP相比,#P<0.01。
3.6 体外透皮实验结果
3.6.1体外皮肤累积渗透量结果 36 h后,TP-FNLs中TP的皮肤累积渗透量为(397.08±29.61) μg·cm-2,而游离TP的皮肤累积渗透量为(88.34±9.66) μg·cm-2。TP-FNLs中TP的36 h皮肤累积渗透量约为游离TP的4.5倍,表明与游离TP相比,TP-FNLs可有效提高TP的皮肤渗透量。结果见图8。
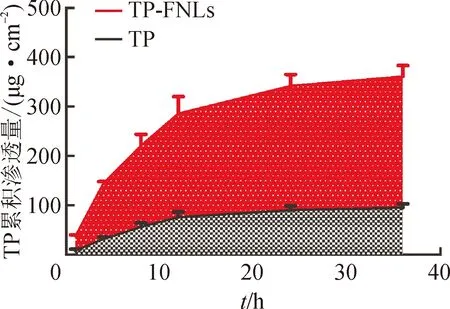
图8 TP-FNLs和TP在体外皮肤的累积渗透曲线 (n=4)
3.6.2体外皮肤滞留量结果 36 h后,TP-FNLs中TP的皮肤滞留量为(46.56±0.39) μg·cm-2,而游离TP的皮肤滞留量为(10.93±0.61) μg·cm-2,TP-FNLs中TP的皮肤滞留量约为游离TP的4倍。
4 讨论
TP在水中的溶解度低,在肠胃中不易被吸收且易被代谢,生物利用度很低,因此考虑将其制成经皮给药制剂,但由于其不易透过角质层,故直接经皮给药也不易被吸收[13]。FNLs制剂具有较好的生物相容性,更容易透过皮肤角质层[14-16]。基于此,本研究拟将TP包裹在FNLs载体中。研究结果显示,制备的TP-FNLs的粒径为(178±13) nm、PDI为(0.237±0.021)、Zeta电位为(12.39±1.8) mV、包封率为(56.3%±4.1%);透射电镜结果显示TP-FNLs呈梭形,且具有良好的变形性。
体外释药结果显示,TP-FNLs的释药行为具有pH依赖性。TP-FNLs在pH 6.0的酸性介质中TP的释放速度显著快于在pH 7.4中性介质中,且释放量多。TP-FNLs酸敏特性的释药特点可有效增加其在体循环中的稳定性,而在炎症微酸环境下,可以选择性地发生药物释放,从而保证了递送系统的高效、低毒。TP-FNLs具有酸敏释药特性,主要是因为TP是一种弱碱性药物,它在酸性条件下的溶解度更大,所以在pH 6.0释放介质中扩散得更快,药物释放速度也更快。部分TP可能是通过静电吸附于脂质体表面,在酸性条件下,TP从其表面迅速解吸附[17]。细胞摄取实验结果表明,TP-FNLs可时间依赖性地被RAW 264.7细胞摄取,进而发挥抗炎活性。ELISA结果显示,与游离TP相比,TP-FNLs可显著降低相关炎症因子的分泌,表明TP-FNLs具有强大的抗炎作用,进而可有效治疗RA[18-19]。
体外皮肤渗透性实验结果表明,与游离TP相比,TP-FNLs的皮肤渗透性更好,TP-FNLs中TP的36 h皮肤累积渗透量约为游离TP的4.5倍。而皮肤滞留实验结果显示,36 h后,TP-FNLs中TP的皮肤滞留量约为游离TP的4倍。表明TP-FNLs中的药物能够很好地穿透角质层,而且TP-FNLs中的药物可以大量滞留于皮肤中,使药物具有长效、缓释的特性。而游离TP则不能有效进入皮肤,药物皮肤渗透量和滞留量均大大降低。表明FNLs具有明显的经皮渗透优势,适合作为药物的经皮渗透载体。
综上所述,本研究以FNLs为载体,促进TP的透皮吸收,实现了TP皮肤局部给药,并具有缓释特性,增加了使用的安全性。
