ZIF 衍生Fe3 O4@NC/石墨烯锂离子电池负极材料研究
2023-11-14张亚婷索轲刘国阳朱由余张娜娜
张亚婷 ,索轲 ,刘国阳 ,朱由余 ,张娜娜
(1.西安科技大学 化学与化工学院,陕西 西安 710054;2.自然资源部煤炭资源勘查与综合利用重点实验室,陕西 西安 710021)
锂离子电池具有可重复充放电、容量大、使用寿命长等特性,被广泛应用于便携式电子产品以及电动汽车。此外,作为储能元件,它还能对接太阳能、风能等清洁可再生能源,为未来取代化石燃料发电提供可能[1-4]。众所周知,决定锂离子电池性能优劣的是电极材料,其中普遍采用的负极材料是石墨,然而石墨的理论比容量只有372 mAh·g-1,这限制了电池的性能及应用范围,因此人们一直致力于寻找更高容量的替代材料。
过渡金属氧化物自Tarascon 首次用于负极材料以来,就得到广泛关注[5]。其中Fe3O4由于理论比容量高(926 mAh·g-1)、地球储量丰度、无毒性和低成本等优势,被认为是一种有前途的负极材料[6]。但Fe3O4较差的电导率以及充放电过程中的体积膨胀影响了其作为负极材料时的电化学性能。为了解决以上问题,研究人员提出了许多方法,其中使用碳材料与Fe3O4形成复合结构是一种常用手段。例如,He 等[7]以Fe基金属有机框架(MIL-53)为前驱体,制备了纳米球形Fe3O4@C 复合材料。复合电极表现出了优异的储锂性能,在0.2 mA·g-1的电流密度下经过200 圈循环后仍然有1297.5 mAh·g-1的高比容量。Jia 等[8]通过使用多巴胺作为碳源,制备了碳包覆结构的Fe3O4@PNC 复合材料。通过电化学测试得出,Fe3O4@ PNC电极在0.2 A·g-1的电流密度下,100 圈循环后可保持988.2 mAh·g-1高可逆比容量,在2 A·g-1电流密度下,100 圈循环后,保持了483 mAh·g-1的比容量。徐飞等[9]通过碳纳米管共沉淀的方法制备了Fe3O4-CNTs 复合材料,在10 A·g-1的大电流密度下循环,第100 圈时放电比容量稳定在230 mAh·g-1。循环至第9999 圈时,比容量下降至179 mAh·g-1,只损失了50 mAh·g-1。复合材料在大电流密度超长循环的背景下表现出优异的性能。Li 等[10]通过水热法合成了Fe3O4纳米颗粒与石墨烯的复合材料Fe3O4@ rGO。在0.4 A·g-1的电流密度下,经100 圈循环后,保持了1139 mAh·g-1的比容量;在1 A·g-1的电流密度下循环200 圈后,显示出稳定的比容量665 mAh·g-1。Fe3O4与碳材料复合不仅能提高导电性,还能有效缓解充放电过程中的体积膨胀,从而延长电池循环寿命。但是设计合理的复合材料组成,构筑适当的微观结构,有效地控制复合材料在充放电过程中的性能衰减依然面临诸多挑战。
为此,本文设计了一种具有双碳包覆结构的新型Fe3O4基复合材料(Fe3O4@NC/G),如图1。采用Fe-ZIF 作为前驱体,使用多巴胺在其表面聚合,经阳离子修饰后与带负电的氧化石墨烯通过静电吸附作用组合,再煅烧碳化得到Fe3O4@NC/G 复合材料。对其进行结构和形貌的表征分析,并对组装后的电池进行了电化学性能测试。结果显示,所构筑的Fe3O4@NC/G复合材料具有优异的循环稳定性和倍率性能。
1 实验
1.1 电池材料制备
(1)Fe-ZIF 的制备
称取2.808 g 硫酸亚铁置于烧杯,加入250 mL 甲醇并超声5 min 使之溶解。接着称取0.5 g 聚乙烯吡咯烷酮加入上述溶液中搅拌10 min。另称取3.351 g 2-甲基咪唑置于烧杯,加入250 mL 甲醇并超声5 min 使之溶解。将硫酸亚铁溶液快速倒入2-甲基咪唑溶液,搅拌10 min,之后在室温下静置24 h。将得到的溶液分别用甲醇和去离子水洗涤数次,之后离心收集固体并置于真空干燥箱中,在70 ℃干燥8 h 得到样品Fe-ZIF[11]。
(2)Fe-ZIF/PDA 的制备
称取200 mg Fe-ZIF 置于烧杯中,加入20 mL 甲醇。另称取30 mg 盐酸多巴胺置于烧杯中,加入10 mL 甲醇。将Fe-ZIF 溶液快速倒入多巴胺溶液中,在室温下搅拌12 h。将得到的溶液分别用甲醇和去离子水洗涤数次,之后离心收集固体并置于真空干燥箱中,在70 ℃干燥8 h 得到样品Fe-ZIF/PDA。
(3)氧化石墨烯的制备
氧化石墨烯的制备采用改良的Hummers 法[12]。在冰水浴下,将34 mL 浓硫酸加入烧杯,缓慢加入1.0 g鳞片石墨(325 目)和0.75 g NaNO3并搅拌30 min。之后缓慢加入5.0 g KMnO4,并保持反应温度低于20℃,搅拌30 min。接着将反应升温至35 ℃并恒温搅拌2 h。缓慢加入50 mL 去离子水并保持温度不超过40℃。然后用水浴加热将反应温度提升并保持在98 ℃搅拌30 min。之后逐滴加入4 mL H2O2溶液(体积分数30%),继续搅拌30 min,并保持温度为98 ℃。将溶液冷却至室温,用去离子水离心洗涤至pH=7 得到氧化石墨烯溶液。制得的氧化石墨烯溶液经过超声分散处理5 h 后,冷冻干燥。最后用去离子水将氧化石墨烯标定为5 mg·mL-1。
(4)Fe-ZIF@PDA/GO 的制备
使用十六烷基三甲基溴化铵(CTAB)对Fe-ZIF/PDA 进行表面修饰,使材料带正电,与带负电的氧化石墨烯通过静电吸附作用组装成复合材料,具体方法如下: 称取100 mg Fe-ZIF@ PDA 分散于250 mL CTAB 水溶液(体积分数2%)中,超声1 h,之后用去离子水洗去过量CTAB。离心收集Fe-ZIF/PDA 固体并分散于250 mL 去离子水中,逐滴加入5 mL 氧化石墨烯水溶液(5 mg·mL-1),搅拌1 h。最后用去离子水离心洗涤数次并通过冷冻干燥得到样品Fe-ZIF@PDA/GO。
(5)Fe3O4@NC/G 的制备
称取适量Fe-ZIF@PDA/GO 置于瓷舟并放入管式炉,在氩气气氛下以5 ℃/min 的升温速率加热至600℃并保持4 h,得到Fe3O4@ NC/G。作为对照样,将Fe-ZIF、Fe-ZIF/PDA 和GO 采用同样的温度煅烧制备得到Fe3O4、Fe3O4@NC 和rGO。
(6)电极材料的制备与电池组装
将所制备的Fe3O4@NC/G 与聚偏氟乙烯、导电碳黑,按照8 ∶1 ∶1 的质量比放入研钵中混合。用滴管取适量的N-甲基吡咯烷酮滴入研钵中,充分研磨得到浆料。之后将浆料用涂膜工具按150 μm 的厚度均匀涂覆在铜箔上,并将涂覆好的铜箔放入真空干燥箱,在70 ℃下干燥5 h。干燥完成之后,使用冲片机将铜箔裁剪为直径16 mm 的圆形电极片。在充满高纯氩气的手套箱中组装扣式电池。
1.2 材料表征与电化学测试
材料表征: 扫描电子显微镜(SEM,Sigma 300 德国ZEISS);X-射线衍射仪(XRD,MiniFlex 600 日本理学);拉曼光谱仪(Raman,InVia Reflex 英国Renishaw);X 射线光电子能谱仪(XPS,Thermo Scientific K-Alpha 美国ThermoFisher)。
电化学测试: 使用中国武汉蓝电的CT2001A 型工作站对电池进行恒流充放电测试;通过江苏东华分析仪器有限公司的DH7000 电化学工作站对电池进行循环伏安(CV,测试电压0.01~3.00 V)和电化学阻抗(EIS,电压为开路电压,频率范围0.01~100 kHz,振幅5 mV)测试。
2 结果与讨论
2.1 形貌与结构分析
图2 为Fe-ZIF,Fe-ZIF@ PDA,Fe-ZIF@ PDA/GO 和Fe3O4@NC/G 的SEM 图。由图2(a)可知,Fe-ZIF 具有球型结构,颗粒粒径在100~150 nm 之间。由图2(b)可知,多巴胺通过聚合反应在Fe-ZIF 表面与周围生成了聚多巴胺。由图2(c)可知,Fe-ZIF@PDA被包覆在石墨烯之中,并且石墨烯有效地连接了Fe-ZIF@PDA 颗粒。图2(d)为碳化后生成的Fe3O4@NC/G 复合材料,其表面变得粗糙,但整体结构没有变化。

图2 样品SEM 图。(a) Fe-ZIF;(b) Fe-ZIF@PDA;(c)Fe-ZIF@PDA/GO;(d) Fe3O4@NC/GFig.2 SEM images of (a) Fe-ZIF,(b) Fe-ZIF@PDA,(c)Fe-ZIF@PDA/GO,(d) Fe3O4@NC/G
图3 为Fe3O4,Fe3O4@ NC 和Fe3O4@ NC/G 的XRD 图。由图可知,三组样品均在2θ=30.3°,35.7°,43.4°,53.8°,57.4°和63.0°处产生了明显的特征峰,分别对应了Fe3O4的(220)、(311)、(400)、(422)、(511)和(440)晶面。这与尖晶石型Fe3O4的标准谱图(JCPDS 19-0629)相一致。三组样品相同的特征峰说明Fe3O4成功与多巴胺和石墨烯复合。Fe3O4@ NC/G样品在26°附近出现了一个较小的特征峰,这归因于复合材料的表面碳层。
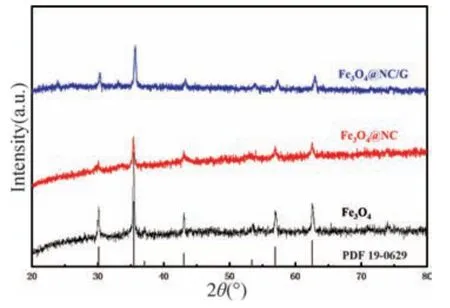
图3 Fe3O4,Fe3O4@NC 和Fe3O4@NC/G 的XRD 谱图Fig.3 XRD patterns of Fe3O4,Fe3O4@NC and Fe3O4@NC/G
图4 为rGO 和Fe3O4@ NC/G 的Raman 谱图。由图可知,rGO 和Fe3O4@NC/G 均在1354 cm-1和1597 cm-1处产生了两个特征峰,分别对应于石墨中sp3碳原子的无序结构缺陷(D 峰)和sp2碳原子的有序振动(G峰)。D 峰与G 峰的峰强度比值(ID/IG)越小说明材料的石墨化程度越高。Fe3O4@ NC/G 复合材料的ID/IG值(1.58)为rGO(0.86)的1.84 倍,这说明Fe3O4@NC的存在阻碍了氧化石墨烯的热还原过程,增加了表面缺陷,这将为Li+的存储提供更多的反应活性位点[13]。
图5 为Fe3O4@NC/G 的XPS 谱图。由图5(a)可知Fe3O4@ NC/G 复合材料中存在C、N、O 和Fe 元素。图5(b)为Fe3O4@NC/G 复合材料的高分辨率N 1s 谱图,经过拟合在398.7,399.9,401.1 eV 处得到3 个峰,分别对应吡啶-N、吡咯-N 和石墨-N,这是由于含氮的二甲基咪唑、聚乙烯吡咯烷酮以及多巴胺在高温碳化过程中产生的氮原子掺杂到了碳材料晶格中。氮掺杂碳为Li+储存提供更多的电化学活性位点,增强了活性物质与锂的快速反应能力[14-15]。图5(c)为Fe3O4@ NC/G 复合材料的高分辨率C 1s 谱图,在284.8,285.7,287.7,291.4 eV 处的4 个拟合峰,对应碳的C—C/C ═C,C—O/C ═N,C ═O/C—N 和O—C ═O 键,表明存在与氮原子连接的碳原子[16]。图5(d)为Fe3O4@NC/G 复合材料的高分辨率Fe 2p 谱图,位于711.8 eV 和725.1 eV 处的两个峰对应Fe 2p3/2和Fe 2p1/2轨道。经过拟合得到711.1 eV 和724.7 eV 处的两个峰对应Fe2+的Fe 2p3/2和Fe 2p1/2轨道,而714.1 eV 和727.5 eV 处的两个峰对应Fe3+的Fe 2p3/2和Fe 2p1/2轨道。另外在718.7 eV 处的峰为Fe 的伴峰[17]。这些XPS 结果清楚地表明了复合材料中Fe3O4和氮掺杂碳的存在。

图5 Fe3O4@NC/G 的XPS 谱图。(a) 总谱;(b) N 1s;(c) C 1s;(d) Fe 2pFig.5 XPS spectra of Fe3O4@NC/G.(a) Survey;(b) N 1s;(c) C 1s;(d) Fe 2p
2.2 电化学性能分析
图6(a)为Fe3O4@NC/G 电极在0.1 mV·s-1扫描速率下前3 圈的循环伏安(CV)曲线。第一圈循环中0.75 V 处产生了一个强还原峰,归因于Li+嵌入Fe3O4晶格生成Li2Fe3O4,Li2Fe3O4被还原为单质Fe,以及固态电解质(SEI)膜生成。相关化学反应式如下[18]:
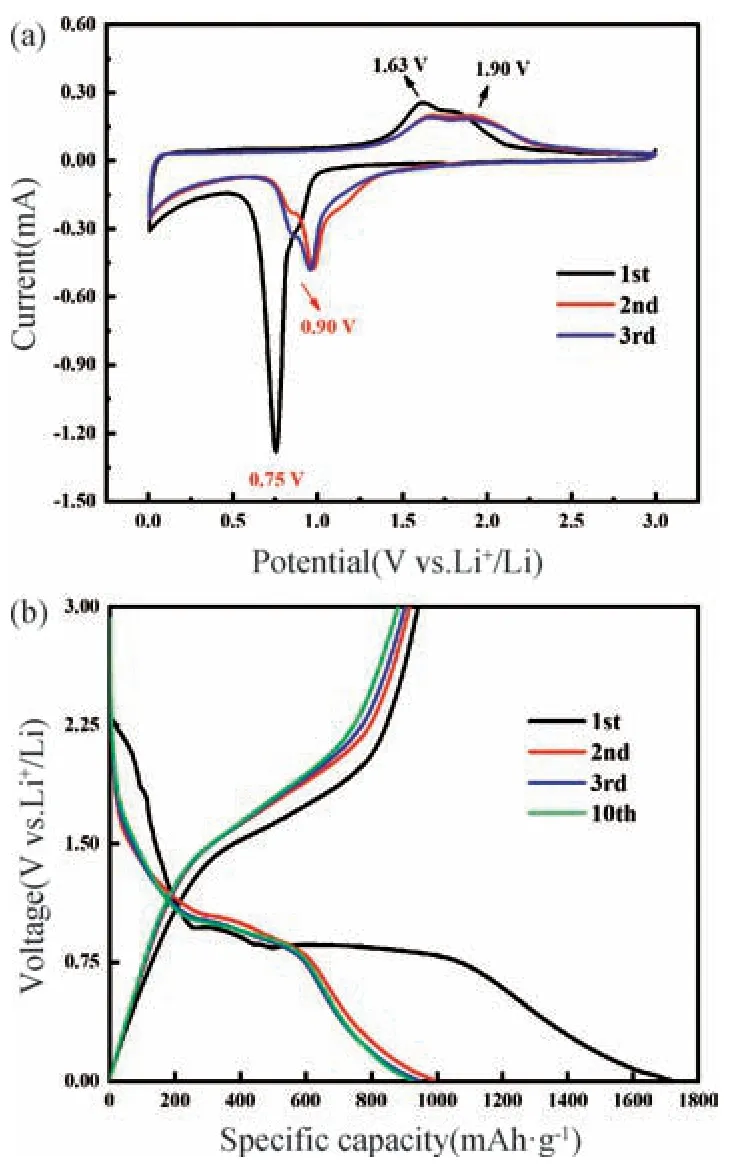
图6 (a) Fe3O4@NC/G 在0.1 mV·s-1 扫描速率下的循环伏安曲线;(b) Fe3O4@NC/G 电极在0.1 A·g-1电流密度下的充放电曲线Fig.6 (a) CV curves of Fe3 O4@NC/G at a scan rate of 0.1 mV·s-1;(b) Charge and discharge curves of Fe3O4@NC/G at a current density of 0.1 A·g-1
在1.63 V 和1.90 V 处产生了两个氧化峰,这归因于金属Fe 被氧化为Fe2+和Fe3+。随后的循环中0.75 V 处的还原峰移动到了0.9 V 处,峰强度降低,同时两个氧化峰电位也有所提高。这归因于第一次充放电过程中Li+嵌入Fe3O4后造成的晶体结构变化以及固态电解质膜的生成。值得注意的是,在第2 和第3 圈循环中,氧化/还原峰的电势和积分面积几乎重叠,这体现了电极材料优异的循环稳定性。
图6(b)为Fe3O4@NC/G 电极的恒电流充放电曲线图。由图可知,在0.1 A·g-1的电流密度下,电极材料的首次充放电比容量分别为1108.5 mAh·g-1和1604.7 mAh·g-1,库伦效率为69.08%。首次放电平台在0.75 V 附近,随后的循环中提升到0.9 V,这与之前的CV 曲线结果相一致。较低的首次库伦效率是因为在第一次放电过程中固态电解质膜的生成,这造成了部分电解质的分解,消耗了一定量的Li+,这个问题存在于大多数负极材料中。
图7(a)为0.1 A·g-1电流密度下Fe3O4,Fe3O4@NC 和Fe3O4@ NC/G 电极的循环曲线图。由图可知,Fe3O4电极材料在首次充放电中的放电比容量为1155.7 mAh·g-1,循环至30 圈后其放电比容量已经下降至140.5 mAh·g-1。Fe3O4@NC 电极材料首次放电比容量为1265.7 mAh·g-1,循环至30 圈后放电比容量下降至369.8 mAh·g-1。这表明聚多巴胺的引入在一定程度上减缓了电极材料的容量衰减。Fe3O4@NC/G 电极材料首次放电比容量为1604.7 mAh·g-1,在30 圈循环后放电比容量为1005.6 mAh·g-1,是Fe3O4电极的7.2 倍,Fe3O4@NC 电极的2.7 倍,这表明石墨烯的引入极大提升了材料的循环稳定性。为了进一步验证Fe3O4@ NC/G 复合材料的循环稳定性,在2 A·g-1的电流密度下对其进行测试,结果如图7(c)所示,在300 圈的循环后,材料仍保持838.3 mAh·g-1的放电比容量。

图7 (a) Fe3O4、Fe3O4@NC 和Fe3O4@NC/G 在电流密度为0.1 A·g-1时的循环性能曲线;(b) Fe3O4、Fe3O4@NC 和Fe3O4@NC/G 的倍率性能曲线;(c) Fe3O4@NC/G 在电流密度为2 A·g-1时的循环性能曲线Fig.7 (a) Cycling performance of Fe3O4,Fe3O4@NC and Fe3O4@NC/G at a current density of 0.1 A·g-1;(b) Rate performances of Fe3O4,Fe3O4@NC and Fe3O4@NC/G;(c) Cycling performance of Fe3O4@NC/G at a current density of 2 A·g-1
图7(b)为Fe3O4,Fe3O4@NC 和Fe3O4@NC/G 电极的倍率性能曲线图。由图可知,三组样品中Fe3O4@NC/G 电极拥有最佳的倍率性能。在0.1,0.2,0.5和1 A·g-1的电流密度下循环10 圈后,其放电比容量分别为842.1,780.5,696.6 和643.9 mAh·g-1,并且当电流恢复为0.1 A·g-1时,放电比容量增加到805 mAh·g-1。Fe3O4@NC 电极缺少石墨烯的保护,倍率性能远不如Fe3O4@NC/G 电极。而Fe3O4电极的倍率性能最差。
通过电化学阻抗测试对Fe3O4,Fe3O4@NC 和Fe3O4@NC/G 电极进行电化学动力学探究,结果如图8所示。图中的半圆部分代表电荷转移电阻(Rct),半圆越小说明材料的电荷转移电阻越小。由图可知,Fe3O4@NC 和Fe3O4@ NC/G 电极的半圆半径均小于Fe3O4电极,说明它们的电荷转移电阻更小。进一步对测试结果进行拟合得到Fe3O4@ NC/G 电极的Rct为26.85 Ω,小于Fe3O4@NC 的28.87 Ω 和Fe3O4的35.92 Ω。证明多巴胺和石墨烯的引入降低了Fe3O4的电荷转移电阻,加快了电荷在活性物质表面的传输速率,增强了复合材料的电导率。

图8 Fe3O4,Fe3O4@NC 和Fe3O4@NC/G 的交流阻抗图Fig.8 EIS diagram of Fe3O4,Fe3O4@NC and Fe3O4@NC/G
3 结论
本文采用分步合成的方法制备了Fe3O4@NC/G 复合材料,并对其进行了形貌、结构表征以及电化学性能测试。结果显示,多巴胺与石墨烯的引入,提高了材料的导电性,同时作为Fe3O4体积膨胀的缓冲层,有效提高了材料的电化学稳定性。Fe3O4@NC/G 电极在0.1 A·g-1电流密度下循环30 圈后放电比容量可达1005.6 mAh·g-1,是Fe3O4电极(140.5 mAh·g-1)的7.2 倍。在2 A·g-1的大电流密度下循环300 圈后放电比容量仍有838.3 mAh·g-1。独特的结构设计使Fe3O4@NC/G 复合材料获得了优异的电化学性能,这为其他锂离子电池负极材料的构筑提供了思路。
