循环肿瘤细胞和循环肿瘤DNA 在预测肿瘤免疫治疗效果中的应用及研究进展*
2023-11-14赵宝银吴明军温雪综述薛庆亮审校
赵宝银 吴明军 温雪 综述 薛庆亮 审校
癌症作为威胁人类健康的主要原因之一,其发病率和死亡率仍然呈现不断上升的趋势。据统计,2022年我国有大约482 万例新增癌症病例和321 万例癌症死亡病例[1]。癌症的发病率和死亡率因国家、地域、年龄、性别和癌症类型不同而有所区别,如在国内最常见的癌症是肺癌,美国最常见的癌症是乳腺癌。对国内而言,成人比例的增加和人口老龄化是癌症相关死亡率增加的主要因素。近年来,尽管除了外科手术、放射治疗和化学药物等传统的癌症治疗方法外,免疫治疗、靶向治疗等新型治疗方案不断涌现和更新,但其针对的肿瘤类型和对于其疗效的检测手段有限,这显著缩短了大多数癌症患者的总生存期,降低了该类人群的生存质量。免疫治疗是通过激活免疫系统、调节T 淋巴细胞、靶向阻断细胞调节受体发挥抗肿瘤作用,这类药物包括针对程序性死亡受体-1(programmed cell death receptor-1,PD-1)的纳武利尤单抗、帕博利珠单抗、卡瑞利珠单抗和西米普利单抗,细胞程序性死亡配体-1(programmed death-ligand 1,PDL1)的阿替利珠单抗、度伐利尤单抗和阿维鲁单抗和细胞毒性T 淋巴细胞相关蛋白4(cytotoxic T-lymphocyte antigen 4,CTLA4)的伊匹木单抗和曲美木单抗,上述ICIs 类的抗肿瘤药物在遏制癌症恶性进展的过程中取得了显著的疗效,特别是在癌症晚期,主要体现在非小细胞肺癌和黑色素瘤[2]。虽然ICIs 类药物的安全性是可以接受的,但由于ICIs 相关的不良反应较多,同时ICIs 类药物昂贵的生产成本也增加了癌症患者的经济负担。因此,迫切需要确定合适的生物标志物来评估ICIs 抗实体肿瘤的效果。
目前正式批准用于预测ICIs 治疗效果的生物标志物是PD-L1,但PD-L1 主要用于预测PD-L1/PD-1抑制剂的疗效,并不适用于所有的ICIs,一部分PDL1 低表达或阴性表达的患者也可能对ICIs 有反应[3]。此外,PD-L1 表达的时空模式存在显著的异质性,这提示仅依靠PD-L1 评估ICIs 的抗肿瘤效果是不可靠的。而且免疫治疗方法还包括了过继细胞转移、抗原特异性癌症疫苗和主动免疫治疗,这都在抗肿瘤过程中展现出了一定的效果。因此,对临床医生而言,亟需探索用于预测免疫治疗疗效的新型生物标志物。当前,除了PD-L1 外,也相继出现了较多的候选生物标志物,如癌症驱动基因突变、肿瘤浸润淋巴细胞、POLE/POLD-1 突变、肿瘤突变负荷(tumor mutation burden,TMB)、错配修复缺陷(mismatch repair,MMR)、微卫星不稳定性(microsatellite instability,MSI)、CTCs 和ctDNA 等[4],但是其在ICIs 抗肿瘤疗效中的预测价值存在差异。本文就CTCs 和ctDNA 在评估肿瘤免疫治疗反应中的最新研究进行归纳与总结,以便为临床采用合理有效的预测生物标志物指标提供一定的参考价值。
1 CTCs 和ctDNA 的概述
在19 世纪60 年代,Vasseur 等[5]利用显微镜观察肿瘤患者的外周血时发现了CTCs,并指出CTCs是原发肿瘤或转移瘤自然脱落进入血液循环中的肿瘤细胞。目前,用于CTCs 检测的技术有荧光原位杂交、反转录-聚合酶链反应、免疫荧光、下一代基因测序和微流控芯片技术等。靶向上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)定量CTCs 的Cell Search 是第一种获得美国食品药品监督管理局(FDA)批准的临床验证的CTCs 富集和计数的方法,其指出CTCs是一种>4μm的循环有核细胞,表达Ep-CAM和细胞角蛋白8、18 和(或)19,而白细胞特异性抗原CD45 呈阴性。CTCs 的检测最早被用于早癌的筛查,如非小细胞肺癌、胰腺癌和肝癌等肿瘤的早期诊断。但是在肿瘤早期,由于肿瘤负荷较低,外周血中检测到的CTCs 非常少,并且因为CTCs 失去了对细胞外基质的粘附,血流动力学剪切力和宿主免疫系统的攻击,其将发生细胞凋亡,释放到循环中的CTCs 中仅有不到0.01% 存活并发生远处转移,这是因为CTCs 在血液中的半衰期较短(1.0~2.4)h,如果在早癌切除术后数月或数年患者血液中检测到CTCs 则提示肿瘤复发或转移。通过国内外学者不断对CTCs和ctDNA 的研究,发现当肿瘤进展到中晚期时,肿瘤负荷明显增加,液体活检采集到的CTCs 和ctDNA 数量就会增加,而且基于液体活检术自身的非侵入性、可重复性优势和动态监控性等优势,其的动态检测有助于明确肿瘤细胞的分子图谱和免疫逃逸机制,以便定期追踪肿瘤的进展变化、评估治疗后反应、实时检测肿瘤复发情况及指导治疗,制定精准的治疗方案。这显著地弥补了通过组织活检获取的如PD-L1、TMB 和MMR 等常规预测性标志物所带来的困扰。研究表明,高计数的CTCs 和PD-L1 阳性CTCs 的存在是接受ICIs 治疗的非小细胞肺癌患者的独立危险预后因素[6],Guibert 等[7]前瞻性地评估了接受纳武利尤单抗治疗非小细胞性肺癌患者的疾病进展情况,发现治疗前PD-L1+CTCs 与较差的生存结果相关,几乎所有发生疾病恶性进展的患者均可检测到PD-L1+CTCs。
虽然从全血中捕获CTCs 较为麻烦且数量有限,但CTCs 提供了获取CTCs 携带的DNA、RNA 和蛋白质等基因水平信息的机会。CTCs 经过凋亡或坏死途径进入外周血中的肿瘤细胞,将其片段化的短链DNA 释放入血,形成ctDNA,其具有与原始肿瘤细胞相同的遗传缺陷。对于ctDNA 的检测,有微滴数字聚合酶链反应-磁珠-乳化-扩增和磁力法、标记扩增子深度测序、深度测序的癌症个性化分析、全基因组亚硫酸氢盐测序、全外显子组测序和全基因组测序等多种分析方法。数字PCR 和下一代基因测序技术(next generation sequencing,NGS)是两种已经被应用于检测癌症患者的ctDNA 的手段,检测发现ctDNA 的片段大小为(120~160 )bp,这也是环绕在染色体上的DNA 长度。其动态测定可以有助于了解肿瘤的负荷、特异性突变、抗原表型以及对免疫治疗的效果,被认定是一种新型的检测肿瘤免疫治疗反应的生物标志物。研究表明,与健康对照组相比,癌症患者的ctDNA 数量显著增加,而晚期肿瘤患者的ctDNA 数量更高[8]。在对非小细胞肺癌进行免疫联合化学治疗的研究中发现,在预测生存结局方面,早期ctDNA 检测的性能优于早期影像学检查[9]。大量的研究结果表明,CTCs和ctDNA 的检测适用于检测因表皮生长因子受体(epidermal growth factor receptor,EGFR)突变、生产肿瘤抑制蛋白BRCA1 和BRCA2 基因染色体重排、PIK3CA、TP53 和HER2 突变、以及EpCAM 和细胞角蛋白8、18、19 和白细胞特异性抗原CD45 表达异常所致的肿瘤患者对免疫治疗的反应[10]。
2 CTCs 参与宿主免疫逃逸机制
CTCs 是恶性肿瘤发生远处转移的“种子”,其逃避宿主免疫系统和靶向药物的攻击,加重肿瘤患者的病情进展,但是目前关于CTCs 是如何逃避免疫监视的机制尚未明确。Liu 等[11]采用单细胞RNA 测序技术分析了胰腺导管腺癌的CTCs、原发灶和转移灶的转录组特征显示:CTCs 和自然杀伤细胞(natural killer cell,NK)细胞通过免疫检查点分子对HLA-E:CD94-NKG2A 相互作用,机体可以通过阻断NKG2A 或下调HLA-E 表达来破坏这种相互作用,增强NK 细胞介导的抗肿瘤作用,阻止肿瘤的恶性进展。但是进一步研究发现血小板源性RGS18 通过AKT-GSK3β-CREB 信号通路上调HLA-E 的表达,同时发现肿瘤患者的机体过表达RGS18,这使得CTCs 免受了NK细胞的监视,导致胰腺癌肝转移。当然,目前研究的热点免疫检查点内的免疫抑制分子PD-1 和PD-L1 的特异性结合也参与肿瘤细胞的免疫逃逸过程,这才使得ICIs 的抗肿瘤作用产生了一定的效果。表达在所有有核细胞表面上的主要组织相容性复合体Ⅰ(major histocompatibility complex Ⅰ,MHCⅠ)具有由从细胞内蛋白中提取的肽表位,通过将肿瘤相关抗原提呈给T 细胞受体,以便适应性启动CD8+T 细胞介导的免疫应答。但是,研究发现CTCs 表面MHCI 表达量降低甚至丢失,这可能是导致CTCs 发生免疫逃逸的机制之一,较低的MHCI 表达水平与较高的肿瘤分级和肿瘤转移之间呈正相关,这表明MHCⅠ分子与CTCs 的恶性转移行为有关[12]。Donato 等[13]对乳腺癌的转移研究中发现大多数的CTCs 簇和单个CTCs 均处于缺氧状态,血管内皮生长因子可以导致原发肿瘤缩小,但增加了肿瘤内的缺氧环境,导致高转移能力的CTCs 簇的聚集。同时,CTCs 内许多缺氧相关基因均呈上调,比如胰腺癌相关的CTCs 在缺氧情况下,通过调控Circ_0000977/miR-153 轴上调HIF1α、ADAM10 和SMICA 的表达,导致NK 细胞中的NKG-2D 减少,使得CTCs 逃离免疫监测和NK 细胞介导的细胞毒性作用。白细胞表面抗原CD47 在肿瘤细胞逃避吞噬清除方面具有重要价值,CD47 与表达在巨噬细胞和树突状细胞上的配体信号调节蛋白α 结合(signal regulatory protein α,SIRPα)抑制这些细胞对肿瘤细胞的吞噬作用。研究发现CTCs 内CD47 高表达,可能赋予了CTCs 非免疫原性的特征,使得其能够逃脱因细胞损伤诱导的相关信号上调后导致的吞噬清除作用,发挥免疫逃逸[14]。此外,在转移性乳腺癌患者的CTCs 中检测到CD47、CD44、EpCAM 和酪氨酸跨膜受体的表达,而且共同表达CD47 和酪氨酸跨膜受体的CTCs 数量与生存率降低和转移部增加相关。凋亡相关因子(factor-related apoptosis,FAS)/凋亡相关配体(factor-related apoptosis ligand,FASL)与细胞凋亡途径与免疫逃逸密切相关,在首次研究FASL 在CTCs 免疫逃避中的作用时分析了乳腺癌患者外周血淋巴细胞亚群上FAS 的表达,发现在CTCs 存在的情况下,FASL+的肿瘤细胞可以通过减少表达FAS 的免疫细胞的激活,协助肿瘤细胞逃避细胞毒性CD8+T淋巴细胞的免疫识别和攻击[15]。最近的研究发现,金复康可以通过上调FASL 的表达,促进NK 细胞分泌TNF-α,使得NK 细胞通过调控FAS/FASL 信号通路诱导CTCs 凋亡,从而发挥抗非小细胞肺癌的作用[16]。也有研究表明,趋化因子CCL5 在CTCs 中的过表达受p38-MAX 信号的转录调控,CCL5 可以募集调节性T 细胞,上调TGF-β 的表达从而促进CTCs 的免疫逃逸[17]。
综上所述,CTCs 对局部进展期或远处转移性的肿瘤接受免疫治疗后疗效的预测价值更为显著。肿瘤细胞释放入血后以CTCs 形式通过多种机制逃避免疫细胞的监视,免受免疫系统攻击,介导肿瘤的复发和转移的机制图,见图1。
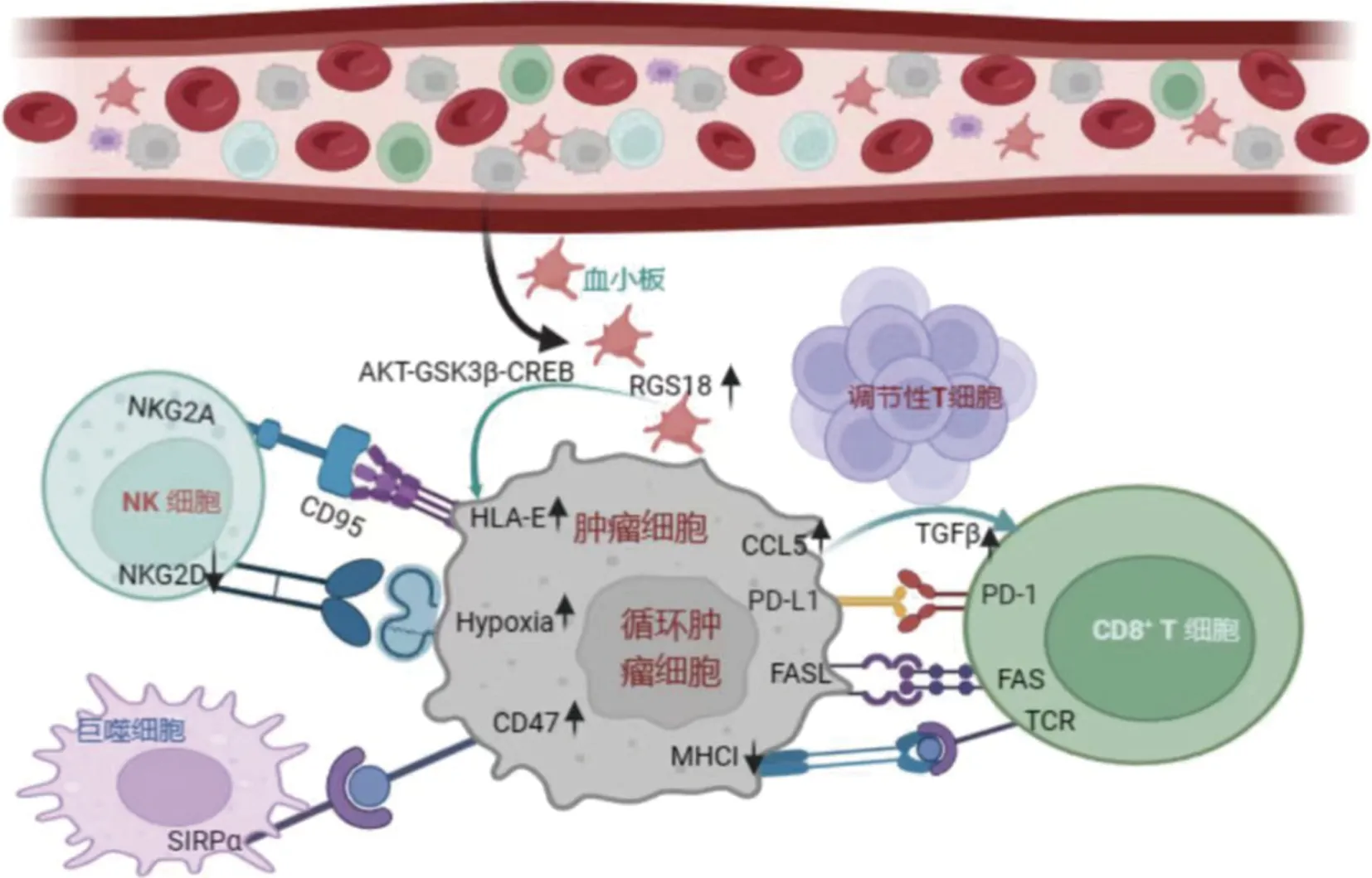
图1 循环肿瘤细胞逃避宿主免疫监视的可能机制
3 CTCs 和ctDNA 与肿瘤的免疫治疗
尽管以ICIs 为主的免疫治疗的问世明显地改善了部分肿瘤患者的生存状况和生存质量,但是其不良反应及局限性不容忽视,需要不断更新预测ICIs 疗效的新型生物标志物以帮助一线临床医生更好地调整治疗方案,评估患者的预后。随着不断的深入探索,研究者们发现CTCs 和ctDNA 不仅可以逃避宿主免疫系统和化疗药物的攻击,也可以预测ICIs 的抗肿瘤效果,而且在监控外周血内ctDNA 的表达时也可以对血源性的TMB 和MSI/dMMR 进行部分检测,采用多种预测性标志物联合的方式评估肿瘤的免疫治疗效果。根据国内外的研究报道发现CTCs 和ctDNA 已经被应用于如肺癌、肝癌、结直肠癌、胃癌、移行细胞癌和头颈部鳞状细胞癌等少部分肿瘤免疫治疗效果的预测中。
3.1 肺癌
肺癌是全球癌症相关死亡的主要原因,其中,非小细胞肺癌约占80%。但是ICIs 使得晚期非小细胞肺癌患者的预后发生革命性的改变,以PD-L1 为首的预测ICIs 抗肺癌疗效的生物标记物也提高了对治疗方案选择的准确性。与此同时,CTCs 和ctDNA 对ICIs 的预测价值也逐渐被重视。Castello 等[18]团队研究发现,与ICIs(纳武利尤单抗、帕博利珠单抗、纳武利尤单抗联合伊匹木单抗和阿替利珠单抗)治疗前的非小细胞肺癌患者相比,治疗8 周后肺癌患者的平均CTCs 数分别为(15±28)个和(11±19)个细胞,经多变量分析后确定在ICIs 治疗8 周时CTCs 计数是无进展生存期和总生存期的独立预测指标。Zhou 等[19]研究也发现了相似的结果,接受ICIs 治疗后的非小细胞肺癌患者CTCs 数量下降,PD-L1 转阴,患者的中位无进展生存期明显延长(5.6 个月vs.1.4 个月),提示CTCs 可能有助于确定从免疫治疗中受益的患者亚群。研究发现,肺癌的CTCs 可以检测到上的PD-L1,并且具有肿瘤异质性,PD-L1 在对应的肿瘤组织中的表达与CTCs 之间无相关性。目前仅有一项研究发现CTCs上PD-L1 阳性和肿瘤组织上PD-L1 阳性染色可以作为晚期肺癌患者对ICIs 更好反应的生物标志物[20]。
在晚期非小细胞肺癌中,ctDNA 与肿瘤细胞之间有很高的一致性,这意味着ctDNA 包含与在原发肿瘤及其转移瘤中发现的相同的特异性突变。Raja 等[21]利用靶向测序评估了经度伐利尤单抗治疗后的非小细胞肺癌患者体内ctDNA 中多个基因体细胞突变的变异等位基因频率,发现ctDNA 变异等位基因频率的减少是免疫治疗长期获益的有效预测因素。研究表明,在非小细胞肺癌的ICIs 治疗时,低水平的ctDNA 与患者良好的总生存期、无进展生存期和客观缓解率相关(P<0.001)[22]。由于ctDNA 的检测可以准确的反映肿瘤组织的TMB,研究发现 ctDNA 中较高的TMB与接受ICIs 治疗的NSCLC 患者较长无进展生存期相关。但是,也有研究发现肿瘤组织或ctDNA 蛋白酪氨酸磷酸酶受体的磷酸酶结构域的有害突变可以作为非小细胞肺癌患者ICIs 治疗后临床结局的预测性生物标志物,而且独立于TMB 或PD-L1 表达。
3.2 肝癌
原发性肝癌由于其明显的异质性、潜伏性、诊断较晚和全身治疗效果欠佳等特点,手术切除和(或)组织病理活检至今仍被临床医生普遍认为是临床决策的金标准。但是组织活检因为其侵入性,临床应用受限,而以CTCs 和ctDNA 为主的液体活检恰好弥补了这一缺点,并且可以提供所有癌症病变(原发性和转移性肿瘤)的遗传图谱,动态跟踪基因组变异,反映免疫治疗的效果。有研究显示,在对PD-L1+的肝细胞癌患者进行PD-1 抑制剂阻断治疗后,PD-L1+CTCs 的存在与良好的总生存期有很强的相关性。Hsu 等[23]对不可切除肝细胞癌患者进行阿替利珠单抗联合贝伐珠单抗治疗的ⅠB 期临床试验发现ctDNA 与良好的无进展生存期有关(P<0.03)。最近另一项使用卡瑞利珠单抗联合阿帕替尼治疗可切除肝细胞癌患者的队列研究表明,完成新辅助治疗后ctDNA 阳性的患者比ctDNA 阴性的患者呈现更短的无复发生存期。也有研究表明对晚期原发性肝癌患者进行免疫治疗前,采用ctDNA 来源的TMB 分析也有助于预测患者免疫治疗的反应。然而,一项对121 份肝细胞癌来源的血液样本的研究发现,ctDNA 与接受酪氨酸激酶抑制剂治疗患者的无进展生存期相关,而与ICIs 治疗的总生存期、无进展生存期和客观缓解率均不相关,这与前期的研究结果相互矛盾[24]。因此,关于CTCs 和ctDNA在肝癌免疫治疗中的预测价值仍需更多的前瞻性研究进行证实。
3.3 胃肠道肿瘤
在2020 年的美国临床肿瘤学会年会上,一项临床研究报道强调ctDNA 可以预测帕博利珠单抗治疗胃癌和度伐利尤单抗治疗晚期食管腺癌患者的反应,即ctDNA 与更长的无进展生存期相关[25]。Kim 等[26]发现,转移性胃癌经帕博利珠单抗治疗6 周后发现与低ctDNA 负荷患者相比,高ctDNA 负荷患者的总有效率和无进展生存期显著提高。Yue 等[27]在评估胃肠道肿瘤对PD-1/PD-L1 抑制剂疗效中发现基线时高表达PD-L1 的CTCs 的可以作为PD-1/PD-L1 阻断剂治疗患者的预测指标。目前,甲基化ctDNA 在预测结直肠癌免疫治疗反应中的作用也被研究。如甲基化SEPTIN9 DNA 作为转移性结直肠癌患者对免疫治疗反应的标志物,该标志物表明ctDNA 水平的降低表明肿瘤对免疫治疗有反应。反之,则提示肿瘤对免疫治疗的效果欠佳。
3.4 泌尿系肿瘤
Chalfin 等[28]评估了接受联合免疫治疗的转移性泌尿系肿瘤患者的CTCs 特征与患者生存和疾病进展的关系发现较短的生存期可能与基线时较高的CTCs计数、特定CTCs 形态亚型、PD-L1+CTCs 的存在以及低CD4/CD8 T 细胞的比值有关。一项关于可手术切除尿路上皮癌患者阿替利珠单抗新辅助治疗的随机对照Ⅲ期临床试验发现在ctDNA 阳性患者中,阿替利珠单抗组的无病生存期和总生存期均优于观察组(P<0.01),对于ctDNA 阴性的患者,两组的无病生存期或总生存期无差异,而且,在治疗第6 周时,阿替利珠单抗组的ctDNA 清除率高于观察组(P<0.05)[29]。Raja 等[21]评估了经度伐利尤单抗治疗后膀胱癌患者体内ctDNA 的变化发现ctDNA 的减少是患者获得较长无进展生存期和总生存期的独立预测因素。Ravindranathan 等[30]报告了2 例经帕博利珠单抗治疗的转移性雄激素阻断疗法耐药的前列腺癌患者,通过检测ctDNA 来源的MSI-H 状态发现治疗后患者的前列腺特异性抗原水平和ctDNA 的变异等位基因频率均显著降低。有研究通过检测ctDNA 评估帕博利珠单抗联合立体定向体部放疗治疗转移性尿路上皮癌疗效,结果提示降低的ctDNA 与良好的免疫应答相关。
3.5 其他类型肿瘤
一项队列研究结果显示在头颈部鳞状细胞癌的PD-1 抑制剂治疗中,EpCAM+CTCs 中PD-L1 的过表达与预后有关,治疗结束时CTCs 中PD-L1 过表达的缺失与肿瘤的完全缓解正相关[31]。
在黑色素瘤患者中,研究人员发现,接受一线ICIs治疗的基线低水平ctDNA(≤ 20 拷贝/mL)的患者显示出较高的无进展生存期。当ctDNA 升高时,接受CTLA-4 联合PD-1 抑制剂治疗的患者比仅接受PD-1 抑制剂治疗的患者显示出更好的无进展生存期。Herbreteau 等[32]在对黑色素瘤患者抗PD-1 治疗的前瞻性研究中发现ctDNA 检测是患者良好生存结果的独立预后因素,早期ctDNA 定量监测可能有助于检测转移性黑色素瘤对抗PD-1 免疫疗法的原发性耐药性。
最近的一项关于应用液体活检和NGS 检测ICIs治疗晚期三阴性乳腺癌效果的研究显示突变的ctDNA 基因与更短的无进展生存期相关,外周血ctDNA 的动态变化可以被用于跟踪晚期三阴性乳腺癌患者ICI 治疗的有效性。Jacot 等[33]前瞻性评估了72 例转移性乳腺癌患者PD-L1+CTCs 的临床病理相关性和预后价值发现PD-L1+CTCs 与无进展生存期有显著相关性,而与组织中PD-L1 的表达无显著相关。因为ctDNA 的NGS 可以检测到体细胞突变,Araujo等[34]证实ctDNA 来源的高TMB 可以预测转移性乳腺癌患者ICIs 的疗效,血源性TMB 和组织源性TMB 相比,其差异具有统计学意义(P=0.002)。
CTCs 和ctDNA 可以作为免疫治疗的候选生物标志物,以便评估ICIs 抗实体瘤的预后和结果。相关的临床试验,见表1。
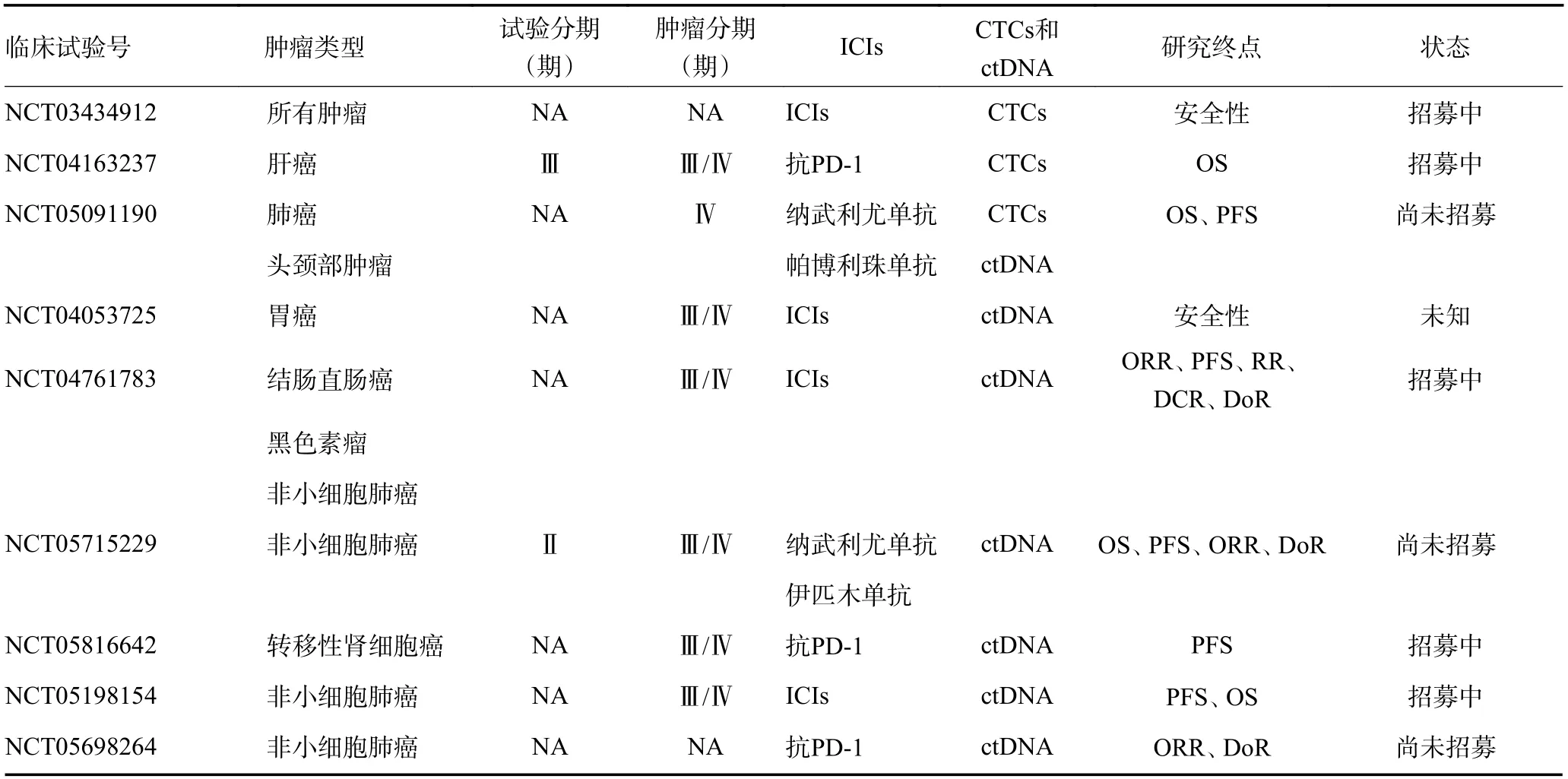
表1 正在进行的通过循环肿瘤细胞和循环肿瘤DNA 预测接受免疫检查点抑制剂治疗实体瘤效果的相关临床试验
4 结语和展望
ICIs 的出现极大地改变了部分实体瘤的预后和结局,但是预测ICIs 治疗效果的生物标志物,如PDL1、TMB 和MMR/dMMI,因其获取途径主要是通过组织活检,存在侵入性、肿瘤部位的单一性和无法重复采集等缺陷,目前仍无法满足临床需求。以CTCs和ctDNA 为主的液体活检是一种相对新型的检测方法,可以协助指导预防、诊断和治疗癌症的临床决策。随着对CTCs 检测技术的不断进步,CTCs 相关的基因组学、转录组学和表观遗传学等信息逐渐被研究者获取,帮助肿瘤学家能够更精确地探索CTCs 和ctDNA 的临床价值。目前,已有研究发现通过动态检测ICIs 治疗前、治疗后以及不同疗程期间内CTCs 的数量和ctDNA 的表达,可以达到预测ICIs 抗部分肿的临床疗效的目的,如非小细胞肺癌、肝癌、胃肠道肿瘤、泌尿系肿瘤、头颈部鳞状细胞癌等。而且,也有研究表明在检测肿瘤患者外周血内CTCs 和ctDNA 的表达时,也可以对PD-L1、TMB 和MMR/dMMI 等遗传预测因子进行部分鉴定,从而提高CTCs 和ctDNA预测价值的准确性和可靠性。但是由于相关的研究数量较少、部分研究结果尚存争议,使其预测价值的可行性较差。未来仍需要更多的前瞻性研究来评估利用CTCs 和ctDNA 预测ICIs 抗实体瘤的效果。但这并不能够否认CTCs 和ctDNA 的重要性,CTCs 和ctDNA 仍然是一个具有前景的新型生物学标志物。
本文无影响其科学性与可信度的经济利益冲突。
