中国抗癌协会肠道微生态技术整合诊治指南(精简版)
2023-11-14中国抗癌协会肿瘤与微生态专业委员会
中国抗癌协会肿瘤与微生态专业委员会
肠道微生态(intestinal microecology,IM)的多样性和生物功能与各种疾病之间关系的研究越来越多,并逐渐向临床转化[1-3]。较传统方法,采用粪菌移植(fecal microbiota transplantation,FMT)、肠道微生态调节剂、基因工程细菌等微生态治疗策略在难治性艰难梭菌感染(Clostridioides difficile infection,CDI)、炎症性肠病、移植物抗宿主病(graft-versus-host disease,GVHD)等疾病的治疗有更好的疗效[4-5]。肠道微生物对肿瘤的发生、发展及治疗反应等方面均有重要影响,通过检测肠道菌群能够及时发现疾病相关的菌群异常,对预防和治疗疾病都有重要的意义。IM 维持宿主免疫系统功能,在控瘤药物治疗中发挥关键作用[6-7]。
1 IM 检测技术概况
目前,IM 检测方法主要有16S rRNA 测序、元基因组测序和基于纳米孔测序的全长基因测序。16S rRNA 测序相对简便,成本较低,元基因组测序涵盖范围更全面,能鉴定微生物到菌株水平。随着NGS 技术快速发展,越来越多微生物16S rRNA 序列能够被测定并收录入国际基因数据库中,16S rRNA 基因成为系统进化分类学研究中最常用的分子标记,广泛用于微生物生态学研究。通过提取样品中DNA,特异性扩增某个或两个连续高变区,采用高通量测序平台对高变区序列测序,然后通过生物信息学行序列分析和物种注释,可了解样品群落组成;进一步通过alpha 多样性和beta 多样性分析以进一步比较样品间差异性。基于纳米孔技术的16S 测序,可设计引物覆盖整个16S 基因,甚至整个核糖体操纵子。纳米孔测序在准确分辨更多物种方面优于传统测序平台[8-9]。
元基因组测序指对环境样品中微生物群落的基因组进行高通量测序,除细菌外,还可覆盖真菌、病毒和寄生虫等。元基因组在分析微生物多样性、种群结构和进化关系基础上,进一步探究IM 功能活性、菌间协作关系及与环境间的关系,发掘潜在生物学意义。与传统微生物研究方法比,元基因组测序摆脱了微生物分离纯培养的限制,克服了未知微生物无法检测的缺点,扩展了微生物检测与利用空间,因此近年在微生物组学研究中得到广泛应用。对特定患者如CDI、化疗后粒细胞缺乏应用广谱抗生素后腹泻患者及拟行粪菌移植或益生菌预防或治疗患者,推荐选择更深入的微生物检测,其中16S rRNA 测序相对简便,结合保守区和高变区设计引物,成本较低。部分带有分类信息的区域在被分析的扩增子之外,该方法在鉴定分辨能力上有所降低。元基因组测序在菌种水平和菌株水平鉴定更有优势,涵盖范围更全面,除细菌外,还可鉴定真菌、病毒和寄生虫等,可鉴定无法培养及未知的微生物[10]。
2 IM 检测技术流程
2.1 检测流程
IM 检测流程较为复杂,涉及标本采集和管理、核酸提取、文库制备、上机测序、数据分析和质控等多个过程,检测结果受多方面因素影响(图1)。标本采集建议在粪便内部位置多点取样,既可避免污染,又能更真实地反映肠道内部的微生物情况;为保证肠道菌群稳定性,建议取样后立即加入肠菌保藏液,保藏液可迅速裂解肠道菌群以达固定作用,避免肠菌体外增殖会大大改变肠道菌群原始状态,保藏液可帮助肠菌在常温下一周内保持稳定。
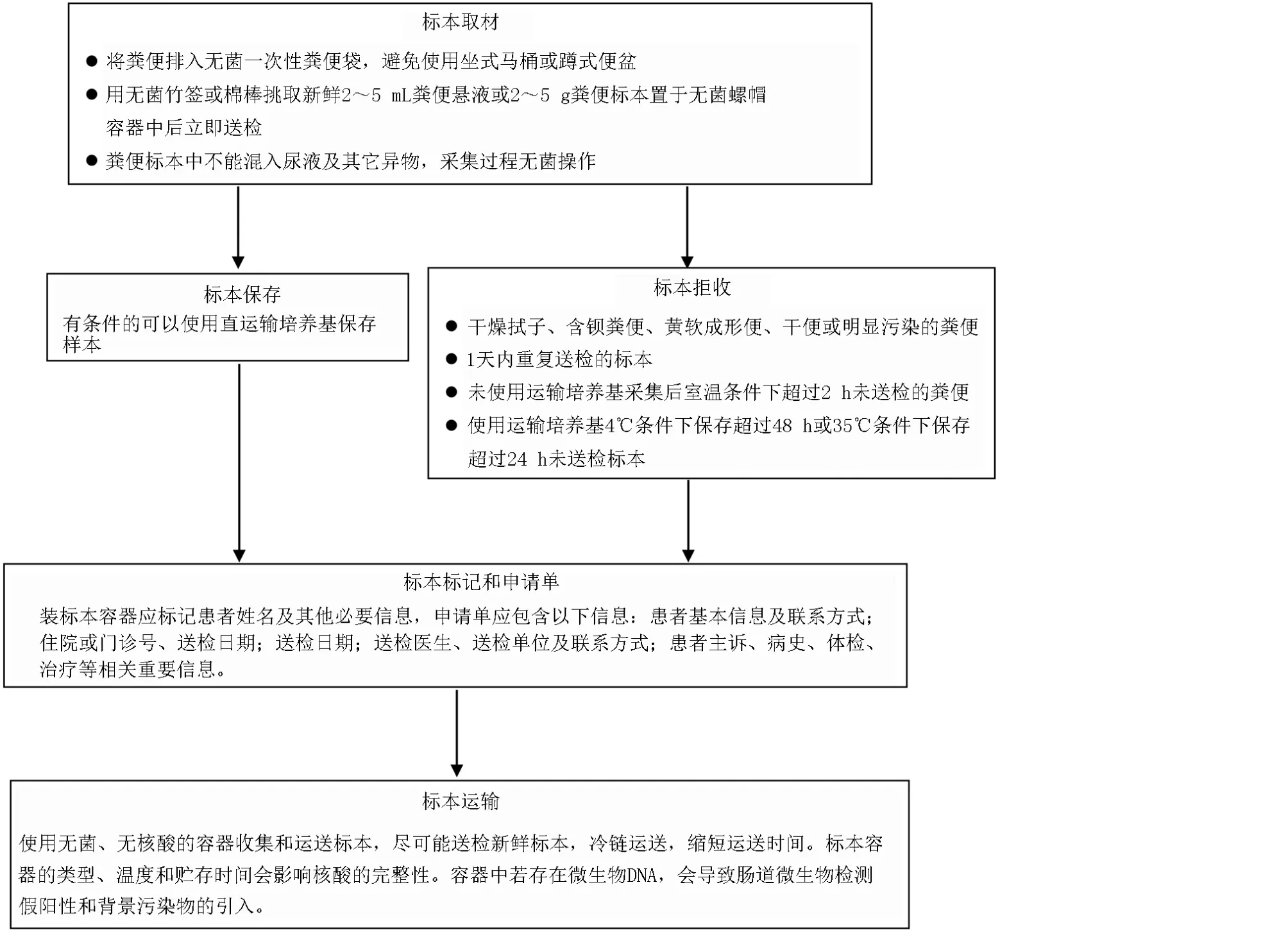
图1 标本采集流程图
2.2 核酸提取及文库制备
应使用经过性能确认的核酸提取试剂,推荐使用商品化的DNA 抽提试剂盒,建立完整核酸检测流程,确保提取方法可重复性和提取效率。DNA 降解程度和各种杂质污染均会对检测灵敏度造成影响,通过测定核酸浓度、纯度和完整性,制定合格样本标准。操作过程严格遵守无菌操作,污染防控对标本检测结果的质控至关重要。每批实验需包括内参照、阴性对照品和阳性对照品。DNA 合格样本参考:DNA A260/A280 在1.7~1.9,A260/A230>2,DNA 质量可用1%琼脂糖凝胶电泳验证(无拖尾、无杂带、无蛋白污染)。DNA 完整性可用分析仪等检测,如大部分片段低于200 nt,说明DNA 降解严重,需重提DNA[11]。
文库制备流程包括核酸片段化、末端修复、标签接头连接和PCR 文库等。文库制备对核酸样本有严格要求,每次提取核酸样本需定量检测,起始核酸量定量≥0.1 ng/μL,确保核酸满足实验要求。若不满足重新提取核酸或再次送检样本。目前常用建库方法有酶切建库、超声波打断建库及转座酶建库等。推荐使用经性能确认的建库试剂或商品化建库试剂盒。文库质量直接影响测序数据质量,文库DNA 质量合格参考:A260/A280 在1.75~2.00,文库浓度≥1 ng/μL,若不满足需重新构建文库。此外,还应使用Agilent 2100 或其他生物分析仪器检测文库片段大小及峰型,合格文库插入片段长度大于100 bp,文库应有明显主峰、无杂峰、无引物二聚体、无接头。若不满足重新构建文库或重新提取,如仍不合格需重新送检样本。文库定量目前常用Qubit 荧光计、实时荧光定量PCR 等。推荐使用实时荧光定量PCR 方法,可使用NGS 定量PCR 检测试剂盒[12]。
2.3 上机测序及生物信息学分析
目前国内实验室常用NGS 测序平台有Illumina、Thermo Fisher 和MGI 等,各平台有不同型号设备配置。测序前需根据测序平台确定相应数据参数,并据测序片段长度、检测标本数量、标本质量和最低测序深度等选用合适芯片,以保证测序结果数据质量合格。推荐使用商品化的上机试剂盒。检测过程中,分别根据所用芯片容量、构建文库片段大小等指标判断所得读长总数、测序平均读长等数据是否合理。不同测序平台的参数要求有差异。16S rRNA 测序常用PCR技术对16S rRNA 的V2、V3、V4、V6、V7、V8、V9高变区行扩增,扩增产物行定量,经末端修复后加特异性接头行扩增,完成测序文库构建。检查肠道菌群16S 测序质控合格标准:片段长度在200、250、300 bp左右处有3 个峰。元基因组测序是通过对微生物基因组随机打断,然后在片段两端加入接头进行扩增,文库片段主峰在300~500 bp,上机测序后通过组装的方式将小片段拼接成较长的序列[12]。测序序列长度直方图示例见图2。
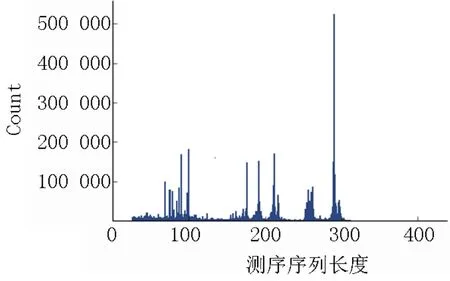
图2 测序序列长度直方图
生物信息学分析主要是对测序产生原始数据进行处理和分析,包括数据质控、微生物物种检测等过程。IM 检测可选择具有商业化自动分析的系统,实验室也可选择与国际同步的算法和软件,搭建实验室个性化分析流程。微生物检测数据库包含细菌、真菌、病毒和寄生虫基因组序列信息,其中支原体、衣原体、螺旋体和立克次体视情况可独立也可并入细菌类别中。公共数据库需验证后方可使用。构建微生物数据库应优先选择全长参考基因组及测序质量高、样本来源、临床信息完整序列。流程中所用各种试剂也可能存在微生物个体或核酸,应建立试剂背景微生物序列数据库[13]。针对OTU 聚类分析有较多升级方法,UCHIME嵌合体检测算法整合了UPARSE 算法和UCHIME算法,相较于此前聚类方法有较大进步。生成OTU除聚类方法,还有降噪方法,对16S 等扩增子测序结果的确认逐渐从UPARSE 算法转向DADA2 算法,采用DADA2 算法进行聚类获得ASV 表格,针对ASV表格可以展开丰富的分析流程。不同样本对应的reads 数量差距较大,为避免因样本测序数据大小不同造成分析偏差,在样品达到足够测序深度情况下,对每个样品进行随机抽平处理。物种累积曲线用于描述随着抽样量加大而物种增加的情况,是调查物种组成和预测物种丰度的有效工具。
物种丰度分析是根据物种注释结果,在不同等级对各样品做物种profiling 相应的柱状图,可以直观查看各样品在不同分类等级上相对丰度较高的物种及其比例。Heatmap 是一种以颜色梯度表示数据矩阵中数值大小,并根据物种丰度或样品相似性进行聚类的图形展示方式。聚类加上样品的处理或取样环境等分组信息,可帮助直观地处理相同或相似环境样品的聚类情况,并直接反应样品群落组成的相似性和差异性。此项分析内容可分别在不同分类水平进行Heatmap聚类分析。物种累积曲线示例见图3,横坐标表示样品的数量,纵坐标表示OTUs 的数量;由该曲线图可以判断抽样量是否充分,在抽样量充分的前提下,运用物种累积曲线还可以对物种丰度进行预测。
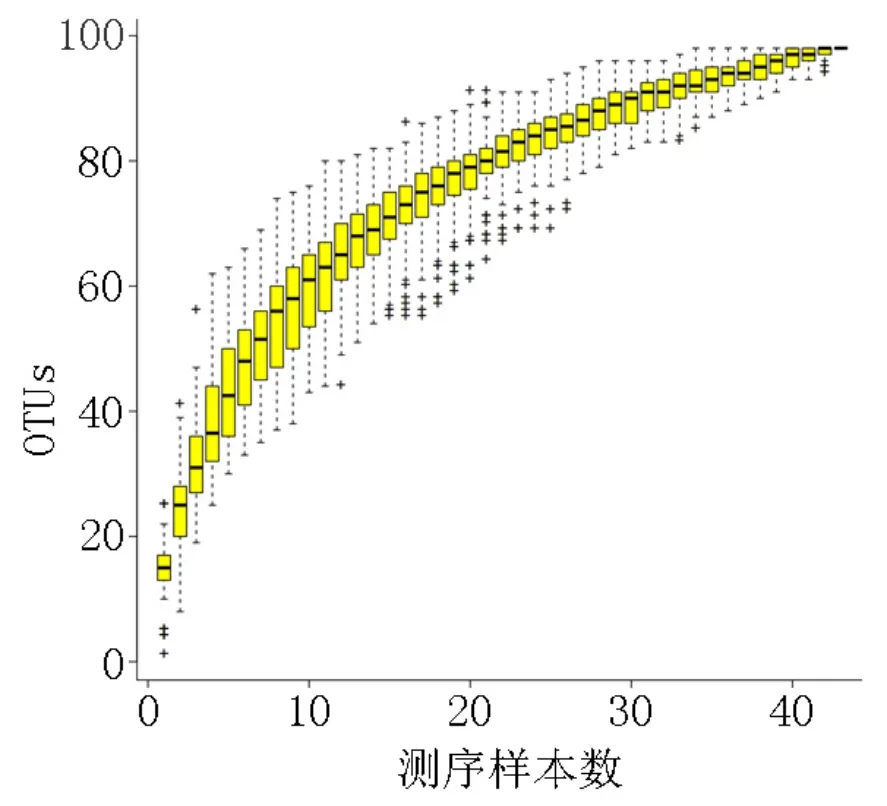
图3 物种累积曲线
Alpha 多样性是对单个样品中物种多样性和物种丰度的分析,使用相关软件计算样品的alpha 多样性指数值,并作出相应稀释曲线,样本间物种丰度分布差异程度可通过统计学中的距离进行量化分析,使用统计算法计算两样本间距离,获得距离矩阵,可用于后续beta 多样性分析和可视化统计分析。样品测序深度alpha 多样性稀疏曲线图示例见图4,横坐标表示抽取的reads 数,纵坐标表示相应的alpha 多样性指数值,图中一种颜色代表一组样品,测序条数不能覆盖样品时,曲线上升;测序条数增加到覆盖样品中的大部分微生物时,曲线呈平缓趋势。
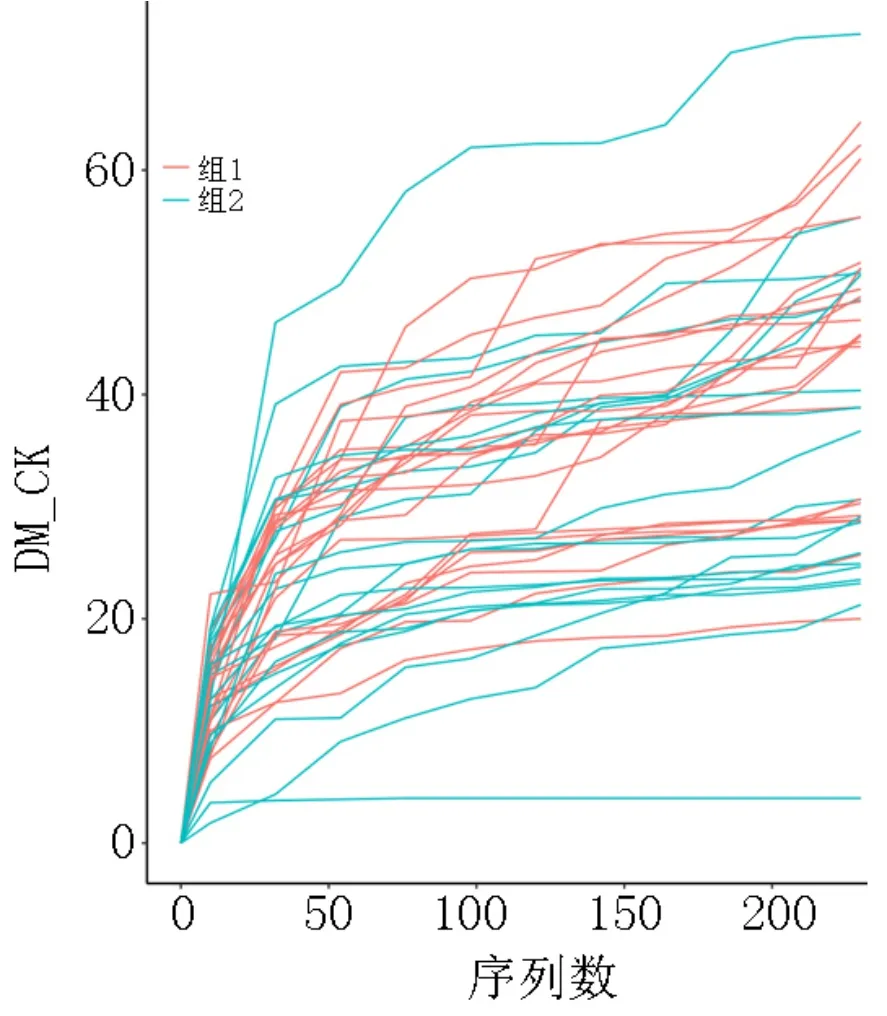
图4 样品测序深度alpha 多样性稀疏曲线图
3 肿瘤治疗相关IM 损伤
IM 可在防御感染中发挥作用,化疗会造成机体微生物组的破坏,增加微生物侵入性感染风险,恢复IM 组成是降低该风险的潜在策略。IM 可致定植抗性,通过共生细菌产生的细菌素/抗菌肽及其他蛋白质对细菌细胞壁的攻击等途径杀死致病菌和其他竞争微生物。IM 改变在肿瘤治疗中的影响越来越受到重视。胃肠道反应是实体瘤及血液肿瘤患者化疗后的常见临床表现,增加患者治疗风险,影响疗效及预后。化疗后消化道症状包括恶心、呕吐、厌食,严重的口腔及肠道黏膜炎、腹痛、腹泻、便秘,常与化学药物剂量及毒性密切相关;患者高龄、免疫功能低下、中性粒细胞减少及骨髓抑制,尤其合并特殊致病微生物感染的复杂临床情况下,开展消化道IM 检测、指标监测及对抗生素应用的影响尤其重要。需针对化疗后口腔及胃肠道症状、消化系统并发症的主要治疗策略做出不同强度的推荐,包括大多数非感染性和感染性并发症的治疗以及相应的护理措施,结合IM 检测、中医药、FMT 的应用等,可为肿瘤与微生态领域的深入研究提供依据[14-15]。
3.1 化疗所致IM 损伤相关的呕吐及黏膜炎
化疗所致恶心呕吐是治疗中的主要不良反应,预先判断化疗药物可能导致的呕吐对患者整体治疗具重要意义。化疗药物方案使用前需多学科整合诊治(MDT to HIM)讨论决定,详细阅读化疗药物说明书,接受常规剂量化疗患者约40% 会出现口腔黏膜炎。造血干细胞移植者,接受预处理患者黏膜炎发生率可达80%~95%。化疗药物、剂量、给药途径、频率及患者耐受性等多种因素均可能与黏膜炎相关,如有继发性或定植微生物感染,黏膜炎时间可能延长。黏膜炎发生的病理机制包含一系列阶段:启动-放化疗通过直接作用损伤DNA,促炎症细胞因子的产生;上调-启动阶段的损伤激活NF-κB 途径;反馈环路放大信号传导。此3 个阶段发生于临床上显著的黏膜炎出现之前,随后是溃疡和炎症及愈合,时间为10~14 天[16-17]。
3.2 化疗所致IM 损伤相关的持续性腹泻
化疗相关性腹泻(chemotherapy-related diarrhea,CRD)是肿瘤患者治疗后常见症状,严重影响日常生活质量。重度CRD 常需住院治疗,甚至可能因脱水和感染而危及生命。腹泻最常见于使用化疗药物(如氟尿嘧啶和卡培他滨)、某些分子靶向药(如索拉非尼、舒尼替尼)以及免疫检查点抑制剂(如伊匹木单抗、纳武利尤单抗和帕博利珠单抗)。应针对CRD 并发症和病因:若存在重度(3 级或4 级)腹泻,持续性轻至中度(1 级或2 级)腹泻,或腹泻伴中性粒细胞减少、发热或大便带血,需血液和大便培养、艰难梭菌产毒菌株检查;血性腹泻需粪便培养及检测肠出血型大肠埃希菌、志贺毒素;对有发热、腹膜刺激征或血性腹泻者,应做腹部和盆腔CT 扫描,并请外科医生会诊。绝大多数患者无需内镜检查,对难治性患者和慢性腹泻(即整个化疗周期持续存在腹泻)或血性腹泻患者应考虑内镜检查。化疗期间腹泻需鉴别其他病因,包括脂肪或胆汁酸吸收不良、乳糖不耐受、小肠细菌过度生长及感染性原因[18-20]。
治疗推荐:预防初始非药物措施包括避免可能加重腹泻的食物,摄入半流质膳食及口服补液,避免含乳糖的食物,停用导致腹泻的药物如大便软化剂、泻药。推荐CRD 的初始治疗为洛哌丁胺,轻至中度无并发症的CRD,建议初始剂量为4 mg,之后2 mg/4 h;重度腹泻患者可使用大剂量洛哌丁胺(最初4 mg,之后每2 mg/2 h)。洛哌丁胺治疗无效的CRD 患者推荐奥曲肽,初治剂量为1 次100 μg 或150 μg,3 次/d,皮下注射。对有发热、中性粒细胞减少、低血压、腹膜刺激征或血性腹泻的患者,应给予静脉用抗生素。洛哌丁胺和大剂量奥曲肽治疗后腹泻仍未停止建议行上消化道内镜或胶囊胃镜检查,可选择小肠胶囊内镜检查,观察整个小肠黏膜包括出血、恶性肿瘤和黏膜损伤等情况,并行病理组织活检以评估是否存在巨细胞病毒或CDI。重度CRD 患者在无腹泻48 h 且无需使用止泻药48 h 后,才能恢复相同化疗方案。所有在先前治疗周期中出现2 级或更重腹泻者,应减少化疗剂量。鉴于肠道腹泻与IM 对肿瘤化疗过程的影响,建议在开展化疗及造血干细胞移植前、后检测IM 变化。
4 造血干细胞移植相关IM 损伤
随着异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)的广泛开展和新型免疫抑制剂的使用,病原微生物感染、抗生素耐药对移植工作造成了极大的不良影响。IM 对宿主具多种作用,如影响宿主免疫系统发育,影响食物消化、必需氨基酸、次生代谢产物、短链脂肪酸和维生素的合成,调节宿主免疫反应等。造血干细胞移植(HSCT)过程中,由于预防和治疗性抗生素、肠道炎症和饮食变化,IM 多样性显著降低,可引起疼痛、恶心呕吐和腹泻。患者HSCT 后主要导致消化道症状腹泻的原因较多,包括消化道黏膜炎、重度血细胞减少相关感染、GVHD 等。HSCT 过程中,预处理及使用预防性抗生素,机体原有肠道菌群构成发生改变,共生菌减少、菌群多样性减少,造成微生态失衡或菌群易位。随着宏基因组学、转录组学、蛋白质组学、代谢组学等组学技术飞速发展,肠道菌群已被证实在肠道稳态和免疫调节中起至关重要作用,是接受allo-HSCT 患者临床结局的预测指标[21-23]。
4.1 移植前预处理引起IM 失调
移植前预处理包括大剂量化疗方案(如白消安/环磷酰胺方案)以及带有全身照射的方案(如环磷酰胺/全身照射方案)易损伤肠黏膜上皮细胞,使肠黏膜屏障功能受损。大剂量化放疗抑制机体细胞免疫及体液免疫功能,导致免疫调控异常,通过促进细菌转位和全身炎症反应,增加患者感染风险,改变肠道菌群组成从而发生菌群失调,肠道菌群易穿透受损肠黏膜,引起异常免疫反应,活化T 淋巴细胞,促进炎症介质释放,造成胃肠黏膜屏障受损,从而损伤胃肠道等靶器官[24-25]。预处理化疗过程中,化疗药物和预防性抗生素的使用,使肠道菌群的多样性和稳定性遭到破坏,造成肠道原有菌群失衡或菌群易位,甚至出现细菌肠道支配。肠道菌群中占支配地位的细菌包括短链脂肪酸的产生菌(如芽孢杆菌、布鲁氏菌等)和专门发酵寡糖的菌种(如双歧杆菌等)。临床上,肠道内各种微生物群的定植或易位常先于感染发生,是引起菌血症和脓毒血症常见原因之一[26]。
4.2 抗生素应用与移植后CDI
系统性使用广谱抗生素常用于allo-HSCT 中治疗感染性并发症,早期使用抗生素治疗可能会抑制肠道菌群中保护性梭菌,但在停止抗生素治疗后能迅速恢复微生物群多样性。allo-HSCT 中出现中性粒细胞缺乏伴发热时接受抗厌氧菌抗生素(如哌拉西林他唑巴坦或碳青霉烯)与仅接受极少量抗生素患者之间的GVHD 发生率及死亡率均增加,使用抗厌氧菌抗生素会致肠道菌群多样性水平降低,尤其双歧杆菌和梭状芽胞杆菌丰度降低。接受allo-HSCT 患者中常见感染病原体是革兰阴性菌(肠杆菌科)和革兰阳性菌(葡萄球菌属),识别和监测患者中此类病原体有助于合理选择抗生素。艰难梭菌是一种常见肠道感染病原体,约1/3 移植患者发生CDI 是由于广谱抗生素的使用影响了肠道固有菌群,尤其是对梭状芽孢杆菌的抑制。在allo-HSCT 时预防性和治疗性使用抗生素会影响肠道菌群多样性,进而增加耐药菌感染风险[27]。CDI是allo-HSCT 后非常见并发症之一,CDI 除可引起局部炎症反应,是发生GVHD 的启动因素。这是因为CDI 可促使肠黏膜释放细胞因子和促进内毒素转运、主要组织相容性复合体表达和免疫共刺激分子上调,从而激活移植物中供者T 淋巴细胞释放更多炎性因子,形成细胞因子风暴,诱使GVHD 发生。因此,CDI患者,即使病情轻微也应积极处理,防止GVHD 发生而使病情复杂化。可考虑使用益生菌纠正IM 失衡以预防CDI[28]。
5 IM 技术在allo-HSCT 中应用
肠道菌群失衡可导致allo-HSCT 患者合并感染、疾病复发、GVHD 并可能延迟免疫重建,缩短总体生存期。allo-HSCT 过程中的各个环节及因素均可能影响到肠道菌群的多样性。改善allo-HSCT 后肠道菌群的策略主要包括调整抗生素、使用益生菌或益生元、FMT 等[29-30]。
5.1 益生菌使用
allo-HSCT 后使用抗生素杀灭致病菌同时会造成人体正常微生物群伤害,导致微生物物种和菌株多样性丧失,且不同抗生素对微生物群造成的影响不同,其中广谱抗生素影响最大,会引起微生物群多样性的长期匮乏,应尽量选择窄谱抗生素,同时减少抗生素的使用时间,以保护allo-HSCT 后肠道环境。益生菌策略包括直接注入胃肠道内一种或多种有益微生物菌株,可通过经结肠镜或保留灌肠实施。益生元是难消化化合物,通常是低聚糖,在影响共生细菌代谢方面具优势。益生元可口服或给予胃内营养补充。应用益生元可能减轻allo-HSCT 患者的黏膜损伤并缓解GVHD。患者可在移植前的肠道准备开始至移植造血重建后口服益生元混合物,可能会减轻胃肠道黏膜的损伤,降低急性GVHD 等级和发生率,同时降低皮肤急性GVHD累积发生率。通过益生元摄入可保留产生丁酸盐的细菌种群,维持肠道菌群多样性。
5.2 急性胃肠道GVHD 诊治
GVHD 指由异基因供者细胞与受者组织发生反应导致的临床综合征,经典急性GVHD 一般指发生在移植后100 天以内,且主要表现为皮肤、胃肠道和肝脏等器官的炎性反应。胃肠道是急性GVHD 常见的靶器官,上消化道和下消化道均可累及,上消化道急性GVHD 主要表现为厌食消瘦、恶心呕吐,下消化道急性GVHD 表现为水样腹泻、腹痛、便血和肠梗阻,下消化道急性GVHD 与移植后非复发相关死亡密切相关。一线治疗为糖皮质激素,最常用甲泼尼龙,起始剂量1~2 mg/kg/d,控制后缓慢减少糖皮质激素用量,一般每5~7 天减量甲泼尼龙10~20 mg/d,4 周减至初始量的10%。若判断为糖皮质激素耐药,需加用二线药物,并减停糖皮质激素,如判断为糖皮质激素依赖,二线药物起效后减停糖皮质激素。二线治疗原则上在维持环孢素A 有效浓度基础上加用二线药物如抗白细胞介素2 受体单抗、芦可替尼等,其他药物和治疗包括甲氨蝶呤、霉酚酸酯、他克莫司、西罗莫司、抗人胸腺淋巴细胞球蛋白、间充质干细胞、FMT 等[31-32]。
6 FMT 技术
FMT 是重建IM 的有效方法,是指将健康人粪便中的功能菌群处理以后移植到患者肠道内,重建新的肠道菌群,恢复肠道菌群的多样性,实现肠道内外疾病的治疗[33]。其途径包括经口服粪菌胶囊,经鼻胃管、鼻空肠管、胃十二指肠镜、肠镜及造瘘口给予粪菌悬液等,新的FMT 途径经内镜结肠植管通过普通肠镜检查至回盲部,沿活检孔插入经内镜结肠植管将粪菌悬液送入导管至回盲部,这种新的移植途径相比于传统的移植途径,更加简单经济,并且可以全结肠给药,方便短期内多次重复的治疗[34]。FMT 制备和质控流程见图5。
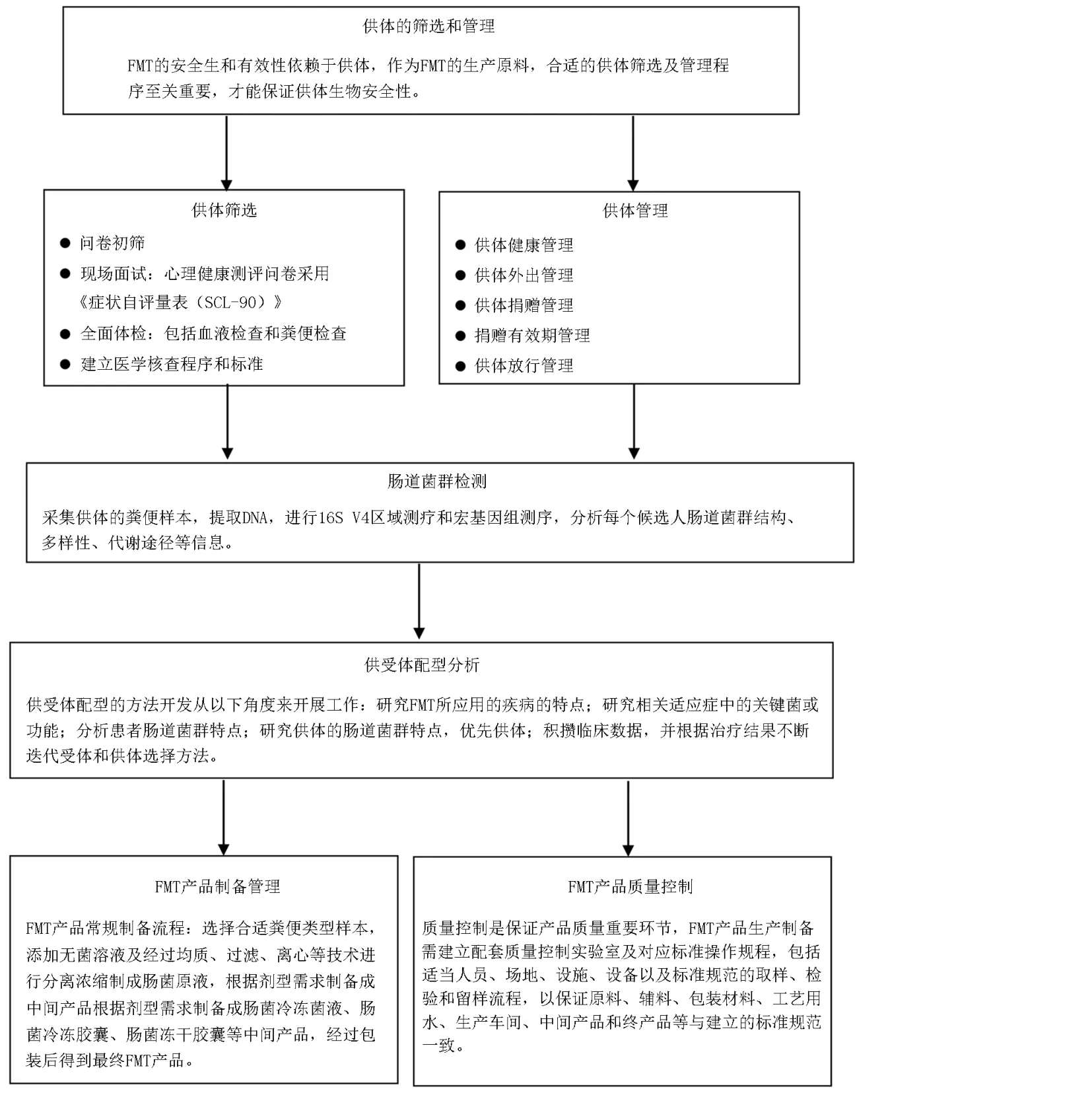
图5 FMT 制备和质控流程图
6.1 供体的筛选和管理
FMT 的安全性和有效性依赖于供体,作为FMT的生产原料,合适的供体筛选及管理程序至关重要,这样才能保证供体生物安全性。在供体筛选及管理的过程中会涉及候选人/供体的隐私信息,需要对候选人进行知情同意、信息脱敏、筛选和对供体进行管理。供体筛选是一个非常严格的过程,包括问卷初筛、现场面试、全面体检和医学核查4 个阶段,一般选择青年供体,这样才能使供体的功能状态和身心健康得到保障。为了保证FMT 的安全性,供体的筛选需要有严格的标准,需要同时兼顾供体的健康状况、依从性以及供体肠道菌群的多样性和稳定性[35]。供体的健康至关重要,需保证供体无感染性疾病或任何可能在FMT 中传染给受体的病毒或致病菌。供体管理的流程包含供体健康管理、外出管理,捐赠管理、捐赠有效期管理、放行管理等。为了及时且持续地掌握供体的健康状态,应设置定期回访健康管理机制。供体协调员应每周定期和供体沟通确认,了解供体近1 周的身体健康状况。向供体强调有任何身体不适都需要及时告知。对于处于非健康状态的供体,需根据对应情况和筛选标准,安排供体复检或淘汰。
6.2 肠道菌群检测
肠道菌群检测的结果可用于指导FMT 的实施,FMT 效果往往是由疾病特点,供体和患者的生理状态及菌群特点决定的。另外,即便被诊断为同一种疾病,不同患者可能具有不同的发病机制和特征。因此,根据疾病特点选择菌群相匹配的供体与患者,有助于最大化提升FMT 的治疗效果[36]。目前,普遍接受的肠道菌群检测,是对粪便样本中的肠道菌群进行DNA 检测。对于供体肠道菌群的了解,需要采集供体的粪便样本,提取DNA,进行16S V4 区域测序和宏基因组测序,分析每个候选人肠道菌群结构、多样性、代谢途径等信息。16S rRNA 检测成本较低,需要的DNA 含量较少,且分析流程较为简单,但是能够从数据中获取的信息也比较有限,其仅能深入到细菌的属水平,无法检测菌种水平以及细菌以外的微生物;无基因功能信息,仅能基于算法模型和公共数据库对菌的功能进行粗略的预测。宏基因组测序成本较高,所需DNA 含量略多,分析流程复杂且对计算资源要求较高,但是能够从样本中获取丰富的信息。
6.3 供受体配型
FMT 通过对患者的肠道微生态重建以达到对疾病的治疗和改善。由于其成分复杂且高度依赖于供体捐赠的样本,FMT 在各个适应证里的作用机制和实现的效果并不相同。提升FMT 的治疗效果,可以从供体以及患者两个方面切入,寻求两者的最佳组配。可以根据疾病特有的IM 特点以及菌-宿主的作用模式来挑选有效供体的菌或代谢物的指标[37],或构建预测模型寻找匹配最优的供体和患者,构建包含多个维度的微生物特征(如alpha 多样性、群落距离、有益菌、有害菌、有益代谢通路以及有害代谢通路)在内的预测模型[38],供受体配型的方法开发,研究FMT 所应用的疾病特点,同时还应考虑,该疾病是因为某些病原菌感染导致的,还是因为肠屏障受损引发,或是体内的免疫、代谢或神经递质失衡引起的;是否具有细分的疾病亚型,这些亚型是否对应不同的FMT 干预效果。另外,可以针对相关适应证中的关键菌或功能进行研究,如关键菌是参与短链脂肪酸的生成,改善肠屏障,还是调控糖脂代谢、线粒体功能,或作用于特定的免疫细胞;也需注意相关适应证是否有菌的产物或营养物质代谢相关的基因功能指标。研究供体的肠道菌群特点,从供体的基础指标(年龄、性别、BMI、饮食特点等)和菌的特征及菌群结构稳定性等角度优选最有可能产生效果的供体;不断累积临床数据,并根据治疗结果不断迭代受体和供体选择方法。供体和受体特定菌种不同菌株的相容性以及供体特定菌株的定植也可纳入考察并指导对受体和供体的选择[39-40]。
中国抗癌协会肿瘤与微生态专业委员会指南编委会主任委员:
谭晓华 深圳市第三人民医院
副主任委员:
王 强 武汉科技大学医学院
于 君 香港中文大学医学院
张发明 南京医科大学第二附属医院
任 军 复旦大学附属浦东医院
郭 智 华中科技大学协和深圳医院
委员(以姓氏拼音排序):
安江宏 深圳市第三人民医院
陈 丰 华中科技大学同济医学院附属武汉中心医院
陈 鹏 解放军总医院第五医学中心
邓丽娟 北京大学肿瘤医院
邓启文 华中科技大学协和深圳医院
付 广 武汉科技大学附属普仁医院
黄自明 湖北省妇幼保健院
黄慧强 中山大学附属肿瘤医院
胡伟国 武汉大学人民医院
李小安 绵阳市中心医院
李志铭 中山大学附属肿瘤医院
梁 婧 山东第一医科大学第一附属医院
刘 智 华中科技大学生命科学与技术学院
刘 哲 天津大学医学部
孟景晔 深圳市第三人民医院
皮国良 湖北省肿瘤医院
乔明强 山西大学生命科学学院
祁小飞 苏州大学附属第一医院
任 骅 中国医学科学院肿瘤医院
邵 亮 武汉大学中南医院
沈鹤霄 华中科技大学生命科学与技术学院
舒 榕 湖北省第三人民医院
孙志强 南方医科大学深圳医院
唐菲菲 北京大学人民医院
王 华 中山大学附属肿瘤医院
王 亮 首都医科大学附属北京同仁医院
王 钧 香港大学深圳医院
吴清明 武汉科技大学医学院
吴 为 广东省公共卫生研究院
解 奇 山东第一医科大学第一附属医院
夏忠军 中山大学附属肿瘤医院
许晓军 中山大学附属第七医院
杨文燕 山东第一医科大学
殷 茜 华中科技大学同济医学院附属同济医院
张利玲 华中科技大学同济医学院附属协和医院
张幸鼎 中山大学医学院
张 钰 南方医科大学南方医院
朱宝利 中国科学院微生物研究所
朱艳丽 新乡医学院第一附属医院
周 浩 华中科技大学同济医学院附属协和医院
周 辉 湖南省肿瘤医院
执笔人:
郭 智 华中科技大学协和深圳医院
王 钧 香港大学深圳医院
王 强 武汉科技大学医学院
本文无影响其科学性与可信度的经济利益冲突。
