基于真实世界数据的食管鳞癌在新辅助治疗联合PD-1/PD-L1 抑制剂的安全性及疗效分析
2023-11-14马敏婷温小多田子强何明靳晶代鹏郭斌
马敏婷 温小多 田子强 何明 靳晶 代鹏 郭斌
食管癌是一种常见的消化道恶性肿瘤。根据最新数据统计结果,食管癌的年发病率60 万余例,占所有新发癌种的3.1%;年死亡率达到54 万余例,占所有死亡癌种的5.5%。东亚地区男性和女性的区域发病率最高,部分是因为中国人在食管癌的疾病负担重所致[1]。中国是食管癌大国,根据统计我国2015 年食管癌发病24.6 万例,居恶性肿瘤发病率第6 位;死亡18.8 万例,居恶性肿瘤死亡率第4 位[2]。自20 世纪80 年代应用新辅助治疗以来,通过减轻局部肿瘤负担,从而使得部分局部晚期的患者获得手术机会,同时增加了显微镜下无残留切除(R0)的可能性,降低了局部或区域复发的风险。早期实体瘤的新辅助治疗近些年正在食管癌的治疗中迅速开展,但是关于治疗反应、后续手术、预后及生存率的数据明显滞后,特别是在真实世界的数据仍然比较少[3]。
围手术期治疗后联合手术的治疗推荐在美国国立癌症网络(NCCN)指南和中国临床肿瘤学(CSCO)指南均为1 级推荐[4-5]。新辅助治疗可改善局部晚期食管鳞癌患者的术后生存、局部控制率及手术切除率[6]。多数食管癌确诊时为局部晚期食管癌,局部晚期食管癌是指肿瘤侵犯局部结构或累及区域淋巴结,但无远处转移,即美国癌症联合委员会(AJCC)分期≥T2 或 N+、M0[7]。单独行手术切除的局部晚期食管癌的总体预后较差,尤其是鳞状细胞癌,既往有较多关于新辅助治疗食管癌的研究,CROSS 研究奠定了新辅助放化疗的地位,且获益至少持续10 年[8-9]。
虽然多年来同步放化疗已成为局部晚期食管恶性肿瘤的标准诊疗模式,但因其较低的患者耐受度、较大的手术难度及较多的术后并发症导致其无法广泛应用。随着近些年免疫治疗的出现,食管癌免疫治疗的使用已经在一线受到广泛推荐[10-11]。免疫治疗在局部晚期食管癌的围手术期治疗的探索仍在广泛开展,尚缺乏术前新辅助治疗的共识,特别是在新辅助方案的选择、治疗周期数及治疗结束到手术的时间间隔,以及免疫检查点以抑制剂作为新辅助治疗的安全性、并发症等尚缺乏大型临床研究。
本研究为回顾性研究,旨在探索真实世界中局部晚期食管鳞癌在新辅助化疗联合免疫治疗后行根治性手术治疗的病理缓解率、生存状况及安全性。以期为免疫检查点抑制剂在食管癌新辅助治疗中的应用提供更多的治疗依据。
1 材料与方法
1.1 临床资料
本研究回顾性分析2020 年3 月至2021 年8 月就诊于河北医科大学第四医院,经病理证实为食管鳞癌的局部晚期患者,经胸外科、肿瘤内科医师评估建议行新辅助治联合免疫检查点抑制剂,后经影像评估后行手术治疗,共纳入患者152 例。本研究经河北医科大学第四医院伦理委员会审核批准通过(伦理批号:2021KY242)。
本研究收集了病理诊断为食管鳞状细胞癌,患者至少接受1 个周期的标准化疗联合程序性细胞死亡因子-1/配体-1(programmed death-1/programmed cell death-ligand 1,PD-1/PD-L1)抑制剂的新辅助治疗,并均已接受规范的食管癌根治手术,具有完善的临床信息的患者。入组标准:1)经内镜检查病理组织证实为食管鳞癌患者;2)所有患者均经外科医生评估,考虑手术风险高,建议先行新辅助化疗联合免疫治疗;3)新辅助治疗后评估可行手术治疗;4)并接受包括MIE、Sweet 术式、Lvor-Lewis 术式、机器人MIE 术式;5)患者治疗情况、临床病理特征、术后并发症等资料完整。排除标准:新辅助治疗后进展未接受手术治疗患者。新辅助治疗中无PD-1/PD-L1 抑制剂。
1.2 方法
评价标准:食管癌的疗效分级系统宜采用美国病理学家协会(CAP)/NCCN 指南的标准,肿瘤退宿分级分为:0 级(完全反应,无存活癌细胞),1 级(中度反应,单个或小簇癌细胞残留),2 级(轻度反应,残留癌灶伴间质纤维化),3 级(反应不良,少数或无肿瘤细胞消退,大量癌细胞残留)。R0 切除是指将肿瘤完整地切除,且在手术切缘组织中未发现癌细胞。围手术期并发症指手术日到术后30 天发生的与手术直接或间接相关的并发症,手术并发症分级按照Clavien-Dindo 评价标准。
随访方法:术后2 年内,通过住院病历系统,门诊就诊记录以及电话,收集患者的术后病理资料,围术期并发症,以及生存资料。
1.3 统计学分析
采用SPSS 23.0 软件进行统计学分析。计数资料以百分数表示,采用频次、频率等进行描述性分析,并用交叉表格的χ2检验比较差异不同组别的频率差异。计量资料采用进行统计描述,不同组别的差异采用独立样本t检验、单因素ANOVA 方差分析或非参数检验比较组别之间的差异。采用Kaplan-Meier 法绘制生存曲线,进行DFS 分析。以P<0.05 为差异具有统计学意义。
2 结果
2.1 一般临床特征
共收集了2020 年3 月至2021 年8 月期间接受了新辅助治疗的450 例患者,其中160 例患者为化疗联合免治疗,后有8 例患者新辅助治疗后出现进展未行手术治疗,最后共有152 例患者入组。其中男性102 例(67.1%),女性有50 例(32.9%),年龄43~80 岁,平均年龄(64.4±6.5)岁。以65 岁为界,≥65 岁的患者为85 例(55.9%),<65 岁以下的患者总数67例(44.1%)。肿瘤的发病位置以胸中断最多,占比58.6%,胸上段和胸下段的占比分别为8.5%和32.9%(表1)。

表1 入组患者的一般临床特征
2.2 新辅助治疗相关情况
关于新辅助治疗周期数情况,新辅助化免周期数为1 个周期的患者占7.9%(12/152),2 个周期的患者67.8%(103/152),3 个周期19.0%(29/152),4 个周期4.6%(7/152),5 个周期仅为0.7%(1/152)。142 例患者术前应用的化疗及免疫周期数相同,占所有患者93.4%。仅有少数患者两种治疗手段周期数有差异,2%的患者免疫周期数比化疗周期数多1 次,4.6%患者化疗周期数比免疫周期数多1 次。无患者接受单纯免疫治疗和同步放化疗。98%(149/152)的患者化疗方案为含铂双药化疗联合免疫药物,仅有3 例患者为单药化疗药物联合免疫药物治疗。80.3%(122/152)的患者应用白蛋白结合型紫衫醇,有2 例患者为联合口服抗血管生成药物,如甲磺酸阿帕替尼、安罗替尼。免疫检查点抑制剂为PD-1/PD-L1,150 例患者新辅助治疗期间应用PD-1 单抗,仅有2 例患者应用PD-L1单抗(度伐利尤单抗)。83.6%(127/152)的患者未出现免疫相关不良反应,仅有16.4%出现新辅助治疗相关不良反应;3.9%(6/152)出现免疫相关肺炎。6.6%(10/152)的患者出现免疫相关甲状腺功能异常。8 例患者出现骨髓抑制,其中有4 例为Ⅳ度骨髓抑制。其中有1 例患者出现心脏毒性4 级且合并肝、肌肉毒性3 级。1 例患者乏力、不明原因意识丧失、周围神经麻痹,免疫相关不良反应≥3 级发生率0.66%,在免疫相关不良反应中,有6 例患者同时发生至少2 种系统的免疫相关不良事件。术后辅助治疗情况:仅有19 例患者术后按计划开始并完成术后辅助治疗。
2.3 手术及术后情况
MIE 术式患者占66.4%(101/152),Sweet 术式患者占25%(38/152),Lvor-Lewis 术式患者占5.3%(8/152),机器人MIE 术式患者占3.3%(5/152)。手术平均值时长为(325.3±84.5)min,手术最短时间为133 min,手术最长时间为620 min。中转开胸手术的2 例,合并其他脏器切除的4 例,合并颈部淋巴结清扫的1 例。手术平均出血量情况为(180.4±143.0)mL,手术总引流量平均为(2 456.8±3 908.2)mL。R0 切除143 例,占94.1%。住院平均天数为(20.8±11.6)天。
术后并发症中2 例患者合并出现骨髓抑制,均表现为术后。全部患者中75%(114/152)无术后并发症,占25% 患者出现术后并发症,包括吻合口瘘、肺炎、乳糜胸、气管瘘、喉反神经损伤、二次开胸及其他少见并发症。其中吻合口瘘的患者占7.8%(12/152),肺炎患者占9.2%(14/152),包括1 例间质性肺炎。术后出现声带麻痹患者为3 例,占2%,其中2 例患者行气管切开。3 例患者出现二次非计划手术,2 例因为乳糜胸开胸,1 例为腹腔出血开腹。
2.4 术后病理及无病生存率情况
新辅助化疗联合免疫治疗结束至手术的(平均时间±标准差)为(45.99 ±18.087)天,最短时间24 天,最长时间122 天。术后病理评估发现肿瘤退缩分级0级的患者占29.6%(45/152),1 级占11.2%(17/152),2级占25.7%(39/152),3 级占33.5%(51/152),新辅助治化疗联合免疫患者pCR 率达25%(38 例),主要病理缓解率高达40.8%。术前cTNM 分期情况:Ⅰ期1 例,Ⅱ期60 例,Ⅲ期54 例,Ⅳ期37 例。术后pTNM 分期情况:0 期38 例,Ⅰb 期22 例,Ⅱa 期13 例,Ⅱb 期32 例,Ⅲa 期11 例,Ⅲb 期26 例,Ⅳa 期10 例。术后降期率62.5%(表2)。
在20世纪70年代,赛义德的《东方主义》详细解释了“西方中心”下的东方话语。他认为在西方,大部分学者对于东方的了解不多,只能根据相关资料而形成一定的东方想象。因此,从某种意义上讲,“西方中心”下的东方话语也仅仅是一种被扭曲变形的想象,不具备真实性。另外,赛义德认为,西方的现实主义小说往往将西方国家作为正面,而将东方国家作为负面。但是,福斯特在《印度之行》这部作品中始终站在印度人民的角度进行描写,将西方国家作为负面。他在小说中以菲尔丁这一形象出现,其为印英友好关系的维持者。他在小说中也极力抨击以治安法官斯洛普为代表的殖民主义者,这些情节一定程度上展现了福斯特的立场——始终无条件支持印度人民。

表2 新辅助治疗后的疗效评估分布特征
术前免疫周期数为2~3 次的患者在术后CAP分级0~2 级93 例(70.5%),然而在1 个周期和≥4 个周期的患者中,CAP 分级0~2 级仅有8 例。CAP 分级0~1 级62 例(47.0%),0 级45 例(34.1%),1 级17例(12.9%),其中免疫治疗2~3 个周期的患者为58 例,远高于1 和≥4 个周期的患者(n=4)比例。CAP 分级0~1 级患者在治疗周期数为2~3 次的比例明显增高(P=0.007,表3),同样CAP 分级0~2 级患者在治疗周期数为2~3 次的比例也明显增高(P=0.042,表4)。可见术前PD-1/PD-L1 药物治疗周期数与疗效关系:术前免疫周期数为2~3 次的患者病理缓解情况更优。因临床研究大多数采用新辅助免疫2~4 个周期,且本项研究纳入的患者应用1 个周期及5 个周期以上患者例数较少,故删除此部分人群后统计共139 例为新辅助免疫治疗2~4 个周期的患者。术前新辅助免疫治疗2、3、4 个周期患者在CAP分级差异无统计学意义(P=0.211),但2、3 个周期的新辅助免疫治疗术后病理在CAP 分级0~2 级的比例较高,分别占77.9% 和20.0%,但差异无统计学意义(P=0.055)。pCR 率在新辅助免疫治疗2、3、4 个周期差异无统计学意义(P=0.103),但2、3 个周期治疗pCR 患者占比达25.2% 和37.9%。在R0 切除方面(P=0.632)、手术降期情况差异无统计学意义(P=0.067)。可见术前新辅助免疫治疗临床常用周期数2、3、4 个周期与疗效关系无差异(表5)。术前应用免疫治疗不同周期数的患者在免疫相关不良反应、术后并发症、R0 切除率、脉管瘤栓、神经受侵情况的差异无统计学意义,与手术时间、引流量、出血量、住院天数也无显著差异。术后90 天无死亡病例。5 例患者术后病理提示脉管瘤栓,5 例患者术后病理提示神经受侵。患者的中位随访时间16.4 个月,1 年DFS 率96.7%,2 年DFS 率87.5%。
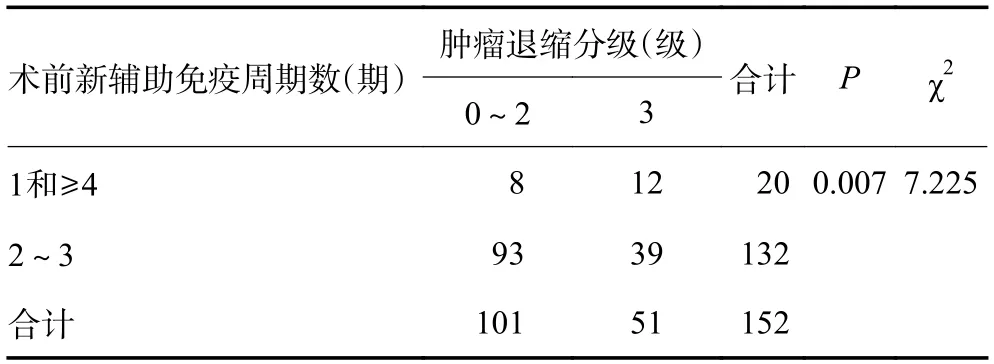
表3 肿瘤退缩分级与新辅助免疫治疗周期数的关系
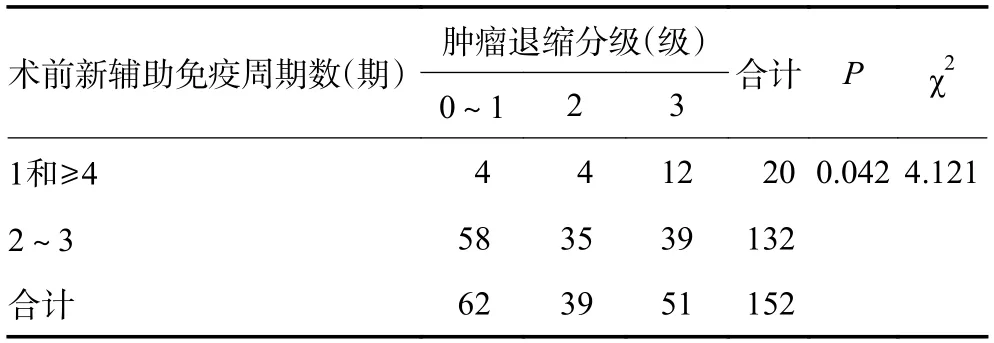
表4 肿瘤退缩分级与新辅助免疫治疗周期数的关系
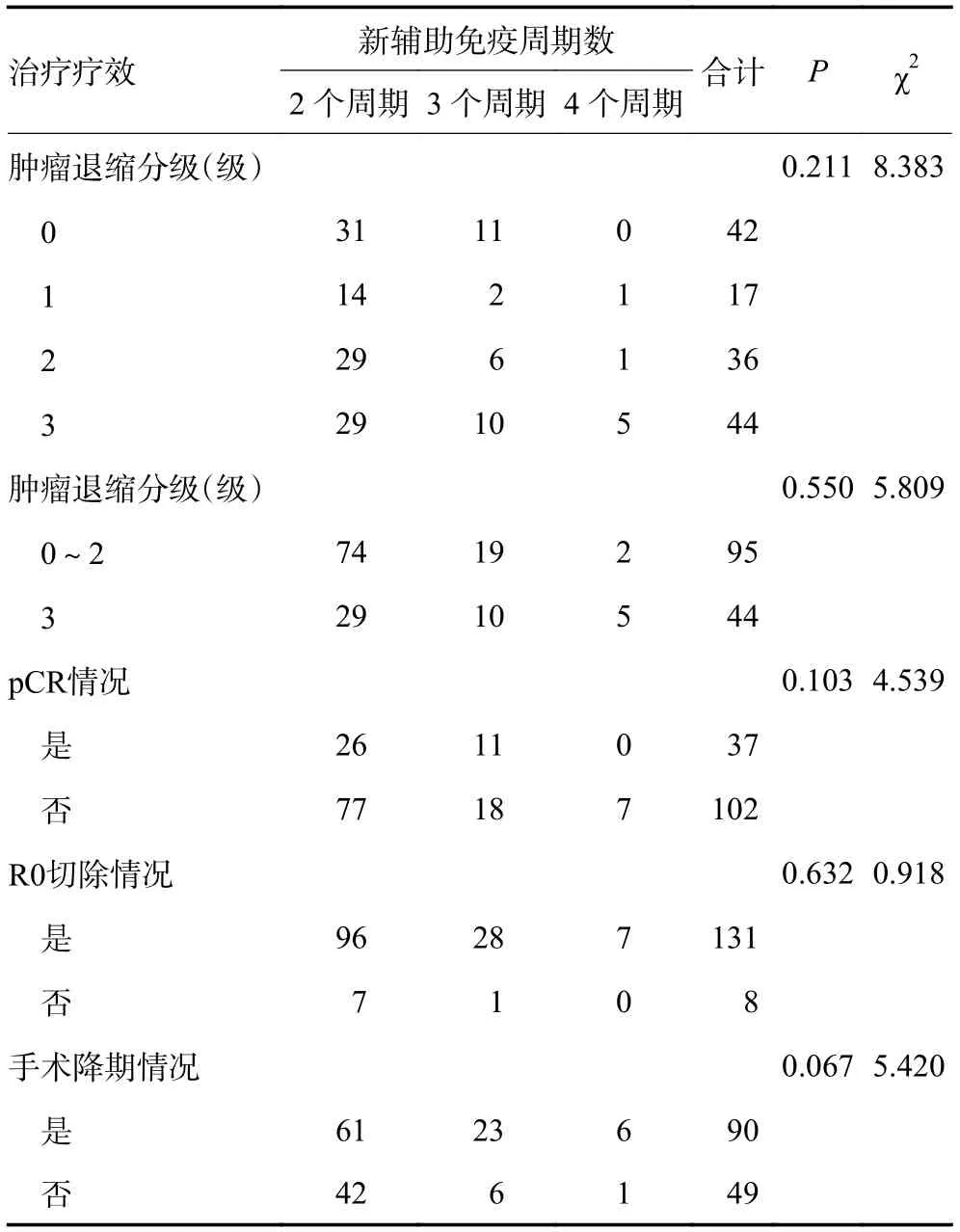
表5 治疗疗效与新辅助免疫治疗周期数的关系
3 讨论
本研究为回顾性研究,能反应真实世界中PD-1/PDL1 在食管癌新辅助治疗的临床结果。有相关研究证实新辅助免疫检查点抑制剂的加入可提高食管鳞癌患者的pCR 率、MPR 率,并不会增加手术并发症[12],免疫治疗已经纳入食管癌的各个时期的治疗实践[13-15]。
早期研究证实新辅助治疗加入免疫检查点抑制剂可提高pCR、MPR 率,最高pCR 率可提高至50%[16-17]。基于本中心的食管鳞癌患者的真实世界数据,接受新辅助免疫治疗后,患者的pCR 率为25%,主要病理缓解率为40.8%,结果虽然与各大型临床研究略有差距,但是也表现出了可观的疗效。尽管病理完全缓解率不及CROSS 研究中的结果,但在安全性及治疗可接纳性方面比新辅助同步放化疗更具有优势。
Depypere 等[18]研究纳入466 例接受新辅助同步放化疗(ncRT)的患者,约32%的患者可以达到pCR,31 例患者为ypT0N+,。尽管患者的pCR 率与本研究的数据接近,此类患者中位生存仅有21.4 个月,远差于ypT0N0 患者的55.2 个月。局部复发率也高达43%,且鳞癌比腺癌在病理完全缓解率上存在显著优势(53.3%vs.18.1%)。
新辅助治疗的疗效与组织病理类型和治疗方案相关。不同新辅助治疗方案的ypT0N0 比例在20.2%~48.8%之间[19-20]。另外,目前新辅助化疗联合免疫治疗术前应用的周期数尚无明确定论。关于局部晚期食管癌术前新辅助免疫治疗的方案设计,有研究推荐免疫联合化疗或化疗模式治疗2~4 个周期[21]。本研究首次回顾性探讨了PD-1/PD-L1 参与下的新辅助治疗周期数与疗效间的关系,发现接受2~3 个周期治疗的患者可能获得更好的病理缓解。本研究结果显示食管鳞癌新辅助治疗化疗联合免疫周期数2、3、4 个周期与术后pCR 率、肿瘤退缩分级、手术降期率无显著差异,目前无远期生存数据。且手术选择的时机可能与患者完成新辅助治疗的周期数有一定相关性需更多数据进一步探索。
本研究中ypT0N+(新辅助治疗后术后病理原发病灶无癌残留,但淋巴结有癌残留)的患者共11 例,新辅助后出现此类病理缓解情况的患者比例不高,目前无大样本的生存数据,但鉴于较差的预后,针对此患者仍有诸多问题亟待解决:1)增加新辅助治疗周期是否能够使得yPT0N+患者降期至ypT0N0(新辅助治疗后术后病理原发病灶及淋巴结无癌残留);2)本研究和既往研究均显示ypT0N+患者阳性淋巴结数量多为1~2 枚,且具有治疗反应。淋巴结清扫范围及技术规范对于精准分期至关重要;3)对于新辅助治疗疗效评价的观测指标如原发病灶病理缓解率是不能充分说明其治疗效果的,如淋巴结的治疗反应、淋巴结降期情况等需加入到评价体系中,这样可从多个观察角度评价新辅助治疗效果,这需要更多研究及数据进一步论证。
综上所述,PD-1/PD-L1 抑制剂在局部晚期食管鳞癌患者的新辅助治疗中安全可行,R0 切除率满意,pCR 率满意。大部分患者术后治疗受限,建议辅助治疗尽可能放到术前。术前2~3 个周期患者可能有更高的病理缓解率。
本文无影响其科学性与可信度的经济利益冲突。
