黑龙江省水稻穗腐病致病菌(Alternaria spp.)的鉴定及生物学特性分析
2023-11-14孙宇佳付忠举靳学慧华丽霞张亚玲
李 雪, 孙宇佳, 刘 瑞, 付忠举, 靳学慧, 华丽霞, 张亚玲
(1.黑龙江八一农垦大学/黑龙江省植物抗性研究中心,黑龙江大庆 163319; 2.四川省农业科学院经济作物育种栽培研究所,四川成都 610300)
水稻穗腐病(rice spikelet rot disease,简称RSRD)是一种由多种真菌引起的水稻穗部病害[1],该病在水稻种植区均有不同程度的发生,严重地块发病率可达100%,受害稻穗结实率下降,千粒质量降低,减产5%~10%,严重可达30%以上,甚至绝收[2]。国内外研究学者认为,造成水稻穗腐病的主要病原菌有多种,如镰孢菌属(Fusariumsp.)、链格孢菌属(Alternariasp.)、弯孢菌属(Curvulariasp.)、蠕孢菌属(Bipolarissp.)[3-6]。张俊华等于2018年对黑龙江省穗腐病病原进行鉴定,从水稻穗腐病样本上分离纯化得到119个菌株,其中链格孢属有112株,认为该菌属为主要致病菌,经ITS鉴定为链格孢[7]。研究表明,不同区域的链格孢属优势致病菌有差异,费丹等将安徽省穗腐病病原菌鉴定为细交链格孢菌[8];胡颂平等将江西省穗腐病病原菌鉴定为细交链格孢菌[9]。
黑龙江省是我国水稻主产区,水稻穗腐病每年都有不同程度的发生,且有逐年加重的趋势。虽然前人研究表明,黑龙江省水稻穗腐病的病原菌主要是以链格孢菌为主[10-11],但前人对链格孢属菌株的鉴定大部分基于形态学鉴定或者是单一菌株的ITS分子鉴定,关于黑龙江省水稻穗腐病致病菌链格孢属的多样性尚未见报道,对于链格孢属致病机制亦研究较少。
有研究报道,当病菌侵染菌丝通过组织的细胞侵入时,会产生一些细胞壁降解酶降解植物组织,使病菌在细胞间迅速扩展,病菌侵入组织后,需要大量的能源,病原菌产生的纤维素酶、淀粉酶、蛋白酶和其他酶类在致病过程中通过分解细胞壁和细胞内含物为病原菌提供了丰富的碳氮源,相关外泌酶在病原菌致病过程中起重要作用[12-13]。本研究旨在分析黑龙江省水稻主产区水稻穗腐病致病菌链格孢属的多样性,明确不同类型链格孢属真菌的生物学特性,同时对各菌株的外泌酶产生情况进行比较分析,以此初步探索链格孢菌属各类菌种的致病机制,为该病的防控提供理论依据。
1 材料与方法
试验于2021年9月至2022年11月于黑龙江八一农垦大学植物抗性研究中心实验室与四川省农业科学院经济作物育种栽培研究所完成。
1.1 试验材料
水稻穗腐病病样采集于黑龙江省水稻主产区建三江科研所水稻实验田、绥化市北林区、庆安县、通河县、绥滨县等5个地区。接种鉴定供试水稻品种为龙粳31。
1.2 病原菌的分离与纯化
采用组织分离法[14]对病原菌进行分离和纯化。采集得到的具有水稻穗腐病症状的稻谷用自来水反复冲洗干净放在滤纸上晾干,将其内外颖壳分离,用灭菌剪刀在病健交界处剪取2 mm×2 mm的病组织,先经乙醇消毒5 s后经漂白粉溶液(水溶液与漂白粉比例为14 mL ∶1 g)浸泡5 min进行表面消毒, 再用无菌水漂洗3次,置于无菌滤纸上吸干水分,呈“品”字形转接于PDA培养基上,于28 ℃在黑暗条件下培养。待菌落长出后,进行初次镜检,用单孢分离法[15]从菌落上挑取单个孢子,移至PDA培养基上进一步培养,将获得的纯化菌株用滤纸片法[16]保存备用。
1.3 病原菌致病性验证
将供试水稻种植于直径为27 cm的花盆内,待水稻长至孕穗期时,制备浓度为1×105个/mL的新鲜孢子悬浮液,使用2 mL的医用注射器将孢悬液注入穗苞上部,直至注射部位有3~5滴菌液溢出[17],接种后的水稻放置于温室内28 ℃保湿培养24 h,光—暗周期为12 h—12 h,对照组注射无菌水。6 d后观察植株发病情况。取发病谷粒,重新分离纯化,将分离纯化得到的菌株与原接种菌株进行形态学比较,验证是否与原接种病原菌相同,从而完成柯赫氏法则验证病原菌的致病性。
1.4 病原菌鉴定
1.4.1 形态鉴定 将菌株接种于PDA培养基上,28 ℃恒温培养5 d后观察菌落形态,用无菌接种刀刮取菌丝,制作临时玻片,使用ECLIPSE 80i显微镜观察各菌株分生孢子形态。
1.4.2 分子生物学鉴定 采用CTAB法[18]提取病原菌的基因组DNA,利用5.8S rDNA核糖体内转录间隔区(internal transcribed spacers,ITS)引物对菌株DNA进行扩增,引物由生工生物工程(上海)股份有限公司合成,引物序列为ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[19]。
扩增体系:正反引物各1.00 μL,9.00 μL ddH2O,1.50 μL DNA 模板,12.50 μL 2×EsTaqMaster Mix (Dye),总体积25.00 μL。
扩增程序:94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃延伸10 min后4 ℃保存。扩增产物送至生工生物工程(上海)股份有限公司测序,将测序结果在NCBI GenBank(https://www.ncbi.nlm.nih.gov/genbank/)中进行BLAST比对。选择相关链格孢种菌株的ITS序列与供试菌株ITS序列作BLASTn对比分析,用MEGA 7.0软件中的Neighbor-Joining(NJ)法构建系统发育树进行系统演化分析,检验重复次数(Bootstrap test)为1 000次。供试菌株的核酸序列数据NMDCN0001CE1-NMDCN0001CE8存储在国家微生物科学数据中心(NMDC),链接为https://nmdc.cn/resource/genomics/sequence/detail/ NMDCXXXX XXXX。根据分析结果确定病原菌的分类学种名。
1.5 链格孢菌属不同菌株的生物学特性分析
1.5.1 测定不同培养基、温度、pH值对菌丝生长的影响 从培养5 d的菌落边缘取直径为5 mm的菌饼,接种于以下条件进行培养:(1) 培养基为马铃薯葡萄糖琼脂(PDA)培养基、马铃薯蔗糖琼脂(PSA)培养基、米糠培养基和查氏(Czapek)培养基,28 ℃恒温培养;(2)温度选用15、20、26、28、30、32 ℃,进行恒温培养;(3)选用pH值为5、6、7、8、9、10、11和12的PDA培养基,28 ℃恒温培养。每个处理重复3次,5 d 后采用十字交叉法[20]测量菌落直径。
1.5.2 测定不同碳、氮源对菌丝生长的影响 以Czapek培养基[21]为基础培养基,将直径为5 mm 的菌饼分别接种于8种不同的碳源培养基:葡萄糖、蔗糖、果糖、麦芽糖、乳糖、可溶性淀粉、甘油、甘露醇及6种不同的氮源培养基:牛肉膏、蛋白胨、尿素、硝酸铵、硝酸钠、氨基乙酸[7],28 ℃恒温培养,每个处理重复3次,测定方法同“1.5.1”节。
1.6 外分泌酶活性检测
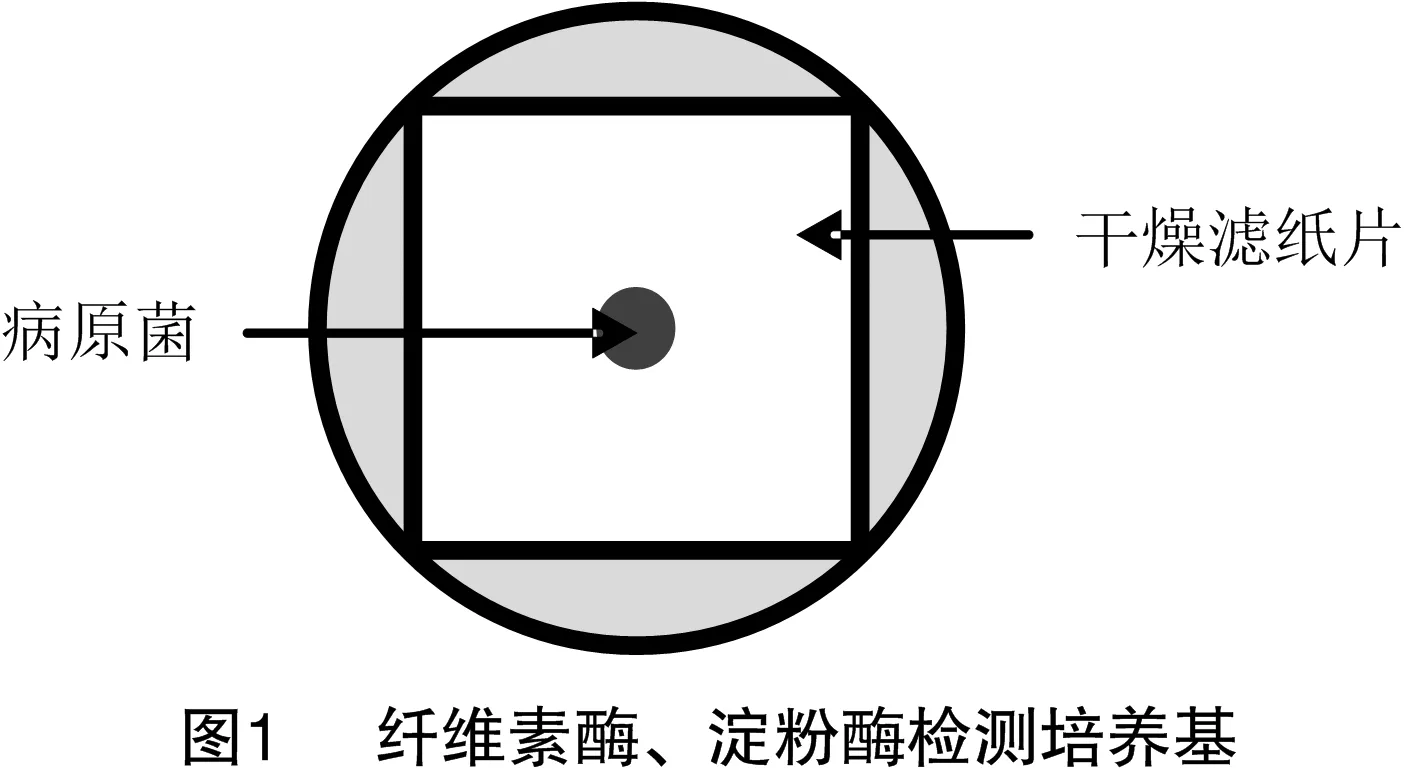
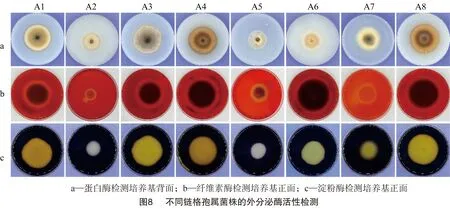
参考贾熙超等的方法[22]将直径为5 mm的菌饼接种于蛋白酶检测培养基上,28 ℃恒温培养,每个处理重复3次,培养3 d,观察是否产生透明水解圈;纤维素酶与淀粉酶的检测分别参考张荷花、蔡鸿杰等的方法[23-24]并在其基础上加以改进,如图1所示在相应检测培养基上铺1层边长为6 cm 的正方形无菌干燥滤纸片,再将直径为5 mm的菌饼接种于滤纸片中心,28 ℃恒温培养,每个处理重复3次,培养3 d,揭掉滤纸片进行染色观察。纤维素酶检测使用0.10%刚果红染液对培养基进行染色,染色 10 min,用1 mol/L NaCL溶液脱色2~3次,观察是否产生黄色透明的水解圈,淀粉酶检测使用碘液进行染色, 观察是否产生明显的水解圈。通过测定水解圈大小与菌落直径的关系,确定各菌株对蛋白质、纤维素和淀粉的分解效率。分解效率=水解圈直径/菌落直径×100%[24]。
2 结果与分析
2.1 病原菌分离与形态比较
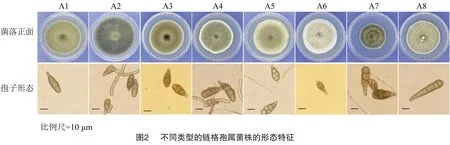
对采集到的39个样本进行分离纯化,共获得181个菌株,根据分生孢子形态鉴定到链格孢属菌株151个,占83.43%。选取其中37个菌株进行形态学比较,根据菌落形态,划分为8个类型,分别记录为 A1~A8。
由图2可知,8个类型的菌株在PDA培养基上菌落生长状态和颜色各不相同,A1为绿色,A2为深棕色,A3为棕色,A4为灰绿色,A5中心浅绿色边缘大部分为白色,A6为白色,A7为深绿色,A8为浅绿色。A1、A2、A3、A6在PDA平板上菌落表面平整,边缘整齐,菌丝埋生;A4、A5、A7、A8在PDA平板上菌落平展,棉絮状,气生菌丝发达;8个类型的分生孢子均为淡褐色或褐色,有横隔和纵隔,在孢子形态上有差异,A1、A2、A3、A4、A5、A6、A7分生孢子呈棍棒状或倒梨形,具有横隔1~6个,纵隔1~5个,分隔处有缢缩,顶端喙状细胞较短,圆柱形或锥形;A8分生孢子呈倒棍棒状,具有横隔4~8个,纵隔 1~4个,横隔分隔处有缢缩,短喙柱形。
2.2 致病力验证
从8个类型中分别选取1个代表性菌株进行致病力验证,接种结果表明,8株分离菌株均可使水稻表现出和田间水稻病害相同或相近的症状(图3),颖壳上有铁锈色圆形或不规则状的斑点。再次分离收集接种感病稻谷,和初次分离纯化病原菌的方法一样。再次分离纯化均得到与初接菌株相同的分离物,符合柯赫氏法则,证实8株分离菌株均为引起水稻穗腐病的致病菌。
2.3 分子生物学鉴定
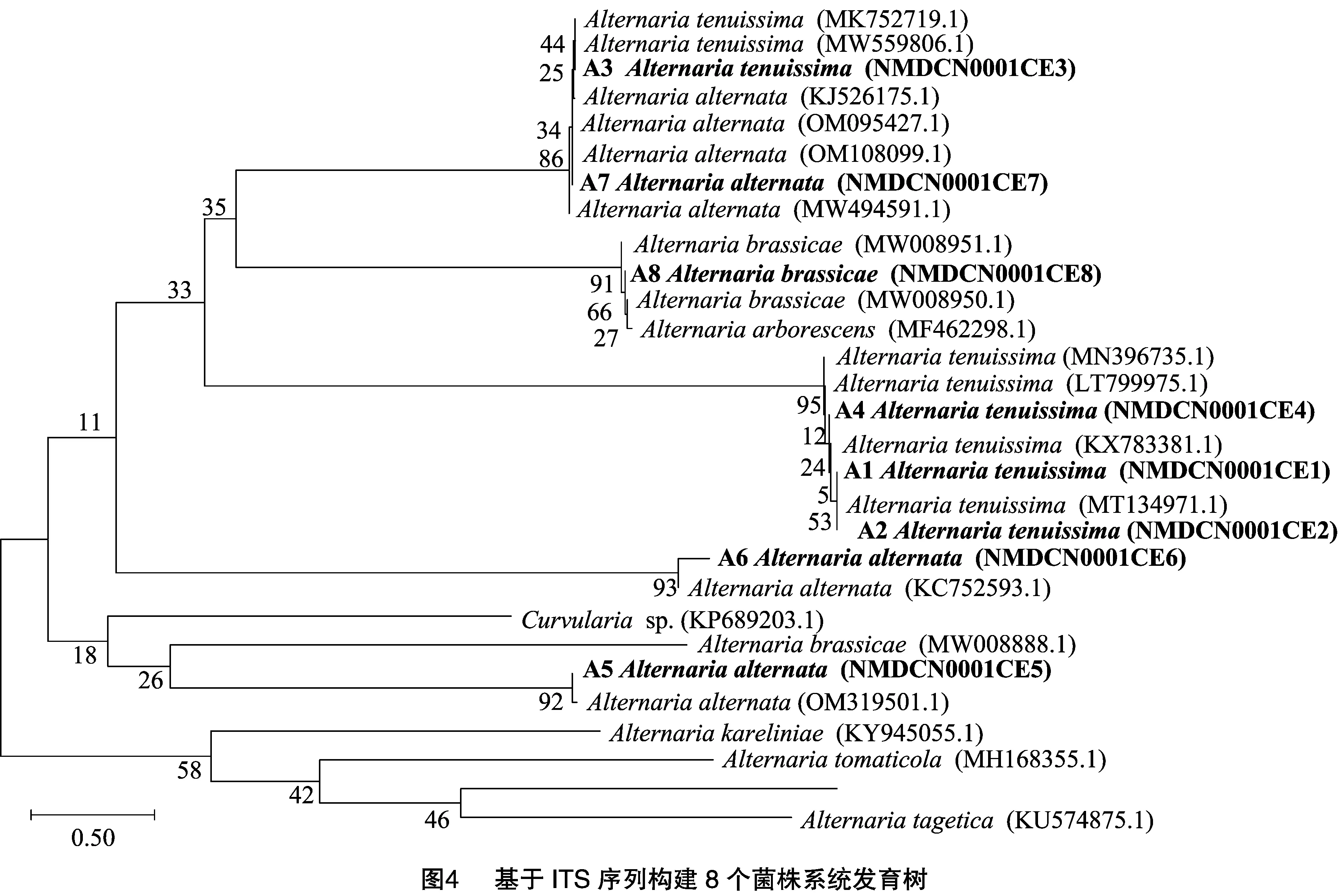
利用真菌通用引物ITS1/ITS4对37个菌株进行分子鉴定,同源性比对结果表明,18个菌株的ITS序列与细交链格孢菌(Alternariatenuissima)同源性高达99.82%,可确定为细交链格孢菌,记为Ⅰ类菌;18个菌株与链格孢菌(Alternariaalternata)同源性高达99.45%,确定为链格孢菌,记为Ⅱ类菌;仅1个菌株与芸薹链格孢菌(Alternariabrassicae)同源性高达100.00%,确定为芸薹链格孢菌,记为Ⅲ类菌。其中,上述接种验证的8个菌株,A1~A4分子鉴定为细交链格孢菌,属于Ⅰ类菌,A5~A7为链格孢菌,属于Ⅱ类菌,A8为芸薹链格孢菌,属于Ⅲ类菌,这8个致病菌与已报道的链格孢菌属的亲缘关系见图4。

2.4 不同类型链格孢属菌株的生物学特性比较
以A1~A8这8个致病菌作为Ⅰ、Ⅱ、Ⅲ类菌的代表菌,比较不同链格孢属菌株的生物学特性。
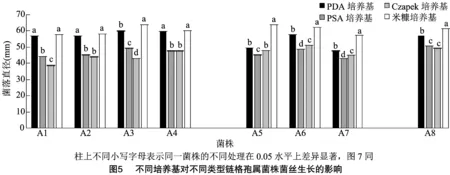
2.4.1 不同培养基、温度、pH值对菌丝生长的影响 Ⅰ、Ⅱ、Ⅲ类菌均能在PDA、米糠、Czapek、PSA等4种培养基上生长,但生长速率不同(图5)。Ⅰ类菌的最适生长培养基为PDA或米糠培养基,在Czapek培养基上的生长速度最慢;Ⅱ类菌和Ⅲ类菌的最适培养基同为米糠培养基,Ⅱ类菌在PSA培养基上菌丝生长最弱;Czapek培养基不利于Ⅲ类菌的菌丝生长。
Ⅰ、Ⅱ、Ⅲ类菌均能在15~32 ℃与pH值范围为5~12时生长,但生长速率有差异(图6)。Ⅰ类菌A1、A2的菌丝最适生长温度为26 ℃,最适pH值为7,A3的最适生长温度范围为26~30 ℃,最适pH值范围为7~10,A4的最适生长温度范围为28~30 ℃,pH值为9;Ⅱ类菌中A5和A7的最适生长温度范围为26~30 ℃,最适pH值分别为7、8,A6、A8的最适生长温度范围同为28~30 ℃,最适pH值范围分别为8~10、8~9。

同一菌种的不同菌株同样存在生物学特性差异(表1)。Ⅰ类菌中的4个菌株在PDA培养基上的生长速度存在显著性差异,Ⅱ类菌中的3个菌株在最优生长培养基米糠培养基上的生长速度也具有显著性差异;在最适生长温度范围26~30 ℃内,Ⅰ类菌的4个菌株在各个温度条件下的生长速度均存在显著性差异,Ⅱ类菌的3个菌株在温度为28、30 ℃时的生长速度存在显著性差异;Ⅰ类菌中的4个菌株在最适生长pH值范围为8~10时的生长速度存在显著性差异,Ⅱ类菌的3个菌株在最适生长pH值范围为7~10时的生长速度存在显著性差异。
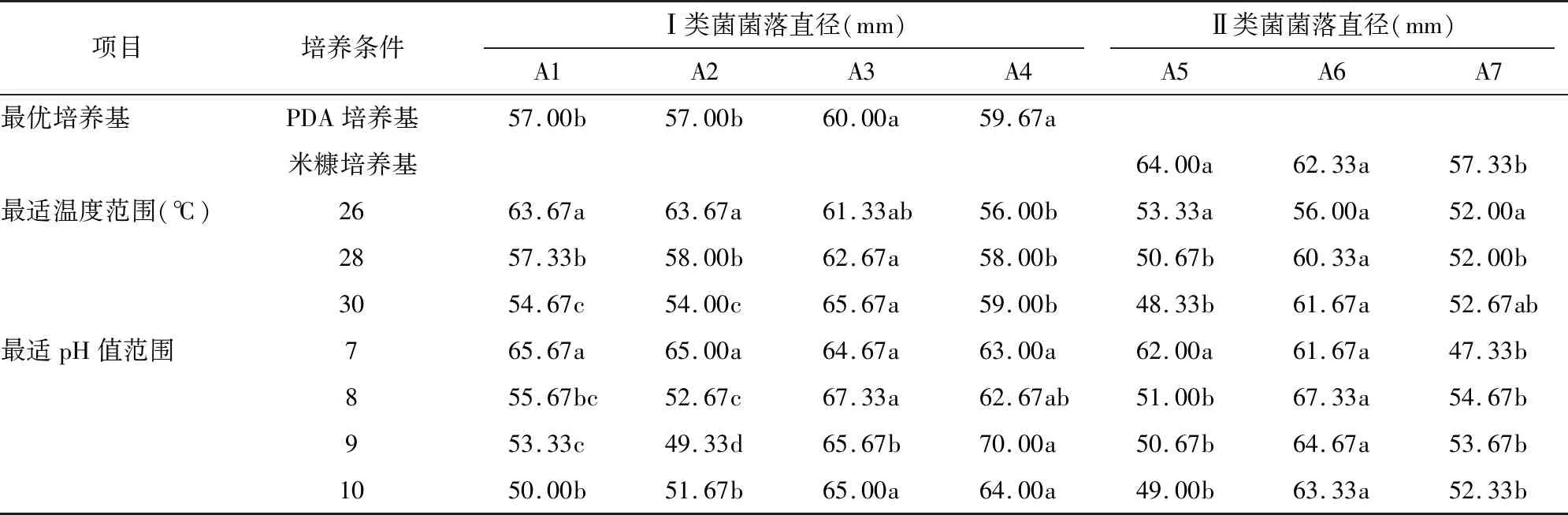
表1 同一菌种不同菌株之间的生物学特性比较
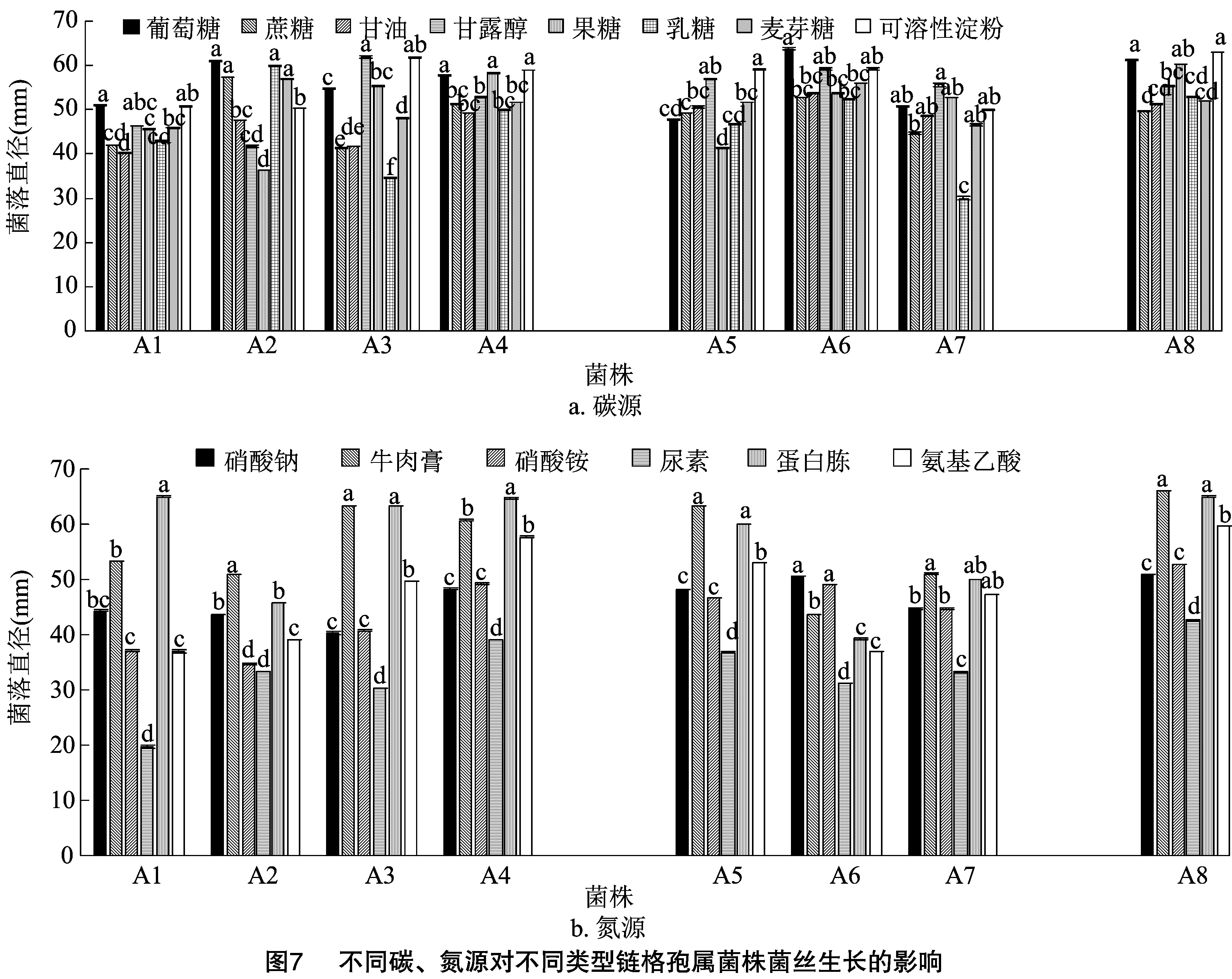
2.4.2 不同碳、氮源对菌丝生长的影响 Ⅰ、Ⅱ、Ⅲ类菌在不同的碳、氮源培养基上均可生长,但生长速率不同(图7),Ⅰ类菌不同菌株对不同碳源的利用效率不同,A1在葡萄糖中生长最快,A2在葡萄糖、蔗糖、乳糖和麦芽糖中生长较快,无显著性差异,A3的最适碳源为甘露醇,A4在葡萄糖、果糖和可溶性淀粉为碳源的培养基上菌丝生长最快,无显著性差异。Ⅱ类菌中A5的最适碳源为可溶性淀粉,A6为葡萄糖、A7为甘露醇。Ⅲ类菌A8在以葡萄糖和可溶性淀粉为碳源的培养基上菌丝生长最快,菌落直径最大。
Ⅰ、Ⅱ、Ⅲ类菌在以尿素为氮源的培养基上生长最差,A6在硝酸钠和硝酸铵为氮源的培养上生长最好,其他菌株以牛肉膏和蛋白胨为氮源的培养基上菌丝生长最好。
2.4.3 外分泌酶检测结果 在蛋白酶、纤维素酶和淀粉酶检测培养基上均观察到透明水解圈的产生(图8),说明Ⅰ、Ⅱ、Ⅲ类菌均能产生蛋白酶、纤维素酶及淀粉酶分解利用蛋白质、纤维素和淀粉。菌株对3类物质分解效率的测定结果(表2)表明,Ⅰ、Ⅱ、Ⅲ类菌对3类物质的分解能力存在差异,其中A1、A3、A5、A8对纤维素的分解效率最强,分别为169.14%、151.15%、165.23%、148.22%;A5对淀粉的分解效率最强,为169.38%,A1最差,为66.04%;A1对蛋白质的分解效率最强,为104.53%,A8最差,为83.19%。
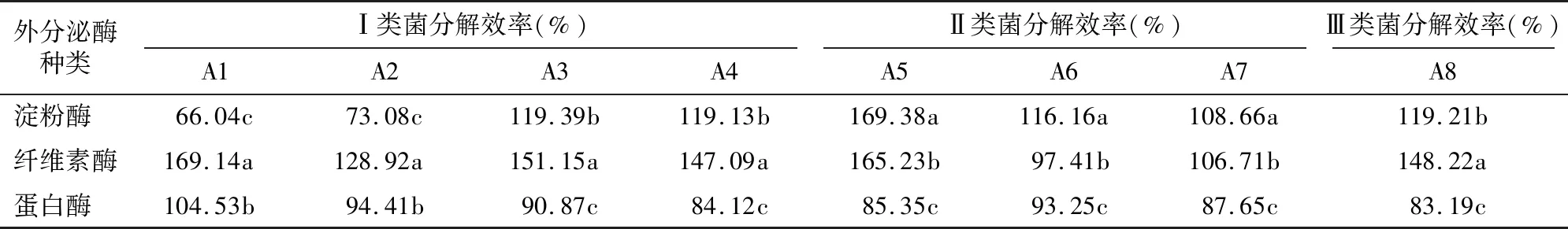
表2 Ⅰ、Ⅱ、Ⅲ类菌产生的外分泌酶的分解效率
3 讨论
链格孢属是引起水稻穗腐病的重要病原物,《中国真菌志 第十六卷 链格孢属》[25]记录有123个种及变种。目前对于链格孢属真菌种的鉴定主要是以形态鉴定为主。本研究在相同条件下分离培养过程中发现8类不同生长状态的菌体,通过孢子形态观察其均符合链格孢属形态特征,用通用引物ITS1/ITS4进行分子鉴定时,将其分为3类, 但是在构建系统发育树时并没有将3类菌完全分在不同分枝上,说明通过核糖体DNA-ITS序列分析来确定链格孢属种间分类是有局限性的。
对于黑龙江省链格孢属真菌引起的穗腐病多认为是由链格孢菌引起的[10],而胡颂平等研究发现新疆省、河南省和江西省水稻穗腐病是由细交链格孢菌引起[9,26-27]。本研究发现引起黑龙江省水稻穗腐病的链格孢属有3种,分别为细交链格孢菌、链格孢菌和芸薹链格孢菌,均是黑龙江省水稻穗腐病的致病菌。其中细交链格孢菌和链格孢菌为该病害主要致病菌,均占链格孢属总数的48.65%,仅分离得到1株芸薹链格孢菌。
本试验将分属于3类不同菌种的8个代表菌株进行生物学特性研究。结果表明,温度、 pH值、培养基和碳、氮源等不同条件对3类菌的菌丝生长均有显著影响。本研究还发现,同一类菌在同一条件下的生长情况不同,如Ⅰ类菌中A3和A4的最适生长温度范围分别为26~30 ℃、28~30 ℃,A1和A2的最适温度为26 ℃,与黄世文等研究的细交链格孢菌最适温度范围为25~28 ℃[2]存在差异。Ⅰ类菌中A3的最适培养基为米糠培养基,其余3个菌株的最适培养基均是PDA和米糠培养基,这暗示着同一菌属的不同菌种生物学特性存在差异。本研究还发现,同一菌种不同菌株在同一类型的培养基中生长速度存在显著差异,且对pH值、温度的需求亦存在差异,暗示着同一菌种不同菌株同样存在生物学特性的差异,然而这种种间以及种内的生物学特性差异是否与致病力有相关性需进一步研究论证。8个菌株的最适碳源为葡萄糖和可溶性淀粉,氮源为牛肉膏和蛋白胨,这与胡颂平等报道的适合细交链格孢菌生长的碳源[9]一致,与其报道的最适氮源存在差异。
在与寄主互作过程中,病原微生物产生的外分泌酶对成功侵染寄主具有重要的作用[28]。纤维素是植物细胞壁的主要成分,是阻碍病原物侵染的第一道屏障[29-32]。淀粉是水稻籽粒重要的营养成份,水稻抽穗后进入灌浆期,这一时期颖壳内会产生大量的淀粉,从而为病原菌提供了良好的营养条件;候恩庆等研究发现,凡是这一时期利用淀粉进行繁殖的植物病原菌,几乎都能使谷粒感病[33]。本研究发现,8个致病菌生长最佳碳源为可溶性淀粉,且均能产生淀粉酶和纤维素酶,这2种酶的产生可能是链格孢属菌株重要的致病机制。本研究发现不同菌株产生的淀粉酶及纤维素酶总量或活性存在显著差异,是否与致病力具有相关性需要进一步通过接种验证。
有趣的是,本研究从水稻穗腐病病样中分离得到1株致病菌芸薹链格孢菌(A8),该菌种为十字花科黑斑病的主要致病菌[34],关于芸薹链格孢菌侵染水稻的报道尚未见报道。A8经淀粉酶活性检测发现能产生淀粉酶分解利用淀粉,这可能是因为芸薹链格孢菌能利用淀粉进行繁殖从而使植株感病,后续将通过分离鉴定更多的链格孢属菌株来验证这一假设。
4 结论
黑龙江省水稻主产区穗腐病的致病菌为链格孢属菌株,其中细交链格孢菌、链格孢菌为优势菌种,均占菌株数量的48.65%,只有1株为芸薹链格孢菌。水稻穗腐病病原菌的菌丝生长受培养基、温度、pH值和碳、氮源的影响,其中温度和碳、氮源的影响较突出。不同的生理小种在不同的碳、氮源培养基上菌丝生长速率存在差异,较适合所有菌株菌丝生长的碳源为葡萄糖和可溶性淀粉,氮源为牛肉膏和蛋白胨。8个菌株均能分泌3种外分泌酶。分析结果表明,链格孢菌属不同菌种存在生物学特性差异,同一菌种的不同菌株也存在生物学特性差异。
