从NLRP3/Caspase-1/GSDMD信号通路探讨健心颗粒对糖尿病心肌病大鼠心肌焦亡的影响
2023-11-14程慧娟陈永忠林倩倩郭进建
程慧娟,陈永忠,林倩倩,郭进建*
(1.福建中医药大学附属第二人民医院,福建 福州 350003;2.福建三博福能脑科医院,福建 福州 350025)
糖尿病心肌病(diabetic cardiomyopathy,DCM)是指糖尿病患者所产生的一种严重心肌疾病,是排除高血压、冠心病、心脏瓣膜病及其他心血管疾病后的特异性心肌结构与功能的异常。患者往往会出现心律失常、心力衰竭、心源性休克甚至猝死,给家庭和社会带来极大危害。有研究表明,DCM 的发生、发展与细胞焦亡关系密切[1-2]。因此,抑制心肌细胞的焦亡可以有效防御DCM 的发生、发展,干预焦亡信号通路将是治疗DCM 的新策略[3]。DCM 属中医学“消渴”“消瘅”“心痛”“心衰”“喘证”等范畴,而现代中医认为,因其兼有“消渴”及“心病”的症状,故可命名为“消渴病心病”。此病属本虚标实,以阴液亏损、气阴两虚为本,日久阴损及阳,并出现血瘀、痰浊、水饮之标实,而且这些邪实可兼见同病,形成痰饮内阻、痰瘀互结、瘀滞饮停等变化。临床研究证实,健心颗粒能改善DCM 患者的左室功能,降低空腹血糖及血浆N 末端B 型利钠肽原(NT-proBNP)水平[4]。既往动物实验研究已表明,可通过调控NLRP3/Caspase-1/GSDMD 通路改善DCM 模型的心肌焦亡和纤维化[5]。本研究通过制备DCM 大鼠模型,观察健心颗粒对大鼠心肌细胞焦亡和NLRP3/Caspase-1/GSDMD信号传导通路的影响。
1 材料与方法
1.1 动物 SPF 级健康雄性SD 大鼠40 只,约6 周龄,体质量(100±20)g,由上海斯莱克实验动物有限公司提供,实验动物生产许可证号:SCXK(沪)2012-0002。所有大鼠饲养于福建省中医药科学院清洁级动物实验中心,实验动物使用许可证号:SYXK(闽)2016-0005。实验过程及方法均符合福建省中医药科学院动物伦理委员会要求(伦理审批号FJATCM-IAEC 2020019)。
1.2 实验药物制备 健心颗粒(福建省第二人民医院院内制剂,批号:Z20100010)组方:黄芪10 g,红参5 g,蒲黄3 g,丹参5 g,猪苓5 g,白术5 g,桂枝3 g,葶苈子5 g;卡托普利片(国药集团汕头金石制药有限公司,25 mg/片,批号:H44024904)。分别将健心颗粒和粉碎后的卡托普利充分溶解于沸水中,蒸发浓缩成含生药浓度为1 g/mL 的药液,放入无菌瓶中密封保存,存于4 ℃冰箱中。
1.3 主要试剂与仪器 ① 主要试剂:链脲佐菌素(美国Sigma 公司,批号:S0130);TUNEL 细胞焦亡试剂盒(武汉博士德公司,批号:MK1015);GSDMD抗体(美国Affinity公司,批号:AF4012);Caspase-1抗体(美国Proteintech 公司,批号:22915-1-ap);抗-GAPDH(美国Proteintech 公司,批号:60004-1-Ig);NLRP3 抗体(批号:A00034-2),白细胞介素-1β(IL-1β)ELISA 试剂盒(批号:MM-0047R1);白细胞介素-18(IL-18)ELISA 试剂盒(批号:MM-0194R1)均购自福州诺敦斯生物科技有限公司。② 主要仪器:酶标仪(芬兰Labsystems Multiskan MS);恒温箱(日本SANYO 公司);琼脂糖水平电泳仪(北京六一生物科技有限公司);冷冻离心机(广州吉迪仪器有限公司);qPCR 仪(鲲鹏基因科技有限责任公司);漩涡混合器(福州康和尔生物科技有限公司)。
2 实验方法
2.1 动物模型制备与分组 将40 只SD 雄性大鼠按照随机数字表法分为空白组8 只和造模组32 只。空白组不予处理,正常饮食;造模组予高糖高脂饲料喂养8 周后,禁食不禁水10 h 后,一次性腹腔注射链脲佐菌素35 mg/kg,7 d 后尾静脉取血测量血糖值,参考TI 等[6]的诊断标准,如测出空腹血糖≥16.7 mmol/L 则表明糖尿病大鼠模型建立成功,继续以高糖高脂饲料喂养大鼠。参照文献[7]在链脲佐菌素注射后8 周,大鼠心脏体积增大,射血分数降低,心脏出现心肌间质纤维化和左心室扩大,提示DCM 大鼠造模成功并随机分为模型组、西药组、中药组及西药+中药组。
2.2 给药及取材 空白组、模型组均给予生理盐水5 mL,西药组给予卡托普利5 mg/kg,中药组给予健心颗粒3.2 g/kg,西药+中药组给予健心颗粒3.2 g/kg+卡托普利5 mg/kg,早晚各灌胃1 次,共8 周。8 周后,心脏彩超检测后处死各组大鼠,并用3%戊巴比妥钠按35 mg/kg 体质量的剂量腹腔注射麻醉,开腹,取腹主动脉血,取血量约1~2 mL,离心取血清,置于-80 ℃冰箱中保存。随后暴露及剥离大鼠心脏,用生理盐水冲洗,剪去心脏周围组织,并用吸水纸吸干后即刻称重。随后,予刀片沿着大鼠心脏左心室短轴切取相应心肌组织,用PBS 将心肌组织上的血液冲洗干净,按TUNEL、qPCR、Western blot 检测要求将其分成多份,每份约100 mg。做好标记,分别放入4%多聚甲醛溶液中固定,待行常规的脱水、浸蜡和包埋。
2.3 观察指标
2.3.1 心脏彩超检测5 组大鼠左室腔径、室壁厚度及心功能 大鼠麻醉后,脱毛,通过PHILIPS EPIQ 7C 超声成像系统进行心脏彩超检查。测量室间隔厚度(IVST)、左室射血分数(LVEF)、左室舒张末经(LVEDD)、左室收缩末径(LVESD)。
2.3.2 TUNEL 法检测心肌细胞焦亡情况 心肌组织石蜡切片常规脱蜡至水,用蛋白酶K 室温孵育10 min,TBS 洗涤3 次后加入50 μL 的TUNEL 反应混合溶液,置于湿盒中37 ℃孵育2 h,TBS 洗涤3 次;滴加50 μL 转化剂POD,置于湿盒中37℃孵育30 min,TBS 冲洗3 次,之后加入DAB 底物溶液,室温孵育15 min,再经TBS 洗涤3 次;苏木精复染细胞核,用中性树脂封片,高倍显微镜200 倍下分析。
2.3.3 qPCR 检测大鼠心肌组织NLRP3、Caspase-1、GSDMD mRNA 表达水平 提取5 组大鼠心肌组织中总RNA,使用逆转录试剂盒将其反转录并进行cDNA 扩增;继续将荧光染料、cDNA 以及靶标基因上下游引物进行混合,完成实时荧光定量核酸扩增检测。运用2-ΔΔCt法计算目的基因表达水平,引物序列见表1。

表1 PCR 引物序列
2.3.4 Western blot 检测大鼠心肌组织NLRP3、Caspase-1、GSDMD 蛋白表达量 将心肌组织置于研磨管中,添加RIPA裂解液进行研磨,4 ℃下12 000 r/min离心15 min,收集上清液层检测蛋白浓度(BCA 法)。样品经过上样;电泳;转膜(湿转20~30 min);封闭;TBST 洗膜,将膜与稀释的一抗在4℃下孵育过夜;次日,室温孵育稀释的二抗1~2 h。滴加ECL 曝光液于膜上,成像仪内曝光成像,Image-Pro Plus 6.0软件分析条带灰度值。
2.3.5 ELISA 法检测大鼠血清IL-1β、IL-18 的含量 腹主动脉取血,离心取血清,根据试剂盒说明书对各组大鼠血清中IL-1β、IL-18 的含量进行检测。
2.4 统计学方法 使用SPSS 27.0 软件对实验数据进行分析。计量资料符合正态分布的以(±s)表示,组间比较采用单因素方差分析,方差齐时两两比较采用LSD-t法,方差不齐时两两比较采用Games-Howell 分析。P<0.05 为差异有统计学意义。
3 结 果
3.1 5组大鼠IVST、LVEF、LVEDD、LVESD 结果比较 见表2。
表2 5 组大鼠IVST、LVEF、LVEDD、LVESD 结果比较(±s)

表2 5 组大鼠IVST、LVEF、LVEDD、LVESD 结果比较(±s)
注:与空白组比较,1) P<0.05;与模型组比较,2) P<0.05;与西药组比较,3) P<0.05;与中药组比较,4) P<0.05。
LVESD/mm 3.44±0.57 5.66±0.591)4.72±0.632)4.79±0.532)4.16±0.292)3)4)组别空白组模型组西药组中药组西药+中药组n8 8 8 8 8 IVST/mm 2.15±0.30 1.27±0.161)1.60±0.322)1.57±0.272)1.88±0.142)3)4)LVEF/%80.00±5.28 44.96±7.311)53.80±5.612)52.00±3.442)59.80±2.472)3)4)LVEDD/mm 5.19±0.38 6.93±0.521)6.20±0.522)6.39±0.512)5.70±0.392)3)4)
3.2 5组大鼠心肌细胞焦亡情况比较 与空白组比较,模型组心肌焦亡率显著升高(P<0.05);与模型组比较,西药组、中药组及西药+中药组心肌细胞焦亡率均显著降低(P<0.05);与西药组比较,西药+中药组心肌细胞焦亡率降低更明显(P<0.05)。见图1、表3。

图1 5 组大鼠心肌细胞焦亡情况(TUNEL 染色,×200)
表3 5 组大鼠心肌细胞焦亡情况比较(±s)
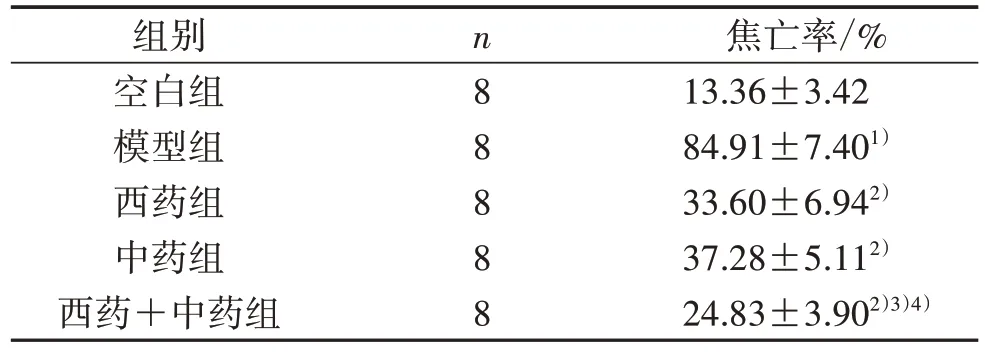
表3 5 组大鼠心肌细胞焦亡情况比较(±s)
焦亡率/%13.36±3.42 84.91±7.401)33.60±6.942)37.28±5.112)24.83±3.902)3)4)组别空白组模型组西药组中药组西药+中药组n8 8 8 8 8
注:与空白组比较,1)P<0.05;与模型组比较,2)P<0.05;与西药组比较,3)P<0.05;与中药组比较,4)P<0.05。
3.3 5组大鼠心肌组织NLRP3、Caspase-1、GSDMD mRNA 表达水平比较 见表4。
表4 5 组大鼠心肌NLRP3、Caspase-1、GSDMD mRNA 表达水平比较(±s)

表4 5 组大鼠心肌NLRP3、Caspase-1、GSDMD mRNA 表达水平比较(±s)
注:与空白组比较,1) P<0.05;与模型组比较,2) P<0.05;与西药组比较,3) P<0.05;与中药组比较,4) P<0.05。
组别空白组模型组西药组中药组西药+中药组GSDMD 1.01±0.02 3.88±1.761)1.37±0.842)1.48±0.592)1.17±0.502)n8 8 8 8 8 NLRP3 1.04±0.06 10.08±4.181)3.74±2.872)3.94±2.832)2.22±1.302)Caspase-1 1.00±0.04 8.44±1.911)2.26±0.632)2.46±0.942)1.21±0.522)3)4)
3.4 5组大鼠心肌组织NLRP3、Caspase-1、GSDMD蛋白表达量比较 见表5、图2。

图2 5 组大鼠心肌NLRP3、Caspase-1、GSDMD 蛋白条带图
表5 5 组大鼠心肌NLRP3、Caspase-1、GSDMD 蛋白表达量比较(±s)
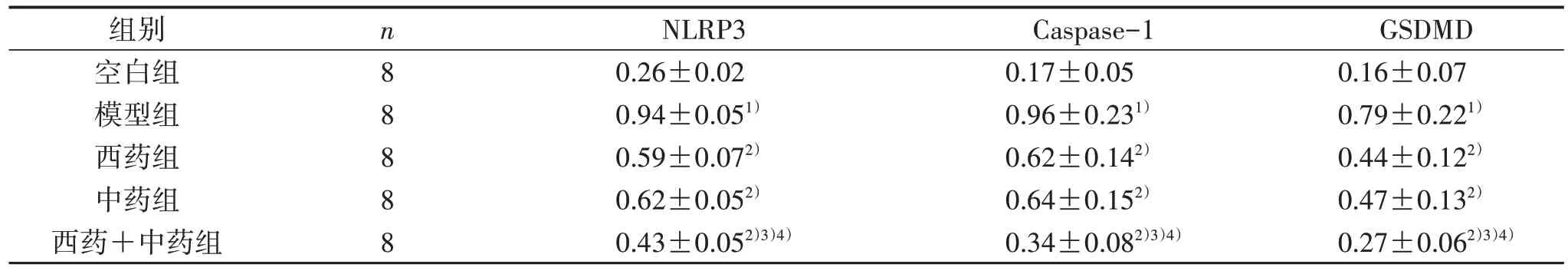
表5 5 组大鼠心肌NLRP3、Caspase-1、GSDMD 蛋白表达量比较(±s)
注:与空白组比较,1) P<0.05;与模型组比较,2) P<0.05;与西药组比较,3) P<0.05;与中药组比较,4) P<0.05。
GSDMD 0.16±0.07 0.79±0.221)0.44±0.122)0.47±0.132)0.27±0.062)3)4)组别空白组模型组西药组中药组西药+中药组n8 8 8 8 8 NLRP3 0.26±0.02 0.94±0.051)0.59±0.072)0.62±0.052)0.43±0.052)3)4)Caspase-1 0.17±0.05 0.96±0.231)0.62±0.142)0.64±0.152)0.34±0.082)3)4)
3.5 5组大鼠血清IL-1β、IL-18含量比较 见表6。
表6 5 组大鼠血清IL-1β、IL-18 含量比较(±s) ng/L

表6 5 组大鼠血清IL-1β、IL-18 含量比较(±s) ng/L
注:与空白组比较,1) P<0.05;与模型组比较,2) P<0.05;与西药组比较,3) P<0.05;与中药组比较,4) P<0.05。
组别空白组模型组西药组中药组西药+中药组IL-18 175.59±7.48 219.13±7.971)198.72±7.082)200.09±11.092)187.18±4.122)3)4)n8 8 8 8 8 IL-1β 46.67±1.30 59.15±1.571)53.12±2.122)54.24±1.572)50.51±1.452)3)4)
4 讨 论
健心颗粒是我省著名心血管病专家陈美华、林求诚团队结合近代医家及多年临床经验研制而成,该方配伍精妙,疗效确切,为我院常用院内制剂。方中黄芪、红参为君,大补元气、振奋心阳,以治其本;气虚不运,致血行瘀滞,故臣以蒲黄、丹参活血行瘀,通利血脉;佐以桂枝通阳化气,猪苓行窍水,白术燥湿利水,此三者取“五苓散”之意,行温阳化饮利水之效;肺主通调三焦水道,水道通则水饮除,故取葶苈子宣肺利水为使,开上源以利下流。全方药为八味,共奏益气、活血、温阳、利水之功。
现代药理学分析表明,白术、红参、黄芪等均具有较好的降血糖作用,因此,健心颗粒适用于糖尿病引起的心力衰竭。已有前期研究表明,健心颗粒可有效提高心力衰竭大鼠心肌代谢能力,改善心室重构[8]。
DCM 患者心肌细胞的最终结局是细胞死亡,因此能够干预细胞死亡相关信号通路的措施显然是治疗DCM 的关键,可有效改善心肌损伤,并延缓DCM 向晚期心力衰竭发展。细胞焦亡是一种新发现的程序性细胞死亡过程。焦亡细胞的胞膜失去完整性,产生1~2 nm 的孔隙,导致细胞器和细胞浆肿胀、破裂,细胞成分及促炎性介质通过膜孔释放,引起炎症反应。细胞焦亡的经典型途径依赖Caspase-1 介导,而非经典型途径依赖Caspase-4/5/11 介导,通过调控有关基因的表达可有效减轻高糖所诱导的心肌细胞的焦亡[9]。在对DCM 的分子研究中发现,依赖NLRP3/Caspase-1 的细胞焦亡经典途径在糖尿病心肌病的病变进展中发挥了重要的作用[10]。当机体处于高糖状态,NLRP3 炎性小体表达会上调,促进前体Caspase-1 裂解,裂解后的Caspase-1 不仅切割炎性因子前体pro-IL-1β、pro-IL-18 使之活化为成熟的IL-1β、IL-18,同时还切割GSDMD,从而在细胞膜上形成微孔,胞内离子外流,膜外水分内流,使细胞肿胀、裂解,进一步导致众多炎症因子如IL-1β、IL-18 等释放,最终诱发细胞焦亡[11-13]。
本研究中,与空白组比较,模型组大鼠心肌组织NLRP3、Caspase-1、GSDMD mRNA 表达水平和蛋白表达量升高,表明DCM 可诱导心肌细胞焦亡相关基因的表达异常。经卡托普利、健心颗粒干预治疗后,大鼠心室重构明显改善,心肌细胞焦亡率显著减轻,心肌组织NLRP3、Caspase-1、GSDMD mRNA表达水平和蛋白表达量降低,血清炎性因子IL-1β、IL-18 水平亦下降,其中中药组作用效果与西药组差异无统计学意义,而西药+中药组作用效果最优,提示健心颗粒可能是通过下调DCM 大鼠心肌细胞焦亡相关基因NLRP3、Caspase-1、GSDMD 表达,抑制炎症因子释放,进而发挥保护心肌组织的作用。
综上,本研究从细胞焦亡的角度进行探讨,发现细胞焦亡在DCM 的发生、发展过程中起着关键的作用。健心颗粒可能通过调控NLRP3/Caspase-1/GSDMD 信号通路改善DCM 大鼠心肌细胞焦亡,抑制炎症反应,从而达到治疗DCM 的目的。本研究为健心颗粒的临床应用提供实验基础,未来可进一步添加信号通路抑制剂进行通路验证,深入探索健心颗粒治疗DCM 的具体作用机制。
