金水六君煎对慢性阻塞性肺疾病小鼠模型巨噬细胞M1/M2表型分化的影响*
2023-11-13杨亿然
杨亿然,张 真,刘 雨
(1.湖南中医药大学,湖南 长沙 410208;2.湖南省中医药研究院附属医院,湖南 长沙 410006)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是临床常见的呼吸系统疾病,以不可逆的气流受限为主要特征,临床表现为咳嗽、咳痰及呼吸困难等[1]。COPD与吸烟、呼吸道感染和空气污染等因素密切相关。炎症是COPD发生发展的重要机制,预防和控制肺部炎症的发生是改善COPD患者症状的重要方法[2-4]。肺部炎症与巨噬细胞密切相关,主要包括经典激活的巨噬细胞(巨噬细胞M1极化)和替代活化的巨噬细胞(巨噬细胞M2极化)两种活化方向。M1极化以释放炎症因子、促进炎症发展为主,M2极化以释放抑炎因子、抑制炎症发展为主。因此,明确COPD中巨噬细胞的极化方向有重要意义[5-8]。金水六君煎出自《景岳全书》,具有养阴化痰之功效。现有研究表明,金水六君煎对COPD有着良好的治疗作用。无论是COPD缓解期还是急性加重期,在常规治疗的基础上加用金水六君煎,能有效缩短病程,改善患者症状,减少病情恶化的发生率[9]。研究认为其机制可能与抑制炎症因子高表达有关[10]。因此,本研究以COPD小鼠为研究对象,观察金水六君煎对巨噬细胞极化方向的影响,以阐明金水六君煎治疗COPD的可能机制及靶点。
1 材 料
1.1 实验动物 SPF级雄性ICR小鼠32只,6~8周龄,体质量(16.91±1.24)g,由北京华阜康生物科技有限公司提供,实验动物质量合格证号:110322211101433345,动物生产许可证号:SCXK(京)2019-0008。本实验经湖南中医药大学动物实验中心审核通过,动物实验伦理批号:LL2022022305。小鼠饲养于12 h黑夜、12 h白昼的环境中,饲养室温度为22~24 ℃,相对湿度为50%~60%。饲养期间小鼠自由进食和饮水。
1.2 香烟 金圣牌香烟,江西中烟工业有限责任公司生产,焦油含量8 mg,烟气烟碱量0.8 mg,CO含量9 mg。
1.3 实验试剂 PBS(批号:04B230203)购自长沙艾碧维生物科技有限公司;CD86抗体(PE)(批号:02S230111)、CD163抗体(APC)(批号:20210727003)、CD206抗体(FITC)(批号:00113481)均购自安诺伦生物科技有限公司;CD68抗体(PC5.5)(批号:00109616)购自百进生物科技有限公司;石蜡(批号:20213642012)、中性树胶(批号:20211031020)购自上海西格玛有限公司;苏木素(批号:20210301006)、PBS(批号:20210618005)、伊红(批号:20211130004)购自美国薇碧生化科技集团公司;白介素-6(IL-6)ELISA试剂盒(批号:07D21228)、白介素-8(IL-8)ELISA试剂盒(批号:03C20216)、CoraLite488-conjugated Affinipure Goat Anti-Rabbit lgG(H+L)(批号:13A2030004)、CoraLite594-conjugated Goat Anti-Mouse IgG(H+L)(批号:10S22110)均购自武汉三鹰生物技术有限公司;甲泼尼龙片(批号:13A221229)购自意大利辉瑞制药厂。
1.4 实验仪器 SL02型低速离心机购自上海知信实验仪器;A00-1-1102型流式仪购自贝克曼库尔特有限公司;H1650R型台式高速冷冻离心机购自湖南湘仪实验室仪器开发有限公司;PW-812型全自动酶标洗板机、MB-530型多功能酶标分析仪均购自深圳市汇松科技发展有限公司;DHP-500型电热恒温培养箱购自北京市永光明医疗仪器有限公司;TS-92型摇床购自其林贝尔;DYY-6C型恒温箱购自北京六一生物科技有限公司;MM721 AAU-PW型微波炉购自美的集团有限公司;M199型切片刀购自德国徕卡公司;YD-315型切片机购自浙江金华益迪试验器材;BMJ-A型包埋机购自常州中威电子仪器有限公司;BCD-245F型普通冰箱购自合肥荣事达电子电器集团有限公司;E-201-C型精密pH计购自上海雷磁环保工程有限公司;BA210T型显微镜购自麦克奥迪有限公司;DY89-1型盖玻片、AY89-2型载玻片均购自海门远泰实验器材厂。
1.5 药物配制 金水六君煎药物组成参照《景岳全书》原方[11]:当归6 g,熟地黄15 g,陈皮4.5 g,法半夏6 g,茯苓6 g,炙甘草3 g,生姜10 g。以上各药均为新绿药配方颗粒,购自湖南省中医药研究院附属医院,经田其学主任药师鉴定确认为正品。将上述药物用适量的灭菌水配置成生药质量浓度为1 g/mL的药液,现配现用。
2 实验方法
2.1 模型制造 将小鼠放置于熏烟箱(1.6 m×0.5 m×0.25 m),箱体设有通风口,防止小鼠窒息死亡。通风口对接烟雾处理设备,防止烟雾逸出污染环境。将20根香烟点燃后并放入熏烟箱内,持续熏烟1 h,中途休息15 min,重复上述步骤再次熏烟1 h,1次/d,2 h/次,连续12周。
2.2 实验分组 将32只ICR小鼠随机分为空白组、模型组、西药组和中药组,每组8只。小鼠给药剂量参考人和动物表面积折算的等效剂量比率表,中药组给药剂量为6.565 g/(kg·d),西药组经人体剂量换算后予甲泼尼龙,4.16 mg/(kg·d)[12],空白组和模型组小鼠予等量生理盐水灌胃,6.57 mL/(kg·d)。除空白组外,各组小鼠均在第1周起接受烟熏,第5周开始在熏烟前1 h灌胃相应药物。空白组小鼠只灌胃,不做熏烟处理。
2.3 观察指标
2.3.1 肺功能检测 12周后腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉小鼠后,分离暴露气管,进行气管插管固定,使用小动物肺功能检测仪测定每分钟通气量(MV)、吸气峰流量(PIF)及呼气峰流量(PEF)。
2.3.2 肺组织病理 HE染色观察肺组织病理。12周后处死小鼠,取小鼠肺部组织浸入4%多聚甲醛内固定24 h。60 ℃烤片12 h,切片脱蜡至水,经苏木素、伊红染色后,梯度酒精脱水。取出后置于二甲苯10 min,2次,中性树胶封片,显微镜观察并采集图像。
2.3.3 肺组织IL-6和IL-8水平 取一定量肺组织,制备10%肺组织匀浆液,4 ℃,1 000 r/min离心10 min(离心半径为7 cm),取上清液,严格按照ELISA检测试剂盒说明书检测IL-6、IL-8水平。
2.3.4 肺组织CD68和CD206表达 采用免疫荧光观察小鼠肺组织CD68和CD206表达。取小鼠肺部组织浸入4%多聚甲醛内固定24 h。60 ℃烤片12 h,切片脱蜡至水,热修复抗原,经过硼氢化钠溶液、乙醇溶液、苏丹黑染液处理后,于10%正常血清/5%BSA封闭60 min。孵育一抗:滴加适当稀释的一抗(CD68+CD206),4 ℃过夜。PBS冲洗3次,5 min/次。孵育二抗:滴加50~100 μL抗-小鼠+兔-IgG标记荧光抗体,37 ℃孵育60~90 min,PBS冲洗3次,5 min/次。DAPI工作液染核后PBS充分冲洗后取出。荧光显微镜下观察,荧光显微镜电脑采集图像。
2.3.5 巨噬细胞M1和M2极化情况 采用流式细胞仪检测巨噬细胞M1和M2极化情况。取小鼠肺组织冷冻于液氮内,并用胶原酶I配制成0.2 mg/mL的消化液,组织剪碎后转移至15 mL离心管,加入6 mL消化液,充分消化后加入6 mL DMEM终止消化。使用细胞滤网过滤,剩余组织研磨后,DMEM冲洗过滤网。4 ℃,1 000 r/min离心5 min(离心半径为7 cm),弃去上清液,收集细胞悬液后再次4 ℃,1 000 r/min离心5 min(离心半径为7 cm),收集细胞沉淀。加入CD86和CD163抗体,孵育。设置阴性管,单染管。4 ℃,1 000 r/min离心5 min(离心半径为7 cm),破膜、洗涤,加入CD86和CD206抗体,孵育。设置单染管,洗涤后4 ℃,1 000 r/min离心5 min(离心半径为7 cm),分别加入200 μL PBS重悬细胞,用流式仪检测。
2.4 统计学方法 采用SPSS 26.0软件进行统计学分析,计量资料用“均数±标准差”(±s)表示。计量资料符合正态分布且方差齐,使用单因素方差分析,若不符合正态分布,则使用非参数检验。P<0.05为差异有统计学意义。
3 结 果
3.1 各组小鼠肺功能比较 模型组小鼠MV、PIF和PEF水平均低于空白组(P<0.05);中药组和西药组小鼠MV、PIF和PEF水平均高于模型组(P<0.05);中药组小鼠MV、PIF和PEF水平均高于西药组(P<0.05)。(见表1)
表1 各组小鼠肺功能比较 (±s)

表1 各组小鼠肺功能比较 (±s)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与西药组比较,cP<0.05。
组别 n 给药剂量 MV/mL PEF/(mL/s) PIF/(mL/s)空白组 8 - 44.85±3.05 4.53±0.32 3.71±0.16模型组 8 - 17.80±2.09a 2.37±0.19a 2.16±0.08a西药组 8 4.160 mg/(kg·d) 31.48±1.90a b 3.64±0.23a b 2.57±0.09a b中药组 8 6.565 g/(kg·d) 37.56±2.95a bc 3.69±0.87a bc 3.16±0.16a bc F 162.015 124.508 220.161 P 0.000 0.017 0.000
3.2 小鼠肺组织病理改变 空白组小鼠肺组织完整,肺泡无明显破裂融合现象;模型组可见肺泡破裂融合,为明显的COPD肺组织征象;与模型组比较,中药组和西药组肺泡破裂融合现象明显减少。(见图1)

图1 小鼠肺组织病理图 (HE,×100)
3.3 各组小鼠肺组织IL-6和IL-8水平比较 模型组小鼠肺组织IL-6和IL-8水平均高于空白组(P<0.05);西药组、中药组小鼠肺组织IL-6和IL-8水平均低于模型组(P<0.05);中药组小鼠肺组织IL-6和IL-8水平均低于西药组(P<0.05)。(见表2)
表2 各组小鼠肺组织IL-6 和IL-8 水平比较 (±s,pg/mL)

表2 各组小鼠肺组织IL-6 和IL-8 水平比较 (±s,pg/mL)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与西药组比较,cP<0.05。
组别 n 给药剂量 IL-6 IL-8空白组 8 - 0.12±0.02 0.07±0.01模型组 8 - 0.26±0.02a 0.17±0.03a西药组 8 4.160 mg/(kg·d) 0.21±0.02a b 0.15±0.02a b中药组 8 6.565 g/(kg·d) 0.18±0.01a b c 0.13±0.02a b c F 84.301 37.696 P 0.001 0.000
3.4 小鼠肺组织CD68和CD206的表达 免疫荧光实验结果显示,各组小鼠均有不同程度的CD68和CD206阳性表达。其中CD68反映巨噬细胞激活程度,CD206反映巨噬细胞M2极化程度。空白组小鼠肺组织中CD68及CD206表达均不明显,提示巨噬细胞处于未激活状态。与其余各组比较,模型组的CD68阳性表达量最明显,提示模型组肺组织中巨噬细胞被激活。中药组和西药组CD206阳性表达明显升高,提示经过治疗后,肺组织中巨噬细胞有向M2极化趋势。(见图2)
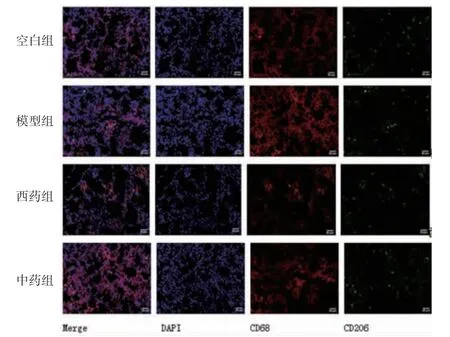
图2 各组小鼠肺组织CD68 和CD206 的表达 (×200)
模型组小鼠肺组织CD68、CD206占比和CD206/CD68均高于空白组(P<0.05);西药组、中药组小鼠肺组织CD68占比低于模型组,CD206占比和CD206/CD68均高于模型组(P<0.05);中药组小鼠肺组织CD68占比高于西药组(P<0.05),CD206占比和CD206/CD68均低于西药组(P<0.05)。(见表3)
表3 各组小鼠肺组织CD68、CD206 占比和CD206/CD68比较 (±s)

表3 各组小鼠肺组织CD68、CD206 占比和CD206/CD68比较 (±s)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与西药组比较,cP<0.05。
组别 n 给药剂量 CD68占比/% CD206占比/% CD206/CD68空白组 8 - 2.40±0.18 0.06±0.01 0.03±0.01模型组 8 - 10.55±0.39a 2.64±0.32a 0.25±0.02a西药组 8 4.160 mg/(kg·d) 6.43±0.33ab 3.65±0.19ab 0.57±0.05ab中药组 8 6.565 g/(kg·d) 7.60±0.64abc 3.56±0.39abc 0.47±0.02abc F 1 460.409 946.189 794.516 P 0.030 0.000 0.028
3.5 小鼠肺组织巨噬细胞极化方向 CD86阳性比例反映巨噬细胞M1极化,CD163阳性比例反映巨噬细胞M2极化。模型组小鼠肺组织CD86阳性比例和CD86/CD163高于空白组(P<0.05),提示巨噬细胞激活以M1极化为主。西药组与中药组小鼠肺组织CD86阳性比例和CD86/CD163低于模型组(P<0.05),CD163阳性比例高于模型组(P<0.05),提示巨噬细胞以M2方向极化趋势为主。(见表4、图3)

图3 各组小鼠巨噬细胞M1、M2 型表达水平
表4 各组小鼠肺组织CD86、CD163 阳性比例及CD86/CD163 比较 (±s)
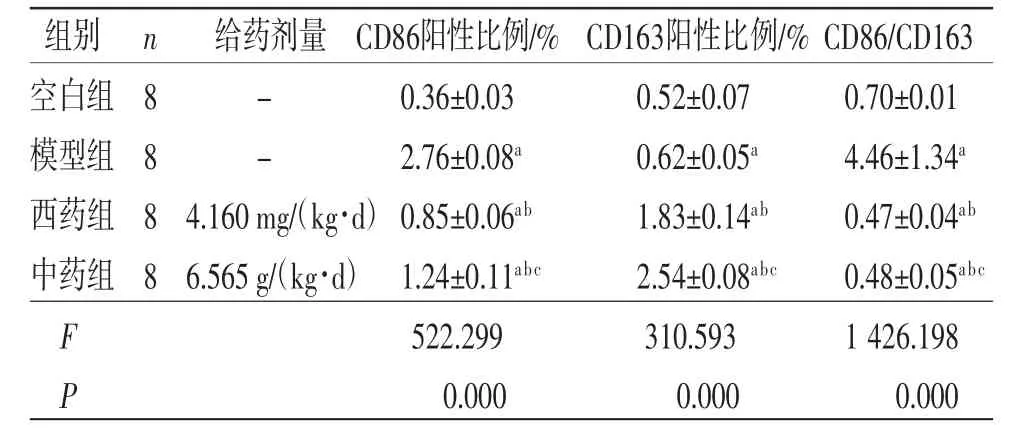
表4 各组小鼠肺组织CD86、CD163 阳性比例及CD86/CD163 比较 (±s)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与西药组比较,cP<0.05。
组别 n 给药剂量 CD86阳性比例/% CD163阳性比例/% CD86/CD163空白组 8 - 0.36±0.03 0.52±0.07 0.70±0.01模型组 8 - 2.76±0.08a 0.62±0.05a 4.46±1.34a西药组 8 4.160 mg/(kg·d) 0.85±0.06ab 1.83±0.14ab 0.47±0.04ab中药组 8 6.565 g/(kg·d) 1.24±0.11abc 2.54±0.08abc 0.48±0.05abc F 522.299 310.593 1 426.198 P 0.000 0.000 0.000
4 讨 论
COPD是一种常见的慢性疾病,尤以老年人多见,严重影响患者的生活质量[13]。COPD的急性发展与炎症密切相关,抗炎贯穿COPD治疗始终,控制炎症的进展是治疗COPD的重要组成部分。临床常根据痰培养鉴定选出合适的敏感抗生素进行治疗,当炎症反应严重,难以控制时,常配合激素治疗改善症状。巨噬细胞在炎症反应过程中有着不可替代的作用[14-15]。在人体气道表面,巨噬细胞广泛分布,具有抵御外来病原微生物入侵和调节人体炎症反应的作用[16]。巨噬细胞具有明显的可塑性和非均一性,其激活状态取决于其自身的局部微环境信号。目前,巨噬细胞的表型主要有两类:经典活化型(M1极化)和替代活化型(M2极化),细胞因子和表型标志物可区分两者[17]。M1极化后的巨噬细胞主要分泌IL-6、IL-12和肿瘤坏死因子-α(TNF-α),具有积极的促炎作用,有利于机体对外来病原体的消灭清除,但是过度的炎症反应对机体组织亦能造成损害[18]。M2型极化后的巨噬细胞主要分泌IL-10、转化生长因子-β(TGF-β),具有积极的抗炎作用,有利于机体炎症的减退,帮助组织修复[19]。研究表明,在COPD发生发展过程中,巨噬细胞的极化现象贯穿其中。对于极化方向,目前主流观点认为,COPD往往由感染导致急性加重,巨噬细胞向M1转化符合炎症的发生发展规律[20]。
COPD属中医学中“肺胀”“喘证”等范畴。咳嗽、咳痰、胸闷气促为主要表现。肺为娇脏,喜润恶燥。肺阴不足,宣降失常,气滞饮停,聚而为痰。肾阴不足,肾不纳气,发为气促[21-22]。金水六君煎养阴化痰,主治肺肾不足,水泛为痰。方中当归补血活血;熟地黄补血滋阴,益精填髓。两者合用,补肺肾之阴,以复肺脏宣降之权,肾脏纳气之能,治病之本[23]。半夏燥湿化痰,陈皮理气健脾,茯苓利水渗湿。三者合用,健脾运湿,化痰止咳,治病之标。甘草调和诸药。诸药合用标本兼治,共奏滋养肺肾、止咳化痰之功。现代药理研究证实,当归可以通过降低毛细血管的通透性、抑制炎症因子的释放、维持机体免疫细胞敏感性来起到抗炎的作用,同时当归还可以通过增加免疫细胞的数量来起到提高免疫力的作用[24]。不同剂量地黄提取物能不同程度地提高T淋巴细胞比值和血清溶血素水平,从而提高机体免疫力。研究表明,地黄醋酸乙酯浸膏、正丁醇浸膏对金黄色葡萄球菌、大肠杆菌、枯草杆菌等有明显抑制作用[25]。现代药理研究表明,半夏提取物有显著的镇咳和祛痰作用[26];陈皮具有抑菌抗炎、抗病毒、抗氧化、清除自由基的作用[27];茯苓具有增强特异性细胞免疫功能、抗炎、抗病毒等作用[28]。
本实验结果显示,模型组小鼠存在明显COPD病理现象,肺功能各项指标恶化,提示COPD造模成功。经金水六君煎和甲泼尼龙干预后,小鼠肺组织病理和肺功能明显改善,炎症因子减少,提示两者可通过抑制肺部炎症治疗COPD。同时,模型组肺泡巨噬细胞数增多,M1/M2型巨噬细胞百分比升高。经金水六君煎和甲泼尼龙干预后,小鼠肺泡巨噬细胞数降低,M1型巨噬细胞比例下降,M2型巨噬细胞比例上升,提示金水六君煎和甲泼尼龙可通过抑制肺泡巨噬细胞M1极化和促进M2极化来抑制肺部炎症,达到治疗COPD的作用。
综上所述,COPD小鼠肺组织存在巨噬细胞极化M1/M2失衡。金水六君煎可能通过促进巨噬细胞M2极化起到改善肺部炎症,从而起到治疗COPD的作用。
