五参汤加减对心肌梗死大鼠心脏功能及促血管生成作用的保护机制研究*
2023-11-13张富璋鲁卫星
张富璋,鲁卫星
(1.北京中医药大学,北京 100029;2.北京中医药大学第三附属医院,北京 100029)
心肌梗死表现为心肌缺血坏死引起的胸痛,可伴有心律失常和心力衰竭。心肌梗死的死亡率较高,且我国的发病率增长迅速[1]。研究[2]表明,为适应心肌梗死后的缺氧状态,心肌梗死周边部位新生血管可在一定程度上恢复缺血心肌血流,改善心功能,因此近年来治疗性血管新生的研究不断深入。心肌梗死在中医属于“真心痛”“胸痹”等范畴。《诸病源候论》中“心里强痞急痛,肌肉苦痹,绞急如刺,不得俯仰”[3]描述了本病症状。本病属本虚标实,多发于中老年人。阳气渐虚,脏腑渐衰,心气亏虚,血行无力,瘀血内生,阻滞经络,故有心痛。《素问·调经论篇》中认为“寒气积于胸中而不泻,……,凝则脉不通”[4]。阳气虚衰,无以温化寒凝,胸痛更甚。针对此病机,中医多采用益气活血之法治疗。五参汤加减具有益气活血之效,临床多用于治疗心系疾病[5],但关于其促血管生成和保护心脏的作用机制报道较少。本研究通过建立心肌梗死大鼠模型,探究五参汤加减对心肌梗死大鼠心脏功能及促血管生成的作用和机制,现报告如下。
1 材料与方法
1.1 实验动物 8周龄健康SPF级雄性SD大鼠82只,体质量225~250 g,购于北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2021-0006,饲养环境:12 h/12 h明暗交替光照,室温22~25 ℃下饲养,相对湿度40%~70%,自由饮食。实验操作流程严格遵照北京中医药大学动物实验伦理委员会的相关法规。本研究经本医院医学伦理委员会批准,批准号:2021-02S1号。
1.2 药物与试剂 五参汤加减(太子参30 g,丹参15 g,沙参15 g,玄参15 g,苦参15 g,麦冬10 g,川芎10 g,炙甘草6 g)由本院药房提供;盐酸贝那普利片(批号:1920203,国药准字H20030514)购于北京诺华制药;肌酸激酶MB(creatine kinase MB form,CK-MB)大鼠ELISA试剂盒(批号:125610)、脑钠肽(brain natriuretic peptide,BNP)大鼠ELISA试剂盒(批号:156011)、肿瘤坏死因子-α(tumor necrosis factorα,TNF-α)大鼠ELISA试剂盒(批号:062416)均购于武汉华美生物工程有限公司;血小板-内皮细胞黏附分子(platelet endothelial cell adhesion molecule 1,CD31)抗体(批号:2411781021)、血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGF2R)抗体(批号:2635212140)、磷脂酰肌醇激酶3(phosphatidylinositol 3-kinase,PI3K)抗体(批号:3011771025)、蛋白激酶B(protein kinase B,AKT)抗体(批号:2654105101)、p-AKT抗体(批号:0524A21)、过氧化物酶标记IgG抗体(批号:0311A23)均购于博士德生物工程有限公司;PCR引物设计、合成由上海生工完成;PCR逆转录试剂盒(批号:1014561)、PCR试剂盒(批号:1511051)均购于宝日医生物技术有限公司。
1.3 主要仪器 SONOS 7500型三维超声心动图(荷兰飞利浦医疗器材集团);CX41-72000-2型光学显微镜(日本OLYMPAS公司);Synergy2型酶标仪(美国伯腾仪器有限公司);ADI POWERLAB型多导生理记录仪(澳大利亚AD Instruments公司)。
1.4 造模与分组 大鼠适应性喂养1周后,随机选出10只大鼠作为假手术组,其余大鼠复制心肌梗死大鼠模型[6]。具体操作:术前禁食,腹腔注射10%水合氯醛麻醉后固定,剪开颈部皮肤,气管插管,使用小动物呼吸机进行人工通气(80次/min,潮气量4 mL),并连接心电图采集系统观察大鼠心电图变化,在左侧第三、四肋间开胸,逐层分离肌肉,镊子刺破胸膜暴露心脏,挑开心包膜,在肺动脉圆锥与左心耳交界处下方2~3 mm处开始结扎,当观察到搏动减弱、心肌组织颜色变为暗红或逐渐苍白、心电图出现ST段弓背向上性抬高,即为造模成功;之后抽吸血液,逐层缝合;待苏醒后拔除插管,缝合颈部。假手术组大鼠仅做气管插管和开胸,不结扎冠状动脉直接缝合。造模过程中,有12只大鼠死亡,60只大鼠造模成功。将造模成功大鼠随机分为模型组、阳性对照组、五参汤加减低剂量组、五参汤加减中剂量组、五参汤加减高剂量组,每组10只。
1.5 实验给药 造模后第2天开始给药治疗,五参汤加减低、中、高剂量组大鼠分别给予1.6、3.2、6.4 g/kg五参汤加减药液灌胃,阳性对照组大鼠予10 mg/kg贝那普利灌胃,假手术组和模型组大鼠予等体积生理盐水灌胃,1次/d,连续给药14 d。
1.6 观察指标
1.6.1 超声心动图评估心脏功能 末次给药1 h后,用10%水合氯醛腹腔注射麻醉大鼠,超声心动图检测评估心脏功能指标,即左心室舒张末期内径(left ventricular end-diastolic dimension,LVEDD)、左心室收缩末期内径(left ventricular endsystolic dimension,LVESD)、左心室短轴缩短率(left ventricular fractional shortening,LVFS)、左室射血分数(left ventricular ejection fraction,LVEF)。
1.6.2 取材 超声心动图检测完成后,取腹主动脉血5 mL,用于ELISA试剂盒检测;处死大鼠,快速剖开胸腔,摘取心脏,生理盐水洗去血液,同时去除心室周围组织,一部分固定于4%多聚甲醛中用于HE染色和免疫组化,一部分用于qRT-PCR和Western blotting检测。
1.6.3 HE染色观察心肌组织病理学改变情况 4%多聚甲醛固定心肌组织48 h,制备石蜡切片,一部分用于HE染色,另一部分用于免疫组化实验,常规脱蜡水化,用苏木素染色,盐酸酒精分化,冲洗玻片,反蓝3 min,冲洗玻片,伊红染色,70%乙醇浸洗玻片,梯度酒精脱水,二甲苯透明,中性树脂封片、烘片,在显微镜下观察组织形态是否发生病理改变。
1.6.4 免疫组化检测微血管密度(microvessel density,MVD) 将石蜡切片二甲苯脱蜡、水化,修复抗原,滴加CD31抗体稀释液,4 ℃孵育过夜,隔日室温孵育二抗1 h,DAB显色,苏木素染色后脱水,中性树脂封片、烘片,光镜下观察CD31阳性细胞(棕黄色),MVD为5个不同视野下单位面积内CD31阳性的微血管数量(管腔≤25 μm)的平均值。
1.6.5 ELISA法检测CK-MB、BNP、TNF-α水平 将大鼠腹主动脉血静置2 h,1 000×g离心15 min,收集血清。操作步骤按照试剂盒要求进行,在试剂盒提供的96孔板中加入血清,37 ℃孵育2 h,去除液体,加入生物素抗体,37 ℃孵育1 h,去除液体,洗板3次,加入HRP亲和素,37 ℃孵育1 h,去除液体,洗板3次,加入底物,37 ℃避光孵育30 min,加入工作停止液,酶标仪上检测450 nm处波长,计算CK-MB、BNP、TNF-α水平。
1.6.6 qRT-PCR检测血管内皮生长因子(vascular endothelial growth factor,VEGF)mRNA、PI3K mRNA、AKT mRNA表达水平 Trizol法提取大鼠心肌组织总RNA,紫外分光光度计定量后,逆转录合成cDNA。加入PCR引物配置PCR体系,在PCR仪上进行扩增,扩增条件:94 ℃15 min预变性,95 ℃30 s、60 ℃30 s、75 ℃30 s,循环40次。以β-actin为内参计算2-ΔΔCt,即为目的基因VEGF mRNA、PI3K mRNA、AKT mRNA相对表达量。PCR引物序列见表1。

表1 PCR 引物序列
1.6.7 Western blotting检测VEGF2R、PI3K、AKT蛋白表达水平心肌组织加入裂解液进行冰上匀浆、裂解,10 000×g低温离心15 min,取中层蛋白,水浴变性,BCA法进行蛋白定量,制备电泳凝胶,进行电泳、转模,采用5%脱脂牛奶封闭1.5 h,4 ℃孵育一抗过夜(1∶1 000),洗膜后室温孵育二抗2 h(1∶2 000),洗膜后进行ECL化学发光,采集蛋白条带图像并用软件分析灰度值。
1.7 统计学方法 采用SPSS 24.0软件,计量资料以“均数±标准差”(±s)表示,多组间比较采用单因素方差分析,两两比较用LSD-t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠心脏功能比较 治疗期间无大鼠死亡。与假手术组比较,模型组大鼠LVEDD、LVESD均明显增加(P<0.05),LVFS、LVEF均明显降低(P<0.05);与模型组比较,阳性对照组和五参汤加减中、高剂量组大鼠LVEDD、LVESD均明显减少(P<0.05),LVFS、LVEF均明显升高(P<0.05)。五参汤加减低剂量组大鼠LVEDD、LVESD、LVFS、LVEF与模型组比较,差异无统计学意义(P>0.05)。(见表2)
表2 各组大鼠心脏功能比较 (±s)
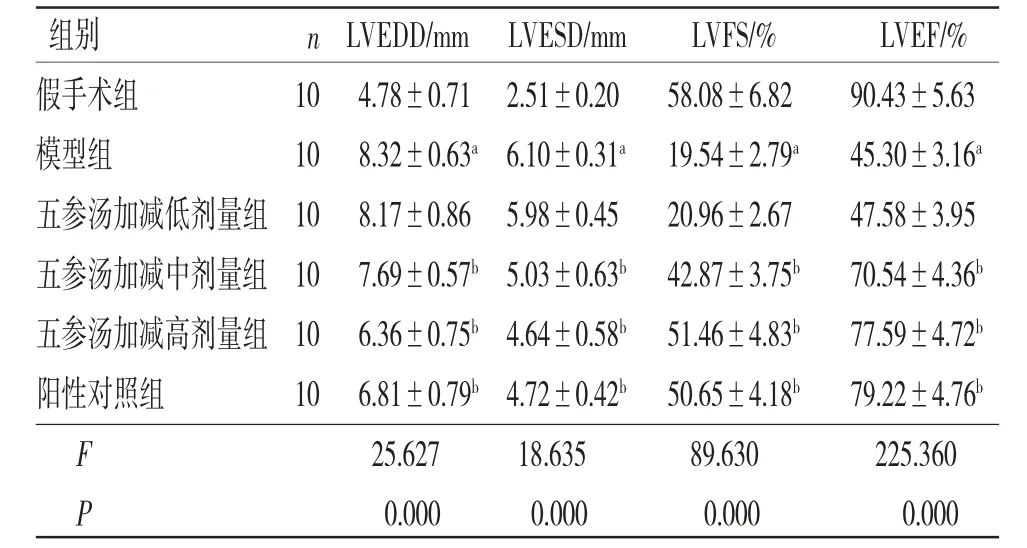
表2 各组大鼠心脏功能比较 (±s)
注:与假手术组比较,aP<0.05,与模型组比较,bP<0.05。
组别 n LVEDD/mm LVESD/mm LVFS/% LVEF/%假手术组 10 4.78±0.71 2.51±0.20 58.08±6.82 90.43±5.63模型组 10 8.32±0.63a 6.10±0.31a 19.54±2.79a 45.30±3.16a五参汤加减低剂量组 10 8.17±0.86 5.98±0.45 20.96±2.67 47.58±3.95五参汤加减中剂量组 10 7.69±0.57b 5.03±0.63b 42.87±3.75b 70.54±4.36b五参汤加减高剂量组 10 6.36±0.75b 4.64±0.58b 51.46±4.83b 77.59±4.72b阳性对照组 10 6.81±0.79b 4.72±0.42b 50.65±4.18b 79.22±4.76b F 25.627 18.635 89.630 225.360 P 0.000 0.000 0.000 0.000
2.2 各组大鼠心肌组织病理改变和MVD比较 假手术组大鼠心肌细胞无明显异常,纤维排列整齐,无明显炎症细胞浸润;模型组大鼠出现明显心肌细胞坏死及炎症细胞浸润,心肌纤维排列紊乱,肌束断裂;阳性对照组和五参汤加减低、中、高剂量组大鼠心肌组织上述病理改变有不同程度的改善。(见图1)与假手术组比较,模型组大鼠MVD明显升高(P<0.05);与模型组比较,阳性对照组和五参汤加减中、高剂量组大鼠MVD均明显升高(P<0.05);五参汤加减低剂量组大鼠MVD与模型组比较,差异无统计学意义(P>0.05)。(见图2)
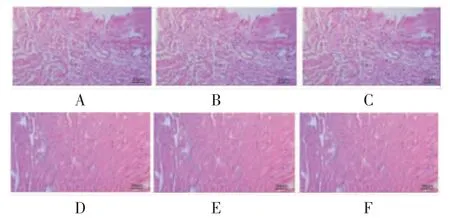
图1 各组大鼠心肌组织病理切片图 (HE,×400)
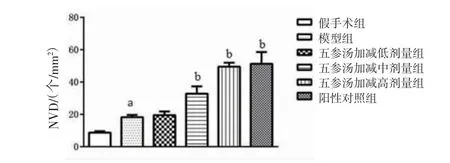
图2 各组大鼠MVD 比较 (±s,n=10)
2.3 各组大鼠血清CK-MB、BNP、TNF-α水平比较 模型组大鼠血清CK-MB、BNP、TNF-α水平均明显高于假手术组(P<0.05);阳性对照组和五参汤加减中、高剂量组大鼠血清CK-MB、BNP、TNF-α水平均明显低于模型组(P<0.05);五参汤加减低剂量组大鼠血清CK-MB、BNP、TNF-α水平与模型组比较,差异无统计学意义(P>0.05)。(见表3)
表3 各组大鼠血清CK-MB、BNP、TNF-α 水平比较 (±s)
注:与假手术组比较,aP<0.05,与模型组比较,bP<0.05。
组别 n CK-MB/(U/L) BNP/(U/L) TNF-α/(ng/L)假手术组 10 17.31±0.97 0.29±0.07 73.27±4.18模型组 10 38.14±1.42a 1.87±0.21a 185.77±18.36a五参汤加减低剂量组 10 37.66±1.53 1.79±0.24 173.48±20.54五参汤加减中剂量组 10 28.58±1.84b 1.05±0.23b 104.59±14.51b五参汤加减高剂量组 10 23.04±1.77b 0.69±0.12b 72.64±8.16b阳性对照组 10 26.67±1.65b 0.72±0.16b 75.20±12.28b F 76.320 8.691 316.120 P 0.000 0.000 0.000
2.4 各组大鼠心肌组织VEGF mRNA、PI3K mRNA、AKT mRNA相对表达量比较 与假手术组比较,模型组大鼠心肌组织VEGF mRNA、PI3K mRNA、AKT mRNA相对表达量均明显降低(P<0.05);与模型组比较,阳性对照组和五参汤加减中、高剂量组大鼠心肌组织VEGF mRNA、PI3K mRNA、AKT mRNA相对表达量均明显升高(P<0.05);五参汤加减低剂量组大鼠心肌组织VEGF mRNA、PI3K mRNA、AKT mRNA相对表达量与模型组比较,差异无统计学意义(P>0.05)。(见表4)
表4 各组大鼠心肌组织VEGF mRNA、PI3K mRNA、AKT mRNA 相对表达量比较 (±s)
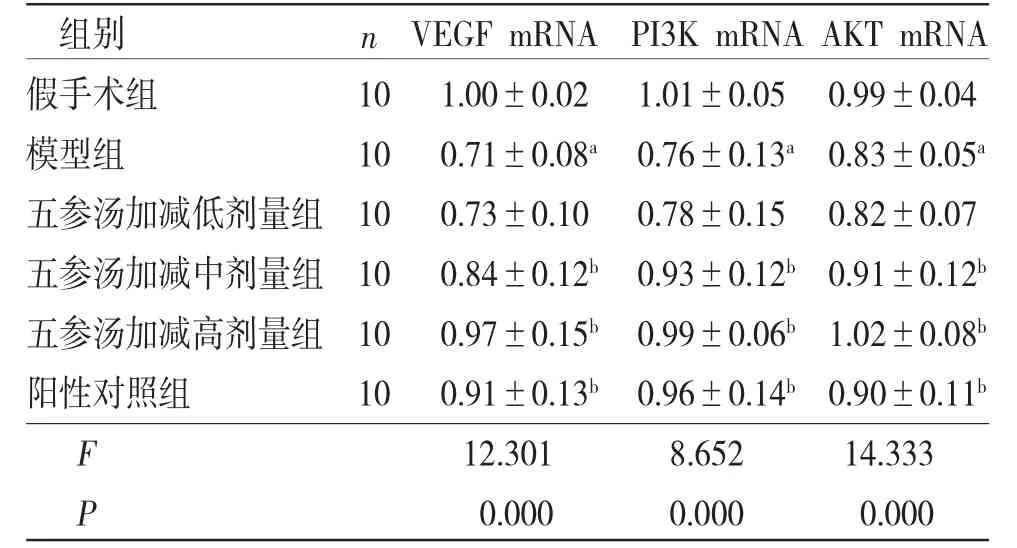
表4 各组大鼠心肌组织VEGF mRNA、PI3K mRNA、AKT mRNA 相对表达量比较 (±s)
注:与假手术组比较,aP<0.05,与模型组比较,bP<0.05。
组别 n VEGF mRNA PI3K mRNA AKT mRNA假手术组 10 1.00±0.02 1.01±0.05 0.99±0.04模型组 10 0.71±0.08a 0.76±0.13a 0.83±0.05a五参汤加减低剂量组 10 0.73±0.10 0.78±0.15 0.82±0.07五参汤加减中剂量组 10 0.84±0.12b 0.93±0.12b 0.91±0.12b五参汤加减高剂量组 10 0.97±0.15b 0.99±0.06b 1.02±0.08b阳性对照组 10 0.91±0.13b 0.96±0.14b 0.90±0.11b F 12.301 8.652 14.333 P 0.000 0.000 0.000
2.5 各组大鼠心肌组织VEGF、PI3K、AKT蛋白相对表达量比较 与假手术组比较,模型组大鼠心肌组织VEGF、PI3K蛋白相对表达量及p-AKT/AKT均明显降低(P<0.05);与模型组比较,阳性对照组和五参汤加减中、高剂量组大鼠心肌组织VEGF、PI3K蛋白相对表达量及p-AKT/AKT均明显升高(P<0.05);五参汤加减低剂量组大鼠心肌组织VEGF、PI3K蛋白相对表达量及p-AKT/AKT与模型组比较,差异无统计学意义(P>0.05)。(见图3~4)

图3 各组大鼠心肌组织VEGF、PI3K、AKT 蛋白表达Western blotting 图

图4 各组大鼠心肌组织VEGF、PI3K、AKT 蛋白相对表达量比较 (±s,n=10)
3 讨 论
心肌梗死以气虚、瘀血多见,治疗时应当以益气养阴、活血祛瘀为原则。五参汤加减组成包括太子参、丹参、沙参、玄参、苦参、麦冬、川芎、甘草。方中太子参益气,丹参、川芎活血祛瘀,沙参、玄参、麦冬养阴,苦参清热,炙甘草益气复脉。现代药理研究[7-10]表明,太子参中的粗多糖和皂苷类均具有保护心肌的作用;丹参酮ⅡA具有强大的抗血管炎症的作用;苦参总碱可抑制心肌细胞凋亡;玄参提取物具有舒张血管、抗心肌纤维化的作用。临床上,血清CK-MB升高表明心肌损伤,BNP则反映了左心室功能障碍程度,TNF-α升高与炎症反应相关[11-12]。本研究发现,心肌梗死模型大鼠心肌细胞坏死且有明显炎症细胞浸润,提示造模成功;在经五参汤加减治疗后,LVEDD、LVESD及血清中CK-MB、BNP、TNF-α降低,LVFS、LVEF升高,且心肌病理改变有所改善,说明五参汤加减可改善心肌梗死大鼠的心肌损伤和心肌重塑。安琪等[13]采用电针联合药物治疗急性心肌梗死大鼠,发现LVEF、LVFS升高;张亚平等[14]研究发现黄芩苷可降低心肌梗死大鼠CK-MB、TNF-α水平,均与本研究结果一致,表明五参汤加减可改善心肌梗死大鼠心功能和心脏重塑,减轻炎症反应。
血管生成是心肌梗死后缓解缺血的病理过程之一,因此治疗性血管生成被认为是一种有效的心肌保护策略,这一过程涉及多个信号通路。在心肌梗死发生后,心肌细胞通过促进HIF-1的生成适应缺氧环境,而HIF-1可增强其下游靶基因表达,VEGF则是其下游的靶基因之一。此外,肥大细胞也可释放VEGF。VEGF的受体VEGFR2在心肌梗死小鼠的心肌细胞中大量表达,从而促进血管生成[15-16]。CD31是一种血管内皮细胞标志物,用于评价微血管密度[17]。研究[18]发现,PI3K/AKT信号通路参与内皮细胞迁移和血管生成,可通过下游靶点HIF-1α调控VEGF表达。本研究结果显示,心肌梗死大鼠经五参汤加减治疗后,其梗死周围心肌组织MVD明显上升,VEGF mRNA表达上调,VEGF2R蛋白表达增加,且PI3K mRNA、AKT mRNA表达上调,PI3K蛋白表达量和p-AKT/AKT升高。白晓君等[19]研究发现,淫羊藿总黄酮可上调心肌梗死大鼠VEGF、VEGFR2表达;FENG Q等[20]研究发现,PTEN抑制剂可通过激活PI3K/AKT/VEGF信号通路,促进心肌梗死小鼠血管生成,与本研究相一致,表明五参汤加减可促进心肌梗死后的血管生成,促进心脏功能恢复,其机制可能与调控PI3K/AKT信号通路相关。
综上所述,五参汤加减可改善心肌梗死大鼠心脏功能和心脏重塑,减轻炎症反应,促血管生成,其机制可能与调控PI3K/AKT信号通路相关。
