超高效液相色谱-串联质谱法研究氯氟醚菌唑在斑马鱼体内的对映选择性富集代谢
2023-11-10张苹孙晓芳钟言茹孔令茹吴琦琦施海燕王鸣华
张苹 孙晓芳 钟言茹 孔令茹 吴琦琦 施海燕 王鸣华
(南京农业大学植物保护学院,南京 210095)
农药施用后会经地表径流、淋溶和降雨沉降等方式进入水环境,在环境生物体内发生吸收、分布和代谢,并进一步对非靶标生物产生如致死性、酶活性影响和“三致”性等毒性效应行为,从而威胁水生生物安全。鱼类模式生物斑马鱼(Danio rerio)具有躯体透明、周期短、易检测且与人类基因同源性高等优点,最初用于检测水体中环境污染物[1],目前已被广泛应用于生态毒理学、遗传学、药物代谢和新药筛选创制等研究领域[2-3]。生态毒理学研究常采用生物富集因子(BCF)、清除速率常数和半衰期评估农药在其体内的吸收、分布和代谢过程的动力学终点[4]。
氯氟醚菌唑(Mefentrifluconazole)是由巴斯夫公司研发并上市的首个新型异丙醇三唑类杀菌剂[5],与传统三唑类杀菌剂相比,具有更高的选择性和內吸性,对多种抗性病原菌防治效果显著,可延缓抗性发展[6]。氯氟醚菌唑的化学结构含有1 个手性中心,包含2 个对映体。对映体具有相同的理化性质,但通常在活性、毒性和环境行为方面表现出较大差异[7]。国际纯粹与应用化学联合会(IUPAC)报告显示,氯氟醚菌唑对水生生物具有毒性,且其毒性还具有遗传性,被视为潜在的肝脏有毒物质。目前,已有研究表明氯氟醚菌唑对斑马鱼早期胚胎发育和幼鱼生长具有选择性致畸和神经毒性[8],并对其成鱼具有肝脏毒性,进而影响其脂质代谢过程[9],但其在斑马鱼体内的生物富集及代谢行为尚未明确。
本研究以斑马鱼为供试水生生物,从对映体水平研究氯氟醚菌唑对斑马鱼的急性毒性、富集代谢行为及代谢途径,为揭示氯氟醚菌唑的对映体选择性水生生物毒性效应及其水生态风险评估提供了理论依据。
1 实验部分
1.1 仪器与试剂
UPLC Xevo TQ-S Micro 型超高效液相色谱串联三重四极杆质谱联用仪(沃特世科技(上海)有限公司);Triple TOF™5600+型液相色谱串联飞行时间质谱联用仪(美国AB SCIEX 公司);FA-25 型高剪切分散乳化机(德国FLUKO 公司);JN25-12D 型超声波清洗仪(宁波江南仪器厂);Talboys 数显型涡旋混合器(美国Henry Troemn 公司);TDL-40B 型台式离心机(上海安亭科学仪器厂);N-EVAP111 氮吹仪(美国Organomation 公司)。
甲酸和乙腈(色谱纯,德国默克公司);丙酮(分析纯,上海凌峰化学试剂有限公司);乙腈(分析纯,西陇科学股份有限公司);C18吸附剂(46~60 μm)和Florisil 吸附剂(100~200 目,即筛孔0.154~0.075 mm)(天津Agela 生物技术有限公司);氯氟醚菌唑标准品(纯度≥93.0%,德国Dr.Ehrenstorfer GmbH 公司);氯氟醚菌唑对映体(纯度≥99.9%,上海勤路生物技术有限公司)。
1.2 供试生物预培养
野生型品系斑马鱼成鱼(3 月龄,体长1.5~2.5 cm)购自南京市夫子庙花鸟鱼虫市场,在实验室条件下用脱氯自来水驯化培养14 d,水温(24±1)℃,pH=7.5±0.5,光暗周期为14 h∶10 h,水中溶解氧浓度≥60%,自然死亡率低于5%方可开展实验。
1.3 实验方法
1.3.1 急性毒性试验
参照国家标准《化学农药环境安全评价实验准则 鱼类急性毒性试验》(GB/T 31270.12-2014)[10]和OECD 指南203 试验准则[11]开展氯氟醚菌唑对斑马鱼成鱼的96 h 急性毒性试验。根据前期预实验结果,选取致死率在10%~90%范围的剂量进行正式实验。Rac-氯氟醚菌唑、R-氯氟醚菌唑和S-氯氟醚菌唑的暴露浓度分别设置6 档浓度梯度,每个浓度处理组随机置入10 条斑马鱼,另设空白对照和0.1%丙酮溶剂对照组,每个实验组设置3 个重复。实验周期为96 h,观察并记录斑马鱼死亡数并及时清除死鱼,使用DPS 7.05 计算半数致死浓度(LC50)。
1.3.2 斑马鱼生物富集和代谢清除试验
参照GB/T 31270.7-2014[10]和OECD 指南305 试验准则[12]开展氯氟醚菌唑在斑马鱼体内的对映体选择性生物富集和代谢清除试验。根据急性毒性试验结果的1/10 和1/100,设置20 和200 μg/L 外消旋体浓度暴露组,另设0.1%丙酮对照组,每个实验组放置200 条斑马鱼,不设重复。药剂暴露14 d 后,将所有实验组更换为清水进入7 d 代谢清除阶段,整个实验阶段每24 h 更换50%的培养溶液。分别于暴露2 h、1 d、3 d、5 d、7 d、10 d 和14 d 后,以及代谢清除开始后2 h、6 h、12 h、1 d、3 d、5 d 和7 d,从各实验组随机取10~12 条斑马鱼,流水反复冲洗,用滤纸吸取表面水分后于–80 ℃冻存。同时于暴露阶段各取样时间点取5 mL 暴露水样于–20 ℃保存。
1.3.3 氯氟醚菌唑对映体含量测定
Li 等[13]利用超高效液相色谱-串联质谱(UPLC-MS/MS)结合Chiralpak IG-3 手性色谱柱实现了氯氟醚菌唑对映体的基线分离,并通过旋光仪和电子圆二色谱确定了氯氟醚菌唑对映体的旋光性和绝对构型。本研究在此基础上测定斑马鱼和水样中的氯氟醚菌唑对映体的含量。
1.3.4 仪器条件
液相色谱条件 Chiralpak IG-3 手性色谱柱,柱温35 ℃;流动相为0.1%甲酸-乙腈(10∶90,V/V)混合溶液,流速0.5 mL/min;进样量2 μL。
质谱条件 毛细管电压为2.56 kV;去溶剂温度为550 ℃;离子源温度为500 ℃;去溶剂气(氮气)流速为650 L/h;电喷雾正离子(ESI+)多反应监测模式;母离子m/z398.3,子离子m/z70.0 和m/z182.2,锥孔电压为23 V,碰撞能量为21 eV。
1.3.5 样品前处理
斑马鱼样品前处理 准确称取0.50 g 经液氮粉碎的斑马鱼样品,加入1 mL 水和5 mL 乙腈,涡旋5 min、超声10 min,加入1 g NaCl,涡旋2 min,4000 r/min 离心5 min,经C18和Florisils 净化后,氮吹至近干,加入1 mL 乙腈,经0.22 μm 有机滤膜过滤后进行UPLC-MS/MS 分析。
水样前处理 准确量取5 mL 水样,加入20 mL 乙腈,振荡5 min,加入3.0 g NaCl,涡旋2 min,离心5 min,上清液过0.22 μm 有机滤膜后进行UPLC-MS/MS 分析。
1.3.6 方法验证
准确称取氯氟醚菌唑外消旋体标准样品0.0101 g,用乙腈配制成1000 mg/L 标准母液,梯度稀释成0.2~1000 μg/L 的系列标准工作溶液。根据1.3.5 节的方法制备空白基质样品,分别使用0.2~1000 μg/L 标准工作溶液配制成基质标准溶液,在1.3.4 节的仪器条件下进行测定。绘制溶剂标准曲线和各基质匹配标准曲线,并根据斜率比评价基质效应[14]。
在空白样品中添加4 个浓度水平(2、10、100 和1000 μg/kg)的氯氟醚菌唑对映体标准溶液,每个添加浓度设5 个重复。按照1.3.5 节的方法提取净化后进行UPLC-MS/MS 分析,计算回收率,评价其准确度和精密度,并分别考察方法的日间精密度和日内精密度[14]。
1.3.7 氯氟醚菌唑在斑马鱼体内代谢产物鉴定
斑马鱼样品按照1.3.5 节的方法前处理后,采用液相色谱-串联飞行时间质谱(LC-Q-TOF-MS/MS)对代谢产物进行分析鉴定[15-16]。
液相色谱条件 Poroshell 120 EC-C18色谱柱(50 mm×2.1 mm,2.7 μm),流动相为0.1%甲酸-乙腈混合溶液,流速为0.2 mL/min,进样量为20 μL,柱温为40 ℃。梯度洗脱程序为:0~5 min,5%乙腈;6~20 min,5%~30%乙腈;21~30 min,30%~95%乙腈;31~35 min,95%乙腈;36~38 min,95%~5%乙腈;36~38 min,5%乙腈。
高分辨质谱条件 采用ESI+扫描模式,扫描范围为m/z50~1000;毛细管电压为5.5 kV;离子源温度为550 ℃;雾化气流量为650 L/h;锥孔电压为30 V;碰撞能量为40 eV;雾帘气压为35 psi(1 psi=6.895 kPa)。利用PeakView 1.2 软件根据精确分子质量信息及二级质谱图等特征信息对实验样品中的氯氟醚菌唑及其代谢产物进行定性分析。
1.3.8 数据处理
农药化学品的生物富集能力通常通过生物富集系数(BCF)进行评估,当农药化学品在生物体与环境中达到平衡时,两者浓度之比即为稳态生物富集因子(BCFss),计算公式见式(1):
其中,Cf为达到稳态时斑马鱼体内氯氟醚菌唑对映体的浓度(mg/kg),Cw为达到稳态时水中氯氟醚菌唑对映体的浓度(mg/L)。
在代谢清除阶段,根据斑马鱼体内氯氟醚菌唑对映体的残留浓度随时间的变化关系拟合一级动力学方程(式(2)),代谢半衰期(T1/2)通过式(3)计算:
其中,Ct为取样时间点为t时样品中氯氟醚菌唑对映体的质量浓度(mg/kg),C0为氯氟醚菌唑对映体的初始质量浓度(mg/kg),k为代谢速率常数。
采用对映体分数(Enantiomeric fraction,EF,式(4))[17]作为评价氯氟醚菌唑对映体选择性降解行为的指标。
其中,CR和CS分别为样品中R-氯氟醚菌唑和S-氯氟醚菌唑的浓度(mg/kg)。EF 值为某一对映体含量占消旋体含量的比值,取值范围为0~1,通常用小数表示。EF=0.5 时,表示生物体内两对映体含量相同;EF 偏离0.5 时,表明该手性农药发生了对映体选择性降解行为。
2 结果与讨论
2.1 UPLC-MS/MS分析方法评价
在1.3.4 节的UPLC-MS/MS 条件下,氯氟醚唑对映体在IG-3 手性柱上的流出顺序为R-(-)-氯氟醚菌唑和S-(+)-氯氟醚菌唑。标准色谱图见图1。

图1 氯氟醚菌唑对映体的分离色谱图Fig.1 Chromatogram of enantioseparation of mefentrifluconazole
斑马鱼空白样品中,氯氟醚菌唑对映体出峰时间处均无干扰峰。氯氟醚菌唑对映体在溶剂和各基质中的线性回归方程和基质效应见表1。在0.2~1000 μg/L 浓度范围内,溶剂标准曲线和基质标准曲线线性良好(R2>0.9932),LOQ 为2 μg/kg。分析结果表明,基质斜率与溶剂斜率之比在0.8~1.2 之间,说明氯氟醚菌唑的基质效应不明显,可采用溶剂标准曲线进行定量检测。

表1 超高效液相色谱-串联质谱法测定斑马鱼中氯氟醚菌唑对映体的线方程、基质效应及灵敏度Table 1 Linearity,matrix effects and sensitivity for determination of mefentrifluconazole enantiomers in zebrafish by ultra-high performance liquid chromatography-tandem mass spectrometry
在2、10、100 和1000 μg/kg 添加水平下,平均回收率为75.0%~106.1%,RSDs 为0.6%~8.2%(电子版文后支持信息表S1)。本方法满足氯氟醚菌唑对映体在水和斑马鱼体内的检测要求。
2.2 氯氟醚菌唑对斑马鱼的对映体选择性毒性
氯氟醚菌唑对斑马鱼的96 h 急性毒性试验结果见表2,氯氟醚菌唑外消旋体及其对映体对斑马鱼的毒性顺序为S-氯氟醚菌唑(LC50=1.68 mg/L)>Rac-氯氟醚菌唑(LC50=2.42 mg/L)>R-氯氟醚菌唑(LC50=3.33 mg/L),S-氯氟醚菌唑的毒性分别是R-氯氟醚菌唑和Rac-氯氟醚菌唑的2.0 倍和1.4 倍。根据国家标准GB/T 31270.7—2014[10]中农药对鱼类毒性的等级划分标准,氯氟醚菌唑外消旋体及其对映体对斑马鱼为中等毒性。此实验结果与文献[9,18]的研究结果一致,氯氟醚菌唑对土壤生物赤子爱胜蚓和水生生物斑马鱼均表现为S-氯氟醚菌唑比R-对映体具有更高的毒性。
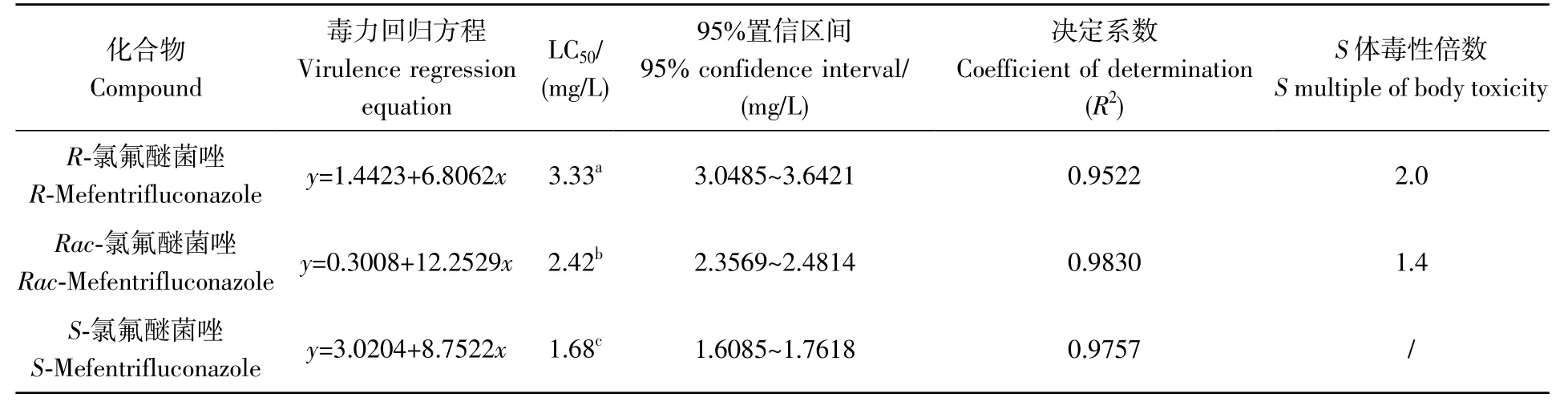
表2 氯氟醚菌唑及其对映体对斑马鱼的96 h急性毒性Table 2 Acute toxicity of mefentrifluconazole and its enantiomers to zebrafish in 96 h
2.3 氯氟醚菌唑在斑马鱼体内的对映体选择性生物富集和代谢
如图2 所示,两种暴露浓度下的斑马鱼体内氯氟醚菌唑对映体含量变化趋势相同。在暴露期间,水体中氯氟醚菌唑浓度基本保持稳定,而斑马鱼样品中两对映体浓度在暴露开始3 d 内迅速积累到最大值后再降低,然后缓慢上升并趋于稳定。
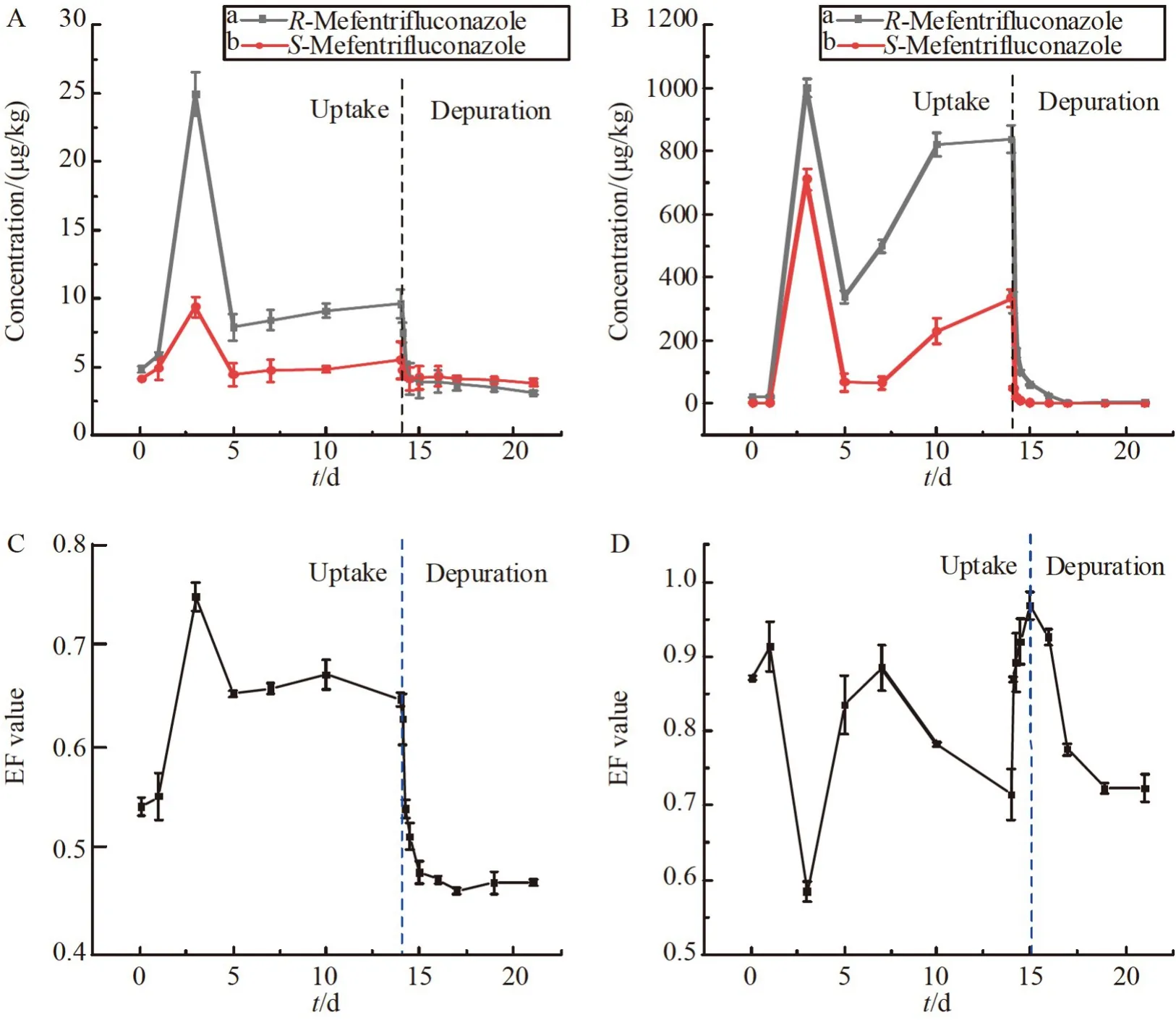
图2 氯氟醚菌唑对映体在斑马鱼体内的对映体选择性生物富集和代谢及其对映体分数(EF)值变化:(A)氯氟醚菌唑暴露浓度为20 μg/L 时,对映体的选择性生物富集和代谢;(B)氯氟醚菌唑暴露浓度为200 μg/L 时,对映体的选择性生物富集和代谢;氯氟醚菌唑暴露浓度分别为(C)20 μg/L 和(D)200 μg/L时,EF 值的变化图Fig.2 Enantioselective bioaccumulation and elimination of mefentrifluconazole and enantiomeric fraction(EF)values in zebrafish:(A)Enantioselective bioconcentration and metabolism of mefentrifluconazole at an exposure concentration of 20 μg/L;(B) Enantioselective bioconcentration and metabolism of mefentrifluconazole at an exposure concentration of 200 μg/L;Changes in EF values when exposure concentrations of mefentrifluconazole are (C) 20 μg/L and (D) 200 μg/L,respectively
在同一浓度处理组,斑马鱼体内R-氯氟醚菌唑浓度始终高于S-氯氟醚菌唑,显著性分析结果表明,氯氟醚菌唑在斑马鱼体内存在显著的对映体选择性吸收现象,表现为R-氯氟醚菌唑优先被富集(p<0.05)。结合图2C 和图2D 中的富集阶段,在两种处理浓度下EF 值始终大于0.5,并且在高浓度处理组中EF 值偏离0.5 的程度更高,表明R-氯氟醚菌唑在高浓度暴露下具有更强的选择性富集能力。进一步计算得到表3 中两对映体在低浓度处理下的BCFss分别为1.02 和0.62,在高浓度处理下的BCFss分别为8.38 和3.41,R-氯氟醚菌唑的BCFss分别为S-氯氟醚菌唑的1.64 和2.46 倍,并且较高的暴露浓度可能导致生物富集程度增加。

表3 氯氟醚菌唑对映体的动力学参数和稳态生物富集因子(BCFss)值Table 3 Kinetic parameters and bioconcentration factors in the steady state (BCFss) values of mefentrifluconazole enantiomers
在清除阶段,斑马鱼体中的R-氯氟醚菌唑和S-氯氟醚菌唑在2 d 内迅速被机体代谢,浓度随时间的变化关系可通过一级毒力学方程拟合,相关参数及半衰期列于表3。结果表明,低浓度处理时斑马鱼体内两对映体之间存在显著的代谢速率差异(p<0.05),R-氯氟醚菌唑和S-氯氟醚菌唑半衰期分别为0.83和1.19 d,表现为斑马鱼对R-氯氟醚菌唑具有更大的清除速率常数和较短的半衰期,其EF 值逐渐变小(图2C)。但是,高浓度处理组中两对映体在清除阶段半衰期均为0.44 d,不存在对映体选择性代谢行为。
虽然富集阶段的变化规律不完全符合一级动力学模型,但与文献报道过的其它化合物(如戊唑醇[19]、氟环唑[20]等)在斑马鱼体内的富集规律相似。文献[19,21]的研究结果表明,戊唑醇和己唑醇在成年斑马鱼中均显示出显著的对映选择性生物富集行为。戊唑醇和己唑醇对映体之间表现为R-体优先被富集,在代谢清除阶段表现出S-体优先被代谢。此外,Zhang 等[22]从对映体水平研究了经不同浓度药剂暴露的成年斑马鱼生物体对丙硫菌唑及其代谢物的对映体选择性吸收和代谢行为。结果表明,不同浓度暴露下,对映体之间均表现为S-体优先被富集而代谢阶段无对映体选择性。推测手性农药化合物在斑马鱼体内富集阶段的含量变化受富集行为和代谢行为共同作用。
2.4 氯氟醚菌唑在斑马鱼体内的代谢途径
采用LC-Q-TOF-MS/MS 分别对氯氟醚菌唑在斑马鱼体内的代谢产物进行了鉴定分析,氯氟醚菌唑及其代谢物的提取离子色谱图和特征碎片离子比对结果见电子版文后支持信息图S1,相关代谢物的分子式及特征性质谱信息见电子版文后支持信息表S2。
母体氯氟醚菌唑出峰时间为10.33 min,m/z398.0877,二级质谱中产生的m/z70.0425 特征碎片离子(电子版文后支持信息图S1A)为三唑氮环的离子。在斑马鱼样品中,共鉴定出8 种氯氟醚菌唑的代谢产物,其中包括3 种Ⅰ相代谢物和5 种Ⅱ相结合物。
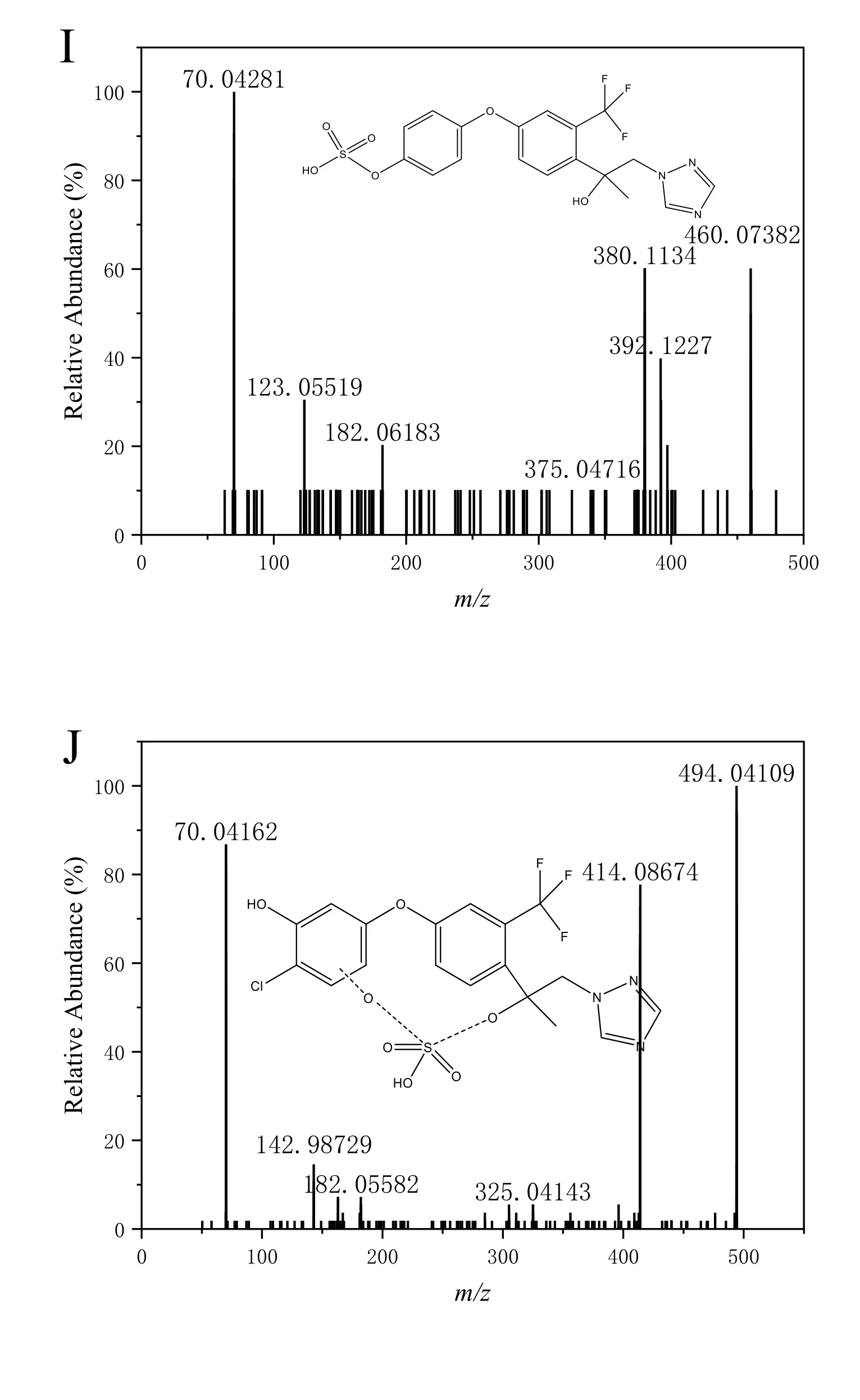
代谢物1#(m/z288.0955)在5.80 min 处出峰,此化合物由母体化合物苯环上C—O 键断裂产生,结合二级质谱图碎片离子m/z199.0585 与此结构中断开C—C 键和C—F 键后的结构质荷比一致,推断代谢物1#为M003(电子版文后支持信息表S2,电子版文后支持信息图S1B)。代谢物2#(m/z414.0826)在9.09 min 处出峰(电子版文后支持信息表S2),此化合物由母体化合物含Cl 苯环的邻、间位羟基化形成代谢物M016 或M017(电子版文后支持信息图S1C),也可以由母体化合物甲基羟基化反应形成代谢物M039(电子版文后支持信息图S1D),还可以由母体化合物三唑氮环的羟基化反应形成M086(电子版文后支持信息图S1E)。代谢物3#(m/z414.0934)在9.16 min 处出峰,此化合物由母体化合物甲基羟基化反应形成代谢物M039 后进一步在含Cl 苯环的邻、间位引入羟基形成,结合二级质谱图碎片离子m/z70.0427 和295.1744 与此结构中断键后的结构质荷比一致,推断代谢物3#为M074(电子版文后支持信息表S2,电子版文后支持信息图S1F)。
结合物1#(m/z368.0525)在4.88 min 处出峰,此化合物由母体代谢生成代谢物M003 后,在磺基转移酶的作用下发生硫酸化反应生成硫酸酯化合物,二级质谱中脱硫酸基形成特征碎片离子m/z288.0969,因此推断结合物1#为M071(电子版文后支持信息表S2,电子版文后支持信息图S1G、S1H)。结合物2#(m/z460.0786)在6.94 min 处出峰,此化合物由母体经脱氯羟基化后,酚羟基在磺基转移酶的作用下发生硫酸化反应生成硫酸酯化合物,二级质谱中脱硫酸基形成特征碎片离子m/z380.1225,推断结合物2#为M092(电子版文后支持信息表S2,电子版文后支持信息图S1I)。类似地,结合物3#(m/z494.0395)在7.49 min 处出峰,结合物4#(m/z510.0343)在7.88 min 处出峰,两种化合物均由母体经羟基化后,继而在磺基转移酶的作用下发生硫酸化反应生成硫酸酯化合物,二级质谱中脱硫酸基分别形成特征碎片离子m/z414.0855 和m/z430.0814,因此推断结合物3#为M072/M060(电子版文后支持信息表S2,电子版文后支持信息图S1J 和图S1K)、结合物4#为M057/M090(电子版文后支持信息表S2,电子版文后支持信息图S1L 和图S1M)。结合物5#(m/z590.1143)在7.21 min 处出峰,此化合物由母体代发生羟基化反应后,在葡萄糖醛酸糖基转移酶的作用下与葡萄糖醛酸结合生成葡萄糖醛酸络合物,二级质谱中脱硫酸基形成特征碎片离子m/z414.0852,因此推断结合物5#为M035/M045(电子版文后支持信息表S2,电子版文后支持信息图S1N)。
本研究初步鉴定获得3 种Ⅰ相代谢物和5 种Ⅱ相结合物,首次在斑马鱼体内鉴定出了羟基化代谢物M074 和葡萄糖醛酸络合物M035、M045 以及硫酸酯化合物M057、M071。代谢物M003 被报道为氯氟醚菌唑在地表水和沉积物中的主要代谢产物,而M016/M017 被报道为大鼠体内主要的代谢产物[7],并鉴定出主要Ⅱ相代谢物M072 为硫酸酯化合物[7]。根据质谱分析获得的代谢产物信息,进一步推测了氯氟醚菌唑在斑马鱼体内可能的代谢途径(图3)。结果表明,氯氟醚菌唑的羟基化作用为主要的Ⅰ相代谢途径,进而在磺基转移酶和葡萄糖醛酸糖基转移酶的作用下形成水溶性更强的Ⅱ相代谢产物而排出体外。

图3 氯氟醚菌唑在动物代谢中的Ⅰ相和Ⅱ相代谢途径。图中虚线箭头标注的产物为推断的可能产生的中间产物,但实际样品中未检测到Fig.3 Phase Ⅰand phase Ⅱmetabolic pathways of mefentrifluconazole in animals.The products labeled with dashed arrows in the figure are inferred possible intermediates that are not detected in the actual samples
3 结论
本研究探究了氯氟醚菌唑对水生斑马鱼的对映选择性毒性及富集代谢行为。氯氟醚菌唑对斑马鱼为中等毒性,在斑马鱼体内属于低富集农药,R-氯氟醚菌唑优先被富集;初步鉴定获得3 种Ⅰ相代谢物和5 种Ⅱ相结合物,其中,羟基化代谢物M074 和葡萄糖醛酸络合物M035、M045 以及硫酸酯化合物M057、M071 为首次鉴定。羟基化作用为其主要的Ⅰ相代谢途径,进而在磺基转移酶和葡萄糖醛酸糖基转移酶的作用下形成水溶性更强的Ⅱ相代谢产物而排出体外。本研究可为氯氟醚菌唑对水生环境中的生物安全及人类健康风险评估提供参考依据,但推测的代谢产物需要进一步验证,代谢物的毒性有待进一步了解。
支持信息
Supporting Information
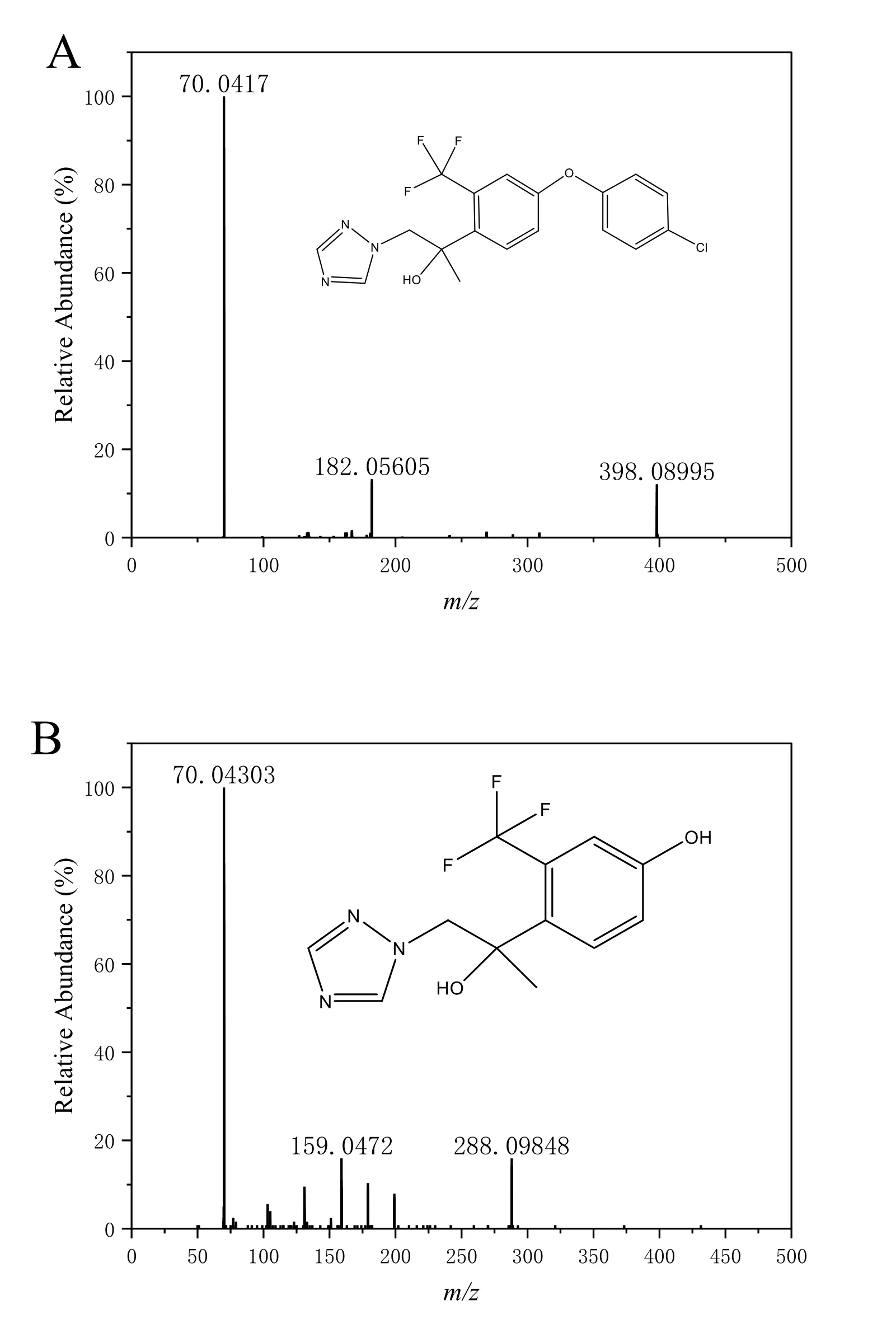


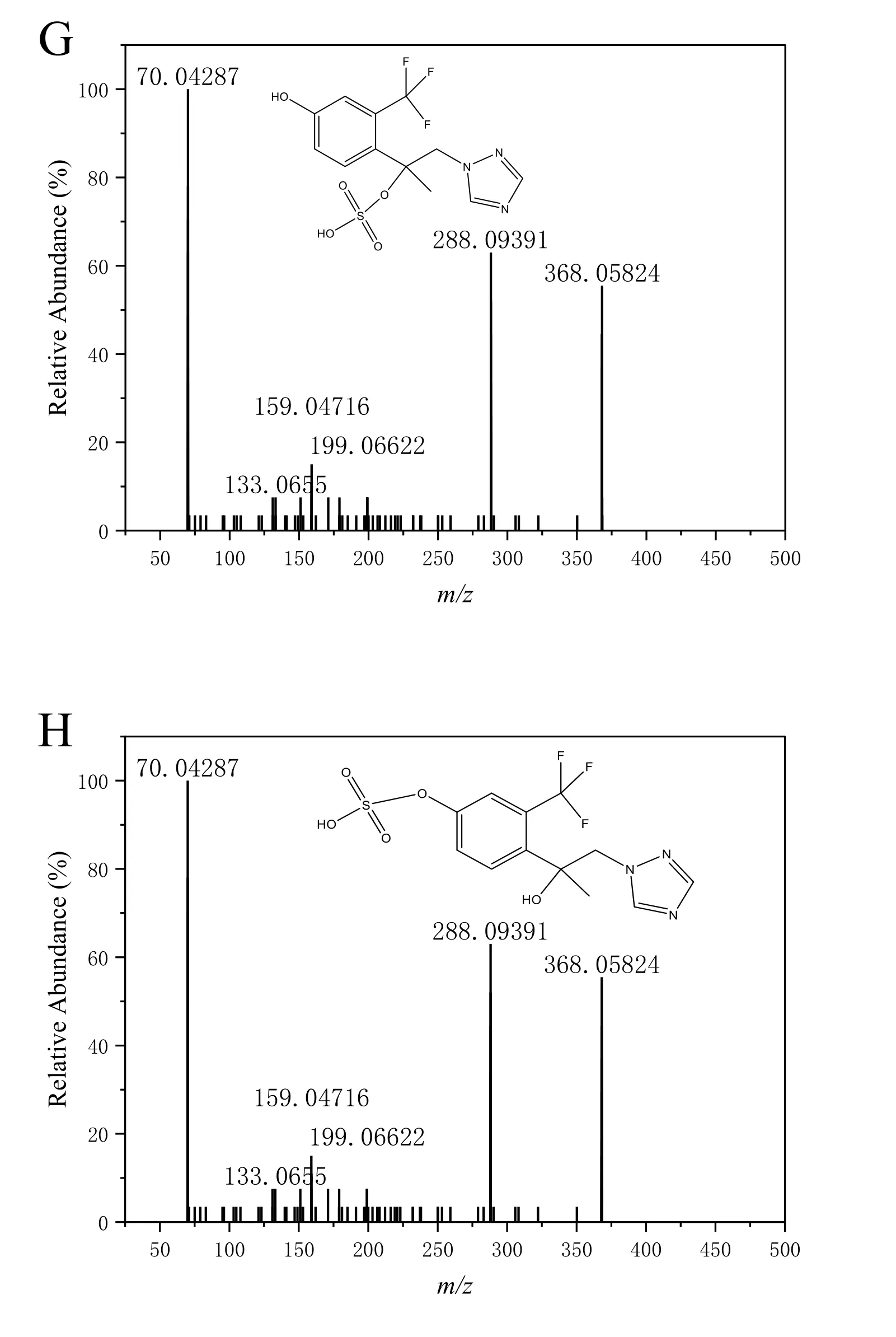


图S1 氯氟醚菌唑及其代谢产物的二级质谱图Fig.S1 MS2 spectra of mefentrifluconazole and its metabolites in animals

表S2 氯氟醚菌唑及其代谢产物质谱信息Table S2 Information of mass spectrometric data for mefentrifluconazole and its metabolites
