淫黄葛合剂对APPswe/PS1dE9小鼠行为及海马胱氨酸/谷氨酸反向转运体的影响
2023-11-10张天赐贺小平孙宁宁李佳明林一璨董贤慧
张天赐,贺小平,刘 珊,孙宁宁,李佳明,林一璨,董贤慧
(河北中医药大学, 河北省心脑血管病中医药防治研究重点实验室,河北 石家庄 050091)
阿尔茨海默病(Alzheimer′s disease, AD)是以学习记忆能力下降及自主探索行为减少为主要临床表现的中枢神经系统退行性疾病[1],随着老龄化进程的加快,逐渐增多的AD患者给家庭与社会带来了沉重负担。近年来研究发现,胱氨酸/谷氨酸反向转运体(cystine/glutamate antiporter, systemXc)从维持细胞外谷氨酸浓度、降低神经元对Aβ的敏感毒性、抑制铁死亡等角度减轻AD损伤[2],是AD的潜在治疗靶点。SystemXc是位于细胞膜表面的异二聚体蛋白,由溶质载体家族7成员11(solute carrier family 7 member 11, SLC7A11)与溶质载体家族3成员2(solute carrier family 3 member 2, SLC3A2)共同组成[3],可以按照1 ∶1的比例交换细胞内外的胱氨酸和谷氨酸,SLC7A11也是最新发现的识别AD的生物标志物之一。因此,检测海马SLC7A11与SLC3A2的表达水平对于探讨药物对AD疗效有一定的实际意义。
现阶段AD治疗药物匮乏,临床疗效并不理想,而中药多靶点、多角度的治疗AD的特点逐渐受到重视。淫羊藿苷、黄芪甲苷、葛根素是中药淫羊藿、黄芪、葛根的有效组分。前期研究基础提示,淫羊藿苷、黄芪甲苷、葛根素组成的淫黄葛合剂可以减少APPswe/PS1dE9小鼠大脑皮质老年斑的沉积,降低神经元的损伤,但是其具体作用机制有待进一步探讨。因此,本实验以APPswe/PS1dE9双转基因小鼠为AD动物模型,通过检测海马SLC7A11、SLC3A2蛋白与mRNA的表达,初步探讨淫黄葛合剂改善APPswe/PS1dE9小鼠行为学表现的机制,为AD的治疗与用药提供新方法。
1 材料与方法
1.1 实验动物、试剂与仪器
1.1.1实验动物 APPswe/PS1dE9小鼠动物购自北京华阜康生物科技股份有限公司,许可证编号为:SCXK(京)2019-0008。所有实验经过河北中医学院动物伦理委员会与河北中医学院实验动物中心批准,许可证号为SYXK(冀)2017-0005,保持12 h明暗周期,25 ℃室温,50%湿度,所有动物单笼喂养及饮水。
1.1.2主要试剂与仪器 黄芪甲苷、淫羊藿苷、葛根素、地拉罗司(deferasirox, DFX)购自大连美仑(MB1955-1、MB2189、MB6183-1、MB1208-2),含量均≥97%;Prestained Protain MarkerⅡ(10-200KDA)、Anti-beta Actin Rabbit pAb(武汉赛维尔,G2058、GB11001);PageRulerTM预染蛋白分子量标准(10-180 ku)(Thermo Fisher Scientific,26616);Blue Plus®V Protein Marker (10-190 ku)(北京全式金,DM141-01);辣根过氧化物酶标记山羊抗兔IgG (H+L)(江苏碧云天,A0208);SLC7A11/XCT Polyclonal Antibody19 Publications(武汉三鹰,26864-1-AP);4F2hc/CD98 Rabbit Polyclonal Antibody(江苏碧云天,AF6444);Alexa Fluor®594标记山羊抗兔IgG (H+L)(中杉金桥,ZF-0516);总RNA提取试剂盒(北京天根,DP419);PrimeScriptTMRT rengeat KIT with gDNA Eraser、TB GreenTMPremix EX TapTMⅡ(TaKaRa,RR407A、RR820A)。QuantStudio5荧光定量PCR仪(美国Thermo Fisher公司)、RM2255全自动轮转切片机(德国Leica公司)、DM5000B型荧光显微镜(德国Leica公司)。
1.2 方法
1.2.1动物分组及干预 6只8月龄雄性C57BL/6J小鼠为正常组,18只8月龄雄性APPswe/PS1dE9小鼠每组6只,随机分为模型组、合剂组、DFX组。所有实验动物给药至10月龄,每日灌胃1次。正常组和模型组小鼠给予等量蒸馏水灌胃。合剂组根据徐叔云主编《药理实验方法学》以临床3倍药量给药,以淫羊藿苷、黄芪甲苷、葛根素配制为淫黄葛合剂(淫羊藿苷、黄芪甲苷、葛根素给药量为120 mg·kg-1、80 mg·kg-1、80 mg·kg-1)灌胃,DFX组以DFX灌胃,剂量为100 mg·kg-1。
1.2.2行为学测试 用药结束后,采用八臂迷宫实验检测各组小鼠空间、学习记忆能力。八臂迷宫是由一中央圆形平台放射出的等分八臂式旱迷宫。八臂迷宫实验前对所有小鼠称量体质量并记录,禁食24 h,此后在每天的八臂迷宫训练结束后限制性的给予正常饲料,使小鼠体质量维持在正常进食小鼠的75%~80%。实验为期7 d。d 1~3在迷宫各臂尽头及中央区分撒适量正常饲料颗粒,同时将4只动物置于迷宫中央区,而后打开各臂门,让所有小鼠自由摄食、探索10 min以适应迷宫环境。d 4~5,取出中央区食物,在各臂尽头分撒适量正常饲料颗粒,所有动物进行单独训练,每天2次。d 6后,将八臂迷宫所有臂进行编号,随机选取4个臂,在臂尽头分撒适量正常饲料颗粒,关闭各臂门。每次将一只实验小鼠放置在迷宫中央区,30 s后打开所有臂门,让小鼠在迷宫中自由活动并摄食,直至动物吃完所有4个臂的食物。如果在10 min测试时间内食物仍未吃净,则实验终止,每只小鼠结束测试后,清除迷宫底部粪便与尿液,并用75%酒精擦拭整个迷宫及隔板,避免气味干扰。待酒精全部挥发后进行下一组小鼠实验。进入放有食物臂视为正确,应用SMART 3.0软件记录并分析所有动物迷宫内行动轨迹、总正确次数、工作记忆错误次数、参考记忆错误次数。
1.2.3免疫荧光观察海马CA3区SLC7A11、SLC3A2的表达 行为学测试结束后,正常组、模型组各3只小鼠麻醉后4%多聚甲醛经心脏灌注固定,石蜡包埋,切片。滴加1 ∶50稀释后的相应一抗,4 ℃湿盒内过夜。将处理好的切片放入pH 7.4的PBS中充分漂洗,加入1 ∶300稀释后的Alexa Fluor®594标记山羊抗兔IgG(H+L),室温下50 min后封片。每张切片选取3个视野进行显微图像(100倍)采集,采用ImageJ观察并分析海马CA3区SLC7A11、SLC3A2表达与平均荧光强度。
1.2.4Western blot检测海马组织SLC7A11、SLC3A2的蛋白表达水平 各组3只小鼠麻醉后断头取脑,冰上迅速剥离海马,-80 ℃冰箱冻存。提取蛋白,应用BCA蛋白定量试剂盒进行蛋白定量。每组蛋白上样量为60 μg,以60 V,40 min,110 V,90 min电泳条件进行电泳。转移到0.45 μm的PVDF膜上后用5%脱脂奶粉进行2 h封闭。Anti-beta Actin Rabbit pAb(1 ∶1 000)、SLC7A11/XCT Polyclonal Antibody19 Publications(1 ∶1 000);4F2hc/CD98 Rabbit Polyclonal Antibody(1 ∶1 000)4 ℃孵育过夜,TBST洗膜3次,室温孵育二抗1.5 h,TBST洗膜3次发光。采用ImageJ软件进行光密度值测量分析。
1.2.5Real time q-PCR检测海马组织SLC7A11、SLC3A2的mRNA表达水平 海马组织放入低温组织研磨仪中研碎,总RNA提取试剂盒进行RNA提取,超微量分光光度计检测RNA浓度。按照PrimeScriptTMRT rengeat KIT with gDNA Eraser 取1 μg总RNA进行反转录。引物由苏州金唯智生物科技有限公司合成,引物序列见Tab 1。以10倍梯度稀释cDNA样本,上下游各取0.8 μL引物,按照TB GreenTMPremix EX TapTMⅡ说明书进行操作,反应总体系为20 μL,目的基因表达相对数量用2-△△CT表示。

Tab 1 Primer sequence

2 结果
2.1 行为学Fig 1八臂迷宫实验结果显示,与正常组相比,模型组小鼠总正确次数明显减少(P<0.01),工作记忆错误次数、参考记忆错误次数明显增加(P<0.01);与模型组相比,合剂组、DFX组总正确次数增加(P<0.01),工作记忆错误次数、参考记忆错误次数减少(P<0.01);合剂组、DFX组总正确次数、工作记忆错误次数、参考记忆错误次数差异无统计学意义(P>0.05)。
2.2 免疫荧光如Fig 2所示,图片为SLC7A11与SLC3A2蛋白(均为红色荧光)与DAPI(蓝色荧光)复染细胞核后合成得图。与正常组相比,模型组小鼠海马CA3区SLC7A11、SLC3A2表达降低,平均荧光强度下降(P<0.05)。

Fig 1 Eight-arm maze test results of mice in each group

Fig 2 Expression of SLC7A11 and SLC3A2 i n hippocampus of mice in normal and
2.3 Western blotFig 3结果显示,与正常组相比,模型组小鼠海马SLC7A11、SLC3A2表达降低(P<0.05);与模型组相比,合剂组和DFX组SLC7A11、SLC3A2表达均升高(P<0.05);合剂组与DFX组SLC7A11、SLC3A2表达差异无统计学意义(P>0.05)。
2.4 Real time q-PCRFig 4结果显示,与正常组相比,模型组小鼠海马SLC7A11、SLC3A2mRNA表达降低(P<0.05);与模型组相比,合剂组和DFX组SLC7A11、SLC3A2mRNA表达升高(P<0.05);合剂组和DFX组SLC7A11、SLC3A2mRNA表达差异无统计学意义(P>0.05)。

Fig 3 Expression of SLC7A11 and SLC3A2
3 讨论
AD发病受环境、遗传以及个体因素差异影响,以空间、学习记忆能力丧失为主要临床表现。本实验选用的APPswe /PS1dE9双转基因小鼠存在早老素1( presenilin-1, PS1)基因E9缺失,是较为常用的AD转基因动物模型。APPswe /PS1dE9双转基因模型小鼠来源于C57BL/6J小鼠,所以选取C57BL/6J小鼠为正常对照组[4]。
AD发病机制复杂。近年来的研究提示,SystemXc是AD的潜在治疗靶点。SystemXc是由轻链亚基SLC7A11和重链亚基SLC3A2通过二硫键组成的异二聚体,在脑中高度表达,生理功能为维持细胞内外谷氨酸、胱氨酸的交换平衡。SLC7A11与SLC3A2表达降低时将导致谷氨酸过度积累与铁死亡激活,加速AD发病[5]。SLC7A11与SLC3A2表达异常将导致的谷氨酸传递受阻,引起神经元兴奋障碍,最终影响学习与记忆功能。在细胞内部,过量谷氨酸因转出障碍逐渐累积,通过激活12-脂肪氧合酶和环鸟苷酸依赖的Ca2+通道、消耗胞内的谷胱甘肽,导致能量代谢障碍以及促进胞内过氧化物积累导致神经元死亡[6-7];在细胞外部,由于突触间的谷氨酸浓度降低,神经冲动无法正常传导,同时由于胱氨酸摄入抑制将放大胞外非SystemXc释放的谷氨酸介导的神经毒性,进而引起神经元功能障碍及退化,导致神经细胞死亡[8],加重AD认知损伤。另外,SLC7A11与SLC3A2也是铁死亡的负调节基因,在AD中,SLC7A11与SLC3A2表达降低将激活铁死亡过程,并由此抑制弗林蛋白,增强β-分泌酶活性,促进淀粉样前体蛋白(amyloid precursor protein, APP)的淀粉样代谢通路加速Aβ沉积,加重AD病情[9]。SLC7A11与SLC3A2表达降低也将抑制谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)的水平并进一步加重神经元损伤[10]。另外,Lane的最新研究提示,SLC7A11在AD患者血液中的表达水平不受年龄影响,且对AD有超高敏感性,是潜在的AD生物标志物之一[5]。因此,SLC7A11与SLC3A2的表达水平一定程度上反映了AD进程。本实验中八臂迷宫结果提示,与正常组小鼠相比,模型组小鼠总正确次数减少,参考记忆错误次数、工作记忆错误次数均增加,结合免疫荧光结果,模型组小鼠海马CA3区SLC7A11与SLC3A2的表达降低,提示模型小鼠的认知障碍可能与SLC7A11与SLC3A2的表达降低相关。
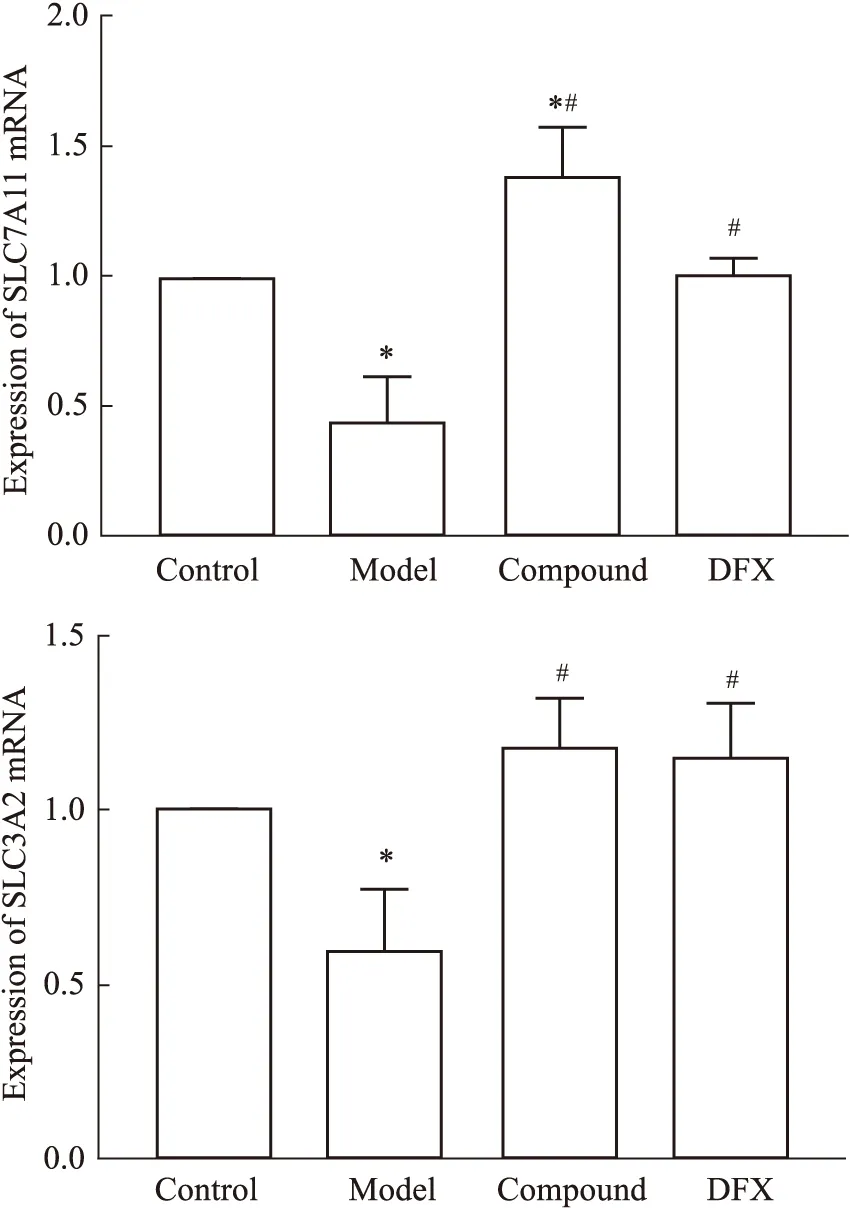
Fig 4 Expression of SLC7A11 SLC3A2 mRNA
AD属中医“痴呆”、“呆病”范畴,是以肾虚精亏,气血不足为本;痰瘀互结,浊毒内生为标的本虚标实之证,治以补肾为主。淫羊藿、黄芪、葛根均是在中医病机理论指导下临床常用的AD治疗药物[11],实验开始前对淫羊藿、黄芪、葛根三药进行了网络药理学分析与分子对接研究也发现三药对AD有直接治疗作用[12]。淫羊藿苷、黄芪甲苷、葛根素是中药淫羊藿、黄芪、葛根的主要有效成分,3种单体组成合剂与传统中药合剂相比,有效成分更加清晰明确且易于质控。现代药理学研究发现,淫羊藿苷[13]、黄芪甲苷[14]、葛根素[15]从抑制氧化应激、促进神经元再生、抑制微管相关蛋白(microtubule-associated protein tau, Tau)异常磷酸化等角度缓解AD发病。前期实验基础也证实,淫黄葛合剂可以缓解APPswe/PS1dE9小鼠皮层神经元肿胀,减少皮质老年斑的沉积,降低神经元的损伤,且合剂效果要强于3药有效成分单独使用[16]。因此,为了进一步明确淫黄葛合剂治疗AD的机制,本实验以SystemXc为切入点,探讨淫黄葛合剂对APPswe/PS1dE9小鼠的行为改善作用以及对海马SLC7A11与SLC3A2的表达影响。DFX可以抑制Aβ沉积改善AD症状[17],促进SystemXc表达[18],因此作为阳性对照药物。本实验中,与模型组相比,合剂组小鼠的行为障碍得到改善,海马中SLC7A11与SLC3A2蛋白及mRNA表达均上升,说明淫黄葛合剂可能通过促进海马SLC7A11、SLC3A2的表达改善模型小鼠的行为障碍。
综上所述,本实验研究淫黄葛合剂对APPswe/PS1dE9小鼠行为及海马SystemXc的影响,结果显示,淫黄葛合剂可以改善APPswe/PS1dE9小鼠行为表现,其机制与促进海马SLC7A11、SLC3A2的表达相关。该研究为AD的治疗与用药提供新的思路与方法。另外,对围绕SLC7A11与SLC3A2发挥抗AD作用的上、下游分子机制的探讨将是下一步的研究方向。
