雷公藤甲素诱导自噬促进人肾小管上皮HK-2细胞凋亡
2023-11-10王春强梁马丹梁泰刚
王春强,云 阳,梁马丹,梁泰刚
(1.山西医科大学第一医院重症医学科,山西 太原 030001;山西医科大学 2.药学院、3.第一临床医学院,山西 晋中 030600)
雷公藤甲素(triptolide,TP)为环氧化二萜内酯类化合物,是卫矛科植物雷公藤的主要活性成分之一。研究表明,TP具有免疫抑制、抗炎和抗肿瘤等多种药理活性[1]。然而,由于其对机体多个重要脏器具有毒性,可导致患者发生严重不良反应,TP的临床应用受到限制。肾毒性作为TP严重的毒副反应之一,已受到广泛关注,尽管大量研究表明凋亡、自噬、炎症和氧化应激等机制参与TP肾毒性的发生发展,其发生机制仍未完全清楚[2-4]。
TP肾毒性的发生与其导致肾脏细胞凋亡密切相关[2-3]。凋亡是由基因控制的细胞自主有序的死亡过程,在维持内环境稳态中具有重要作用,可分为内源性和外源性途径凋亡[5]。其中,前者涉及线粒体凋亡通路,线粒体释放细胞色素C,激活caspase 9,进而催化caspase 3,引发级联反应,最终导致细胞凋亡;另一种途径为外源性凋亡,当Fas、TNF(TNFR)和TRAIL(TRAILR)等死亡受体收到激活信号时,细胞也会发生凋亡[6]。人肾近端小管上皮HK-2细胞来源于正常人肾脏的原发性近端肾小管细胞,通过导入人乳头瘤病毒(HPV16)E6/E7基因而获得,接近原代培养的肾小管上皮细胞功能,常应用于药物的体外肾毒性评估[2-3]。研究表明,TP可在体外通过激活caspase 3途径诱导HK-2细胞凋亡[7]。
自噬是进化上高度保守的分解代谢现象,可将受损的细胞器、错误折叠的蛋白质、细胞中的某些病原体等由双膜小泡包裹,并输送到溶酶体进行降解,是细胞维持自身稳态的重要调节机制[8]。近年来,细胞自噬与凋亡间的调控关系受到广泛关注,自噬对TP诱导细胞凋亡的影响及自噬在TP所致毒副反应中的作用在不同脏器细胞中截然相反。Wei等[9]研究表明,自噬可降低TP诱导的心脏毒性和肝毒性。相反,Chan等[10]研究发现,自噬增强TP对小鼠急性粒-单核白血病细胞系WEHI-3细胞的毒性。因此,研究受TP毒性损伤脏器细胞中自噬与凋亡间的调控关系,并通过对自噬水平的调控可能是降低TP所致毒副反应的可行途径。然而目前,自噬对TP诱导的HK-2细胞凋亡作用以及TP对HK-2细胞自噬的影响仍未见文献报道。
因此,本论文旨在研究TP对HK-2细胞凋亡及自噬的影响,并采用自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)和自噬激动剂雷帕霉素(rapamycin,Rap)进一步探讨自噬对TP所致HK-2细胞凋亡的调控关系,为TP肾毒性的防治提供新思路和理论依据。
1 材料与方法
1.1 药物和试剂TP(JOT-10201)购自成都普菲德公司;吖啶橙(acridine orange,AO)(C11739823)购自麦克林公司;溴化乙锭(ethidium bromide,EB)(Top0236)购自北京博奥拓达公司;3-MA(40214)和Rap(44683)购自MCE公司;一抗caspase 9、Bax、Bcl-2、LC3、p62(SQSTM1)和Beclin 1购自武汉三鹰公司;CCK-8细胞增殖和细胞毒性检测试剂盒购自上海翊圣公司;AnnexinV-FITC/PI细胞凋亡检测试剂盒、BCA试剂盒、超敏ECL化学发光即用型底物和DAPI染色液购自博士德公司;JC-1线粒体膜电位检测试剂盒购自苏州宇恒公司;4%多聚甲醛、0.5% Triton X-100、免疫染色封闭液、免疫染色洗涤液、免疫染色一抗稀释液、免疫染色二抗稀释液、Alexa Fluor 555荧光二抗购自上海碧云天公司。
1.2 仪器恒温细胞培养箱(上海力申科学仪器有限公司);倒置生物显微镜(重庆奥特光学仪器有限公司);全波长多功能酶标仪(美国Thermo公司);流式细胞仪(美国BD公司);台式低速离心机和台式高速冷冻离心机(湖南湘仪公司);倒置荧光显微镜(德国Leica公司);凝胶成像系统(美国BIO-RAD公司);激光扫描共聚焦显微镜(美国Meridian公司)。
1.3 方法
1.3.1细胞培养 人肾近端小管上皮HK-2细胞购自广州吉妮欧生物科技有限公司,由本实验室传代冻存。HK-2细胞在含有10%(V/V)FBS(Gibco)和1%青链霉素混合液的RPMI 1640培养基中,置于37 ℃、5% CO2培养箱中培养,当细胞密度达到80%~90%后,胰蛋白酶消化传代。
1.3.2CCK-8法测定细胞存活率 HK-2细胞(5×107L-1)按照每孔100 μL接种于96孔板中培养过夜。实验分组1:设空白对照组和TP处理组,TP终浓度分别为10、50、100、200、400 nmol·L-1,作用时间24 h;实验分组2:设空白对照组和12、24、36 h TP处理组,TP终浓度为50 nmol·L-1;随后,弃去上清,每孔分别加入100 μL无血清RPMI 1640培养基和10 μL CCK-8试剂,孵育1 h后,用酶标仪在450 nm处测定A值。
1.3.3倒置荧光显微镜观察AO/EB染色细胞形态变化 通过倒置荧光显微镜观察TP诱导及自噬抑制剂3-MA和诱导剂Rap干预下,HK-2细胞凋亡的形态学变化。将HK-2细胞(1×107L-1)接种于6孔板中,每孔2 mL。实验分组1:设空白对照组和TP处理组,TP终浓度为25、50、100 nmol·L-1,作用时间24 h;实验分组2:设空白对照组、TP(50 nmol·L-1)处理组、3-MA(1 mmol·L-1)+TP(50 nmol·L-1)处理组、3-MA(1 mmol·L-1)处理组、Rap(7 nmol·L-1)+TP(50 nmol·L-1)处理组、Rap(7 nmol·L-1)处理组,作用时间24 h;PBS轻轻洗涤2次,加入AO和EB(100 mg·L-1,1 ∶1)混合溶液避光孵育2 min,倒置荧光显微镜观察拍摄。
1.3.4流式细胞术检测细胞凋亡率 HK-2细胞(5×107L-1)于6孔板中培养过夜,每孔2 mL。实验分组同“2.3”,消化并收集细胞,悬浮于PBS中。1 000 r·min-1离心5 min后弃去上清并加入200 μL 1×结合缓冲液、5 μL Annexin V-FITC和10 μL PI试剂,避光孵育15 min后,流式细胞仪检测。
1.3.5线粒体膜电位(mitochondrial membrane potential,MMP)的检测 HK-2细胞(5×107L-1)接种于6孔板培养过夜,每孔2 mL。设空白对照组和TP处理组,TP终浓度为25、50、100 nmol·L-1,作用时间24 h,经胰蛋白酶消化后,PBS洗涤离心,加入JC-1染料,于37 ℃在黑暗中孵育30 min。随后,流式细胞仪检测。
1.3.6免疫荧光检测 HK-2细胞接种于激光共聚焦培养皿中培养过夜,50 nmol·L-1TP处理细胞24 h后,PBS洗涤两次,并在室温下用4%多聚甲醛固定10 min。继而,0.5% Triton X-100(PBS配制)室温处理10~15 min后,PBS洗涤,加入免疫染色封闭液室温封闭60 min,与LC3抗体(1 ∶200)在4 ℃下孵育过夜。免疫染色洗涤液洗涤样品后,与Alexa Fluor 555偶联二抗(1 ∶1 000)于室温下孵育60 min,加入DAPI染色3~5 min,并用PBS洗涤。最后,使用激光共聚焦显微镜观察扫描。
1.3.7蛋白印迹分析 HK-2细胞(5×107L-1)接种于6孔板中培养过夜,每孔2 mL。实验分组1:设空白对照组和TP处理组,TP终浓度分别为25、50、100 nmol·L-1,作用时间24 h;实验分组2:设空白对照组和12、24、36 h TP处理组,TP终浓度为50 nmol·L-1;实验分组3:设空白对照组、TP(50 nmol·L-1)处理组、3-MA(1 mmol·L-1)+TP(50 nmol·L-1)处理组、3-MA(1 mmol·L-1)处理组,作用时间24 h;实验分组4:设空白对照组、TP(50 nmol·L-1)处理组、Rap(7 nmol·L-1)+TP(50 nmol·L-1)处理组、Rap(7 nmol·L-1)处理组,作用时间24 h;收集细胞,提取蛋白并使用BCA试剂盒对蛋白质进行定量。待测样品通过电泳分离并转移到NC膜上。然后,使用5%脱脂牛奶封闭,于4 ℃孵育caspase 9(1 ∶1 000)、Bax(1 ∶2 000)、Bcl-2(1 ∶1 000)、LC3(1 ∶2 000)、p62(SQSTM1)(1 ∶3 000)和Beclin 1(1 ∶2 000)一抗过夜,洗膜后加入二抗,室温孵育1 h。最后,通过凝胶成像系统扫描,采用ImageJ软件分析灰度值。

3 结果
3.1 TP降低HK-2细胞的存活率不同浓度TP处理细胞24 h,与对照组相比,随着TP浓度增加,HK-2细胞的存活率逐渐降低。此外,50 nmol·L-1TP分别处理细胞12、24和36 h,与对照组相比,随着时间增加,HK-2细胞的存活率逐渐降低(Fig 1)。
3.2 TP诱导HK-2细胞凋亡为检测TP是否可诱导HK-2细胞凋亡,采用AO/EB染色法,通过倒置荧光显微镜进行观察HK-2细胞形态。对照组未见凋亡细胞,TP处理组中检测到以黄绿色标记的早期凋亡细胞和以橙色标记的晚期凋亡细胞,随着TP浓度升高,凋亡细胞增加(Fig 2A)。此外,通过流式细胞术进一步对TP诱导HK-2细胞凋亡状况进行检测,不同浓度TP(25、50和100 nmol·L-1)处理细胞24 h后,Annexin V-FITC和PI染色结果显示,随着TP浓度增加,HK-2细胞的凋亡率逐渐上升(Fig 2B-C)。
3.3 TP通过线粒体途径诱导HK-2细胞凋亡流式细胞术检测结果显示,暴露于不同浓度TP 24 h后,随着TP浓度增加,HK-2细胞MMP逐渐下降(Fig 3A-B)。并且,Western blot结果显示,不同浓度TP处理HK-2细胞24 h,随着TP浓度增加,cleaved caspase 9/caspase 9和Bax/Bcl-2比值上调(Fig 3C-E)。
3.4 TP诱导HK-2细胞自噬50 nmol·L-1TP处理HK-2细胞24 h,与对照组相比,TP处理组细胞内LC3Ⅱ荧光强度增强(Fig 4A)。随后,进一步使用Western blot检测TP对细胞自噬相关蛋白LC3、Beclin 1和p62(SQSTM1)表达的影响。不同浓度的TP处理细胞24 h,与对照组相比,p62(SQSTM1)的表达水平随着TP浓度的增加而明显下降,25和50 nmol·L-1TP处理组细胞中LC3Ⅱ/LC3Ⅰ比值和Beclin 1的表达水平增加,然而100 nmol·L-1TP处理组差异无显著性(Fig 4B)。此外,本研究检测了50 nmol·L-1TP分别处理HK-2细胞12、24和36 h后自噬相关蛋白表达的情况。如Fig 4C所示,随着TP处理时间增加,LC3Ⅱ/LC3Ⅰ比值和Beclin 1的表达水平逐渐上升,而p62(SQSTM1)的表达水平逐渐下降。
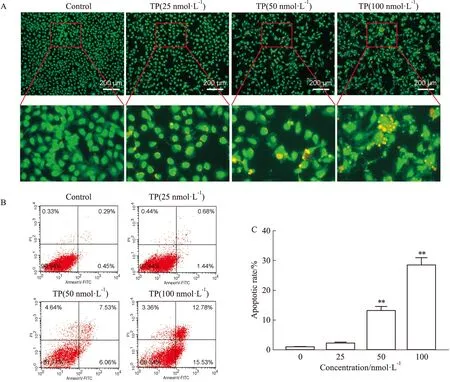
Fig 2 Effects of TP on morphology and apoptosis of HK-2 n=3)
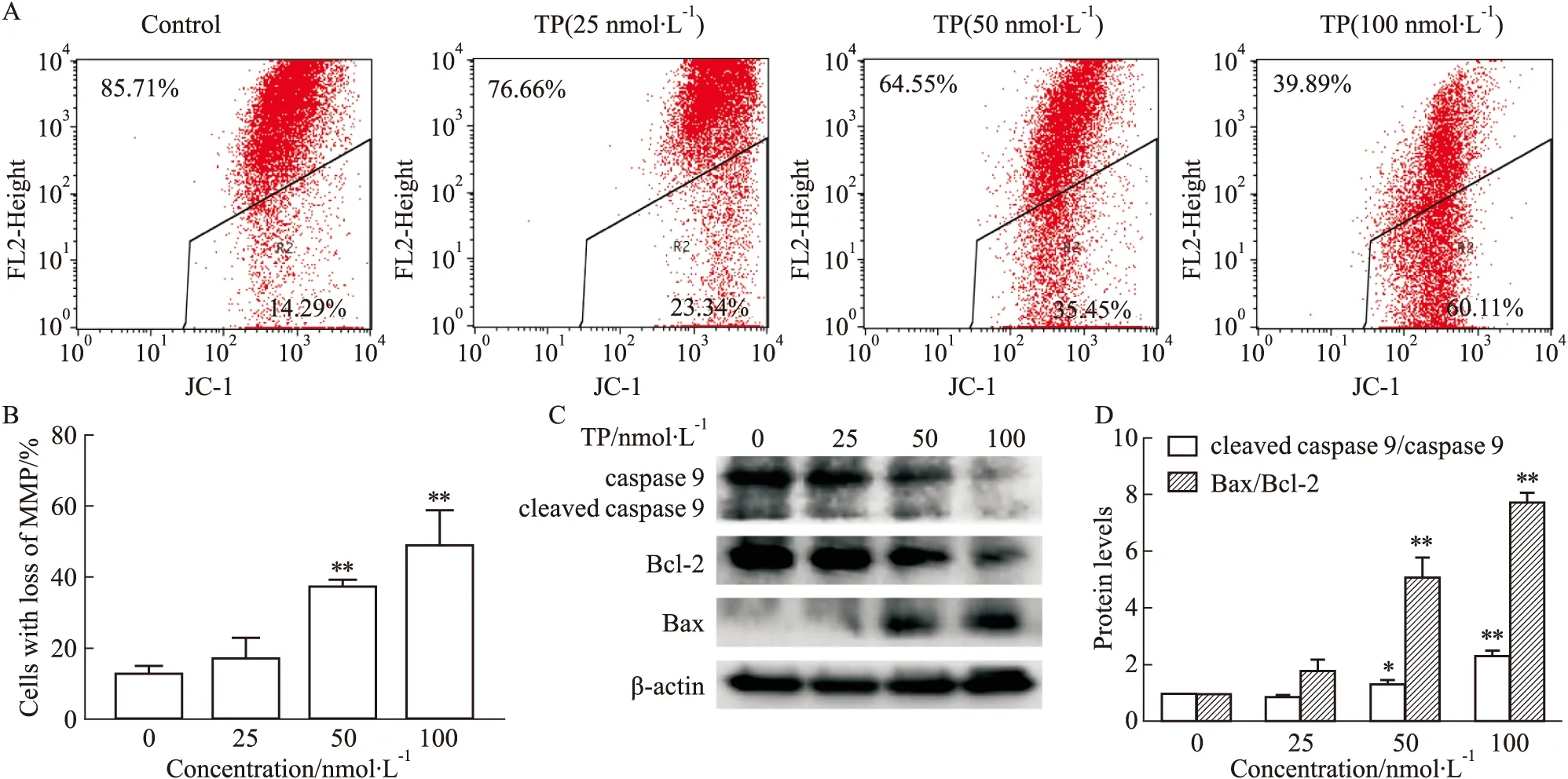
Fig 3 Effects of TP on MMP and expression of apoptosis-related proteins in HK-2 n=3)

Fig 4 Effect of TP on autophagy activity of HK-2 n=3)
3.5 抑制自噬减少TP诱导HK-2细胞凋亡,增强自噬增加TP诱导HK-2细胞凋亡为了探讨自噬对TP诱导HK-2细胞凋亡的影响,采用自噬抑制剂3-MA和自噬激动剂Rap与TP(50 nmol·L-1)分别联用进行探索。如Fig 5A-B所示,1 mmol·L-13-MA降低HK-2细胞LC3Ⅱ/LC3Ⅰ比值,增加p62(SQSTM1)表达;7 nmol·L-1Rap显著增加HK-2细胞内LC3Ⅱ/LC3Ⅰ比值,减少p62(SQSTM1)表达。在后续实验中,我们选择1 mmol·L-13-MA和7 nmol·L-1Rap进行进一步研究。CCK-8结果显示,3-MA+TP组细胞活力高于TP组(Fig 5C),而Rap+TP组细胞活力低于TP组(Fig 5D)。此外,我们通过AO/EB染色和Annexin V-FITC/PI双染法检测3-MA和Rap分别与TP联用后细胞凋亡水平的变化情况。结果显示,3-MA可减少TP诱导HK-2细胞凋亡,Rap增加TP诱导HK-2细胞凋亡(Fig 5E-F)。最后,本研究检测了3-MA和Rap分别与TP联用后cleaved caspase 9和caspase 9蛋白表达水平变化。3-MA+TP组中cleaved caspase 9/caspase 9比值低于单独TP组,而Rap+TP组cleaved caspase 9/caspase 9比值高于TP组(Fig 5G-H)。
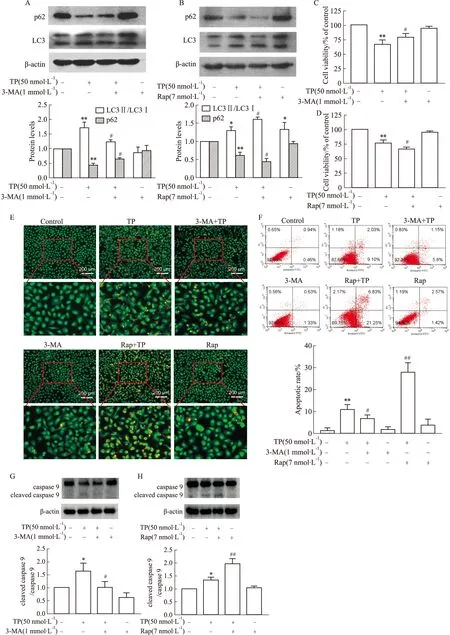
Fig 5 Effects of 3-MA and Rap on TP-induced
4 讨论
药理学研究表明,TP具有肾毒性,可导致HK-2细胞存活率下降,凋亡水平升高[7]。细胞凋亡的主要调节因子包括Bax、Bcl-2、caspase 9和caspase 3等。其中,Bax和Bcl-2可独立调节凋亡,也可通过形成二聚体调节凋亡[11]。Bax表达的上调和Bcl-2表达的下调可刺激线粒体向细胞质释放细胞色素C,进而激活caspase 9和caspase 3,最终导致细胞凋亡[12]。本研究结果表明,TP显著降低HK-2细胞的存活率并诱导其凋亡。为进一步探讨TP调控细胞凋亡的可能机制,本文检测MMP和凋亡相关蛋白Bax、Bcl-2、cleaved caspase 9和caspase 9。HK-2细胞经TP处理后,MMP下降、cleaved caspase 9/caspase 9和Bax/Bcl-2比值上升,表明线粒体凋亡通路可能参与了TP诱导的HK-2细胞凋亡(Fig 3)。
自噬是促进异常细胞凋亡和维持正常细胞稳态必不可少的动态过程。LC3、Beclin 1和p62(SQSTM1)均是细胞内重要的自噬标志蛋白[13]。本研究发现,p62(SQSTM1)的表达水平随着TP浓度的增加而下降,25和50 nmol·L-1TP上调细胞中LC3Ⅱ/LC3Ⅰ比值,并使Beclin 1表达水平升高;但在100 nmol·L-1TP作用时,LC3Ⅱ/LC3Ⅰ比值和Beclin 1表达水平与空白对照组相比无显著性差异。结果表明TP在一定浓度范围内(50 nmol·L-1以内)可促使HK-2细胞自噬水平升高。
Liu等[13]研究表明,自噬水平升高可以减少尿蛋白对肾小管上皮细胞的损伤。与之相反,Melk等人研究表明β-淀粉样肽通过激活自噬促进神经元PC12细胞凋亡[14]。因此,本研究采用自噬抑制剂3-MA和激动剂Rap探索自噬对TP诱导HK-2细胞凋亡的影响。研究发现,与TP组相比,3-MA+TP组HK-2细胞的损伤减弱;而Rap+TP组HK-2细胞的损伤增强(Fig 5)。本研究结果与赵林等[15]研究报道一致,TP可诱导人结肠癌HCT116细胞自噬水平升高,进而促进细胞凋亡的发生,其原因可能为自噬和凋亡间具有协同关系。此外,白利平等[16]研究发现,TP与表皮生长因子受体单克隆抗体西妥昔单抗单独或联合作用于SW480细胞株时,TP可通过抑制mTOR通路诱导细胞自噬性凋亡的发生。本研究表明,自噬和凋亡共同参与TP对HK-2细胞的毒性作用机制,自噬对TP诱导HK-2细胞凋亡具有促进作用。另外,本研究中,100 nmol·L-1TP诱导HK-2细胞凋亡率较25和50 nmol·L-1TP处理组高(Fig 2-3),而100 nmol·L-1TP组自噬水平低于25和50 nmol·L-1TP处理组(Fig 4),这一现象可能由于高浓度(100 nmol·L-1)TP通过影响细胞损伤相关机制,最终导致HK-2凋亡水平升高,确切机制并不十分清楚,有待进一步研究。
综上所述,TP可通过线粒体途径介导HK-2细胞凋亡,诱导HK-2细胞自噬水平升高,并且,抑制自噬可降低TP导致的HK-2细胞损伤。因此,抑制自噬是缓解TP肾毒性的潜在治疗策略。
