宜昌荚蒾叶片诱导愈伤组织及植株再生体系的建立
2023-11-09孙晓慧吕洪岩于晓明董爱新陈甘牛
孙晓慧,吕洪岩,孙 超,于晓明,宋 黎,徐 涛,董爱新,陈甘牛*
(1.烟台市森林资源监测保护服务中心,山东 烟台 264001;2.东阿县林业发展中心,山东 聊城252299;3.山东省林业科学研究院,山东济南 250014)
宜昌荚蒾(Viburnum erosum Thunb.)是忍冬科荚蒾属植物,落叶灌木,在我国华东、华中、西南及陕西、广东、广西均有分布。多生于海拔600—700 m 的山坡林下或灌丛中,枝叶稠密,树冠球形,叶色果色独特。不仅具有较高的观赏价值,还具有很高的药用价值,在园艺观赏及药用等方面都具有很高的开发利用价值[1]。
目前,荚蒾属的繁育方式主要有播种、扦插等[2]。宜昌荚蒾种子小,打破种子休眠所需外部条件苛刻。扦插极不易生根成活,且野生种质资源有限。宜昌荚蒾的繁育极困难,现有的繁育方式难以满足市场的需要,极大阻碍了宜昌荚蒾野生种质资源的保护和开发利用[3-4]。植物组织培养技术具有繁殖系数高、不受季节限制、保持无性系优良特性等优点,是在短期内解决宜昌荚蒾规模化繁育技术难题的有效手段[5]。近年来,荚蒾属植物的组培研究倍受关注,其中鸡树条荚蒾、欧洲荚蒾、地中海荚蒾、香荚蒾等均已进行组培研究获得了再生植株[6-10],但宜昌荚蒾组织培养方面的研究报道比较少。宜昌荚蒾组培快繁主要存在脱分化难以发生、增殖扩繁难以突破、无根苗难以生根的难题。本研究以宜昌荚蒾叶片为外植体,从培养基种类、植物生长调节剂配方等方面,对宜昌荚蒾愈伤组织的诱导、再分化、增殖、生根进行探讨,建立了宜昌荚蒾植株再生体系,为种质资源保护和工厂化育苗提供技术支撑[11]。
1 材料与方法
1.1 试验材料
试验时间为2022 年4 月26 日,试验材料采自山东省烟台市莱山区曲村试验基地多年生宜昌荚蒾植株,剪取当年生颜色淡绿、无病虫害嫩叶为外植体,带回实验室备用。
1.2 方法
1.2.1 无菌体系的建立
选取宜昌荚蒾幼叶,用水冲洗后,再用洗衣粉浸泡15 min,浸泡期间用软毛刷轻柔刷洗,再用流水冲洗4 h,无菌水冲洗1~2 次,移入超净工作台进行外植体消毒处理。采用75%乙醇和0.1%升汞(HgCl2)溶液组合进行消毒处理。用75%的酒精浸泡30 s 后,无菌水冲洗2~3 次,用0.1%的升汞处理5~6 min,用无菌水冲洗4~5次。在培养皿中将叶片剪为0.5 cm×0.5 cm 大小的方块作为外植体,叶背面朝下,接种在诱导培养基上。
1.2.2 宜昌荚蒾愈伤组织的诱导
以MS、1/2MS、N6 为基本培养基,添加6-BA 和NAA 两种植物生长调节剂,6-BA 的质量浓度为0.05、0.07、0.09 mg·L-1,NAA 质量浓度分别为0.5、0.75、1.0 mg·L-1。按照正交设计L9(34),采用3 因素3 水平,共9个处理。每个处理接种15 瓶,每瓶3 块叶片,重复3 次。培养基中均添加30 g·L-1蔗糖、7 g·L-1琼脂,pH 值为5.8。培养条件为温度25±2℃,湿度75%,光照强度为1800lx,光处理时长为8 h/d,暗处理时长为16 h/d。恒温生化培养箱中培养15 天,统计愈伤组织诱导率,并记录愈伤组织的生长状态。
1.2.3 宜昌荚蒾愈伤组织的再分化
切取质地较好、颜色淡黄的胚性愈伤组织,以1.2.2 中得到的最适宜培养基为基本培养基,添加6-BA、TDZ、IBA、IAA4 种植物生长调节剂,6-BA 的质量浓度为0.5、0.75、1.0 mg·L-1,TDZ 质量浓度分别为0.1、0.3、0.7 mg·L-1,IBA 质量浓度分别为0.1、0.25、0.5 mg·L-1,IAA 质量浓度分别为0.05、0.1、0.2 mg·L-1。按照正交设计L9(34),采用4 因素3 水平,共9 个处理。每个处理接种20 瓶,每瓶接种4 块愈伤组织。每个试验处理重复3 次。培养基中均添加20 g·L-1蔗糖、7 g·L-1琼脂,pH 值为5.8。培养条件为温度25±2℃,湿度75%,光照强度为1800 lx,光暗处理时长各为12 h/d。置于恒温生化培养箱中培养,密切观察并记录愈伤组织的分化状态,15 天后统计再分化率。
1.2.4 不定芽增殖扩繁
从愈伤组织上剪取不定芽进行增殖培养,培养基和培养环境与1.2.3 相同。观察并记录不定芽增殖扩繁情况,10 天后统计增殖系数。
1.2.5 生根培养
当不定芽高度生长至3~4 cm、叶片4~5 片时,转接到生根培养基上进行生根培养。以添加6-BA、NAA、IBA 植物生长调节剂,6-BA 的质量浓度为0、0.05、0.1 mg·L-1,NAA 质量浓度分别为0、0.3、0.5 mg·L-1,IBA质量浓度分别为0、0.3、0.5 mg·L-1。按照正交设计L9(34),采用3 因素3 水平,共9 个处理。每个处理接种10瓶,每组试验重复3 次。培养基中均添加15 g·L-1蔗糖、8 g·L-1琼脂、1 g·L-1活性炭,pH 值为5.8。培养条件为温度25±2 ℃,湿度75%,光照强度为1800 lx,光暗处理时长各为12 h/d。恒温生化培养箱中培养15 天后统计生根数及生根率,观察生根情况并做好记录。
1.2.6 数据处理及分析
试验数据用WPS Office 2019 专业版统计汇总后,利用SPSS23.0 统计分析软件进行多重比较分析。
愈伤组织诱导率(%)=(诱导出愈伤组织的外植体数/接种的外植体数)×100%
再分化率(%)=(产生芽点分化出芽苗的愈伤组织数量/接种的愈伤组织总数)×100%
生根率(%)=(生根苗数/接种苗数)×100%
2 结果与分析
2.1 不同培养基和不同植物生长调节剂配方对宜昌荚蒾愈伤组织诱导的影响
多重比较分析可知,基本培养基的种类、植物生长调节剂的浓度对愈伤组织诱导的影响显著(P<0.05)。使用N6 培养基时,诱导的愈伤组织质量差、诱导率较低,不是最佳的基本培养基,使用MS 和1/2MS 的愈伤组织诱导率较理想。添加不同浓度植物生长调节剂对愈伤组织的形成作用明显,当6-BA 浓度升高时,愈伤组织诱导率下降,说明低浓度的6-BA 适合愈伤组织的诱导。当6-BA 添加浓度相同时,NAA 浓度高时,诱导率高,说明适当提高NAA 的浓度,有利于愈伤组织诱导。当6-BA 浓度为0.05mg·L-1、NAA 浓度为1.0mg·L-1、诱导率最高,为100%。该处理3 天左右叶片边缘反向卷曲、膨大变厚,6 天左右形成黄绿色愈伤组织颗粒,颗粒较为密实,紧实度较高,15 天最终形成淡绿色愈伤组织(图1),体积增大明显,颗粒较为密实,紧实度较高,说明该处理为最佳处理。

图1 为叶片脱分化后产生的愈伤组织图
2.2 不同植物生长调节剂种类、浓度对愈伤组织再分化的影响
无菌条件下,将诱导出的愈伤组织嵌入到再分化培养基进行再分化培养。多重比较分析可知,植物生长调节剂的种类、浓度对愈伤组织再分化影响显著(P<0.05)。6-BA和TDZ 是不定芽分化时常用的2 种植物生长调节物质,6-BA 与TDZ 组合时浓度适宜有利于分化。当分化培养基中添加6-BA和TDZ 的浓度之和较低时,宜昌荚蒾愈伤组织再分化率低。提高TDZ 的浓度,愈伤组织分化率也随之升高。培养基中同时添加IAA 的浓度是IBA 浓度的2 倍或接近2 倍时,有利于愈伤组织的再分化。由表2 可知,再分化的最佳培养基为N6+6-BA0.5 mg·L-1+TDZ0.7 mg·L-1+IBA0.5 mg·L-1+IAA 0.2 mg·L-1。该处理14 天生成不定芽(图2),高度为0.5 cm,叶片3~5 片,完成了再分化过程,分化率100%。从愈伤组织上剪取不定芽进行增殖培养(图3),10 天产生大量愈伤组织的同时生成多个丛生芽(图4),高度均超过3cm,叶片5~8 片,完成了组织培养扩繁过程,增殖系数为6.5。

图2 为愈伤组织再分化产生不定芽的图

图3 为不定芽经增殖培养后茎的有效伸长的图

图4 为不定芽增殖扩繁的生长形态图

图5 为不定芽生成无根苗的图

表1 不同基本培养基、不同植物生长调节剂配方对愈伤组织诱导的影响
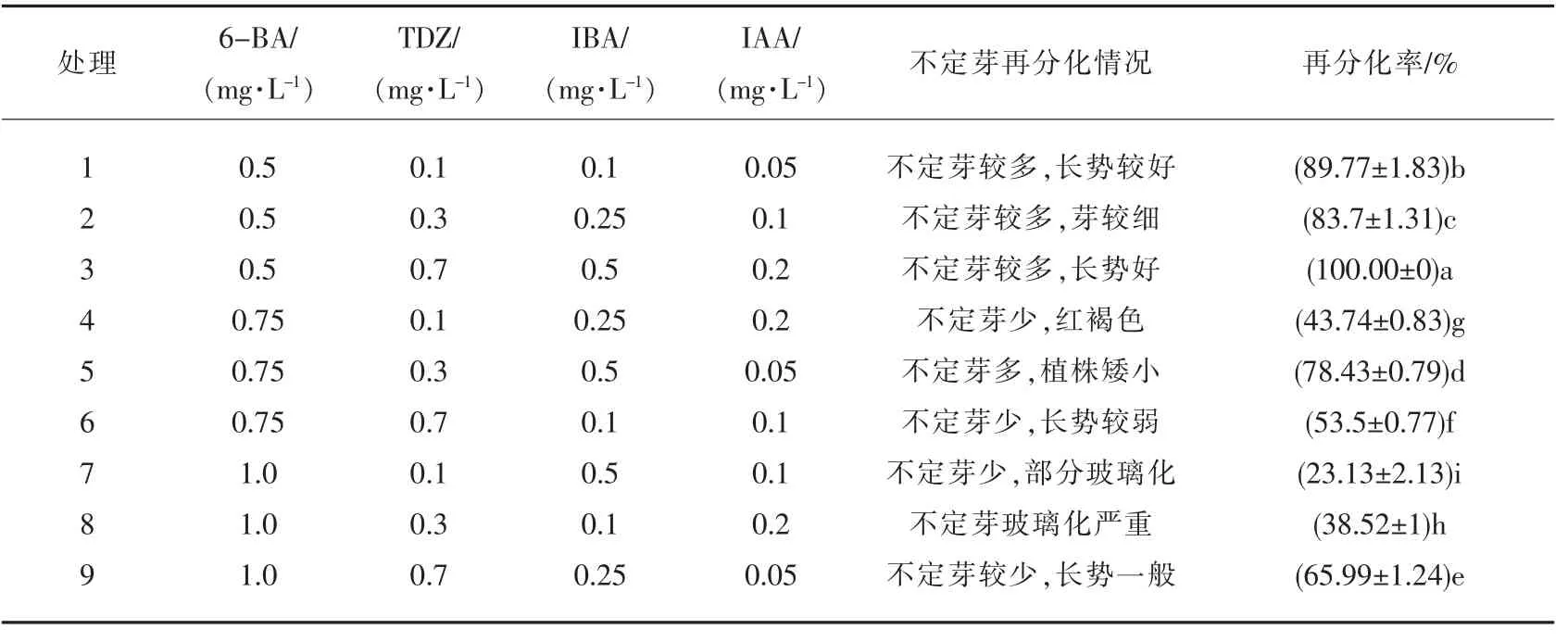
表2 不同种类、浓度植物生长调节剂对愈伤组织再分化的影响
2.3 不同植物生长调节剂配方对宜昌荚蒾生根的影响
挑选宜昌荚蒾愈伤组织分化出的高度2~3 cm、叶片4~5 片的不定芽转接到含有不同浓度植物生长调节剂的生根培养基中进行生根培养。由表3 的多重比较可知,在添加不同浓度植物生长调节剂的培养基中不定芽都能生根,但植物生长调节剂的种类、浓度对不定芽的生根影响显著(P<0.05)。在NAA 浓度小于0.3 mg·L-1的培养基中,根较细弱,植株矮小,长势差。当NAA 浓度逐渐升高时,生根率也随之增高。当NAA 的浓度为0.5 mg·L-1时,不定芽根较粗壮,植株生长速度较快。IBA 的浓度升高时,生根率也随之提高。当生长素总浓度相同,添加相同浓度的NAA 和IBA时,添加NAA 的生根率高于添加IBA 的生根率,说明NAA 的生根效果优于IBA。添加6-BA 浓度为范围为0~0.05 mg·L-1时,生根率逐渐提高,当浓度提高到0.1 mg·L-1时,生根率下降,说明添加微量6-BA 有助于生根。最佳生根培养基为1/2MS+6-BA0.05 mg·L-1+NAA0.50 mg·L-1+活性炭1g·L-1,15 天生根(图6),生根2~3 条,根长2~3 cm,根粗0.2~0.3 mm,植株高度增长15%,完成了生根过程,生根率为100%,形成完整植株。

图6 为生根的完整宜昌荚蒾植株
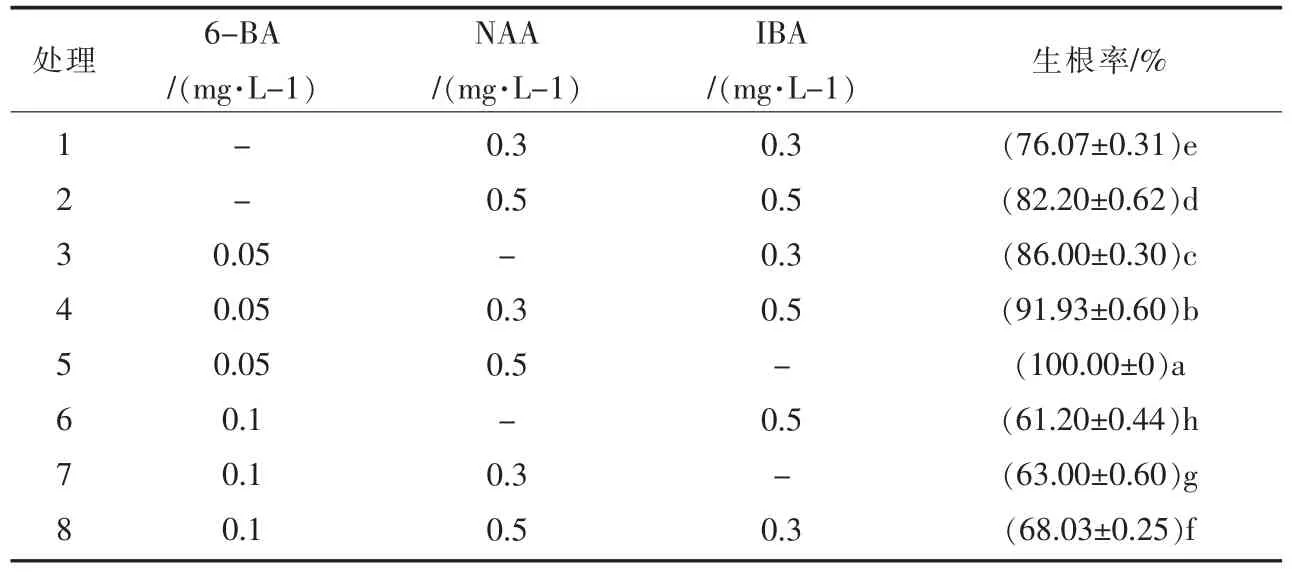
表3 不同种类、浓度植物生长调节剂对宜昌荚蒾生根的影响
3 讨论与结论
建立宜昌荚蒾无菌体系,外植体的消毒处理,选择消毒剂的种类、不同的消毒时间是无菌化处理的关键。宜昌荚蒾叶片表面不平整有凹陷,单一消毒剂的效果效果不佳,本研究采用75%乙醇和0.1%HgCl2组合消毒明显提高消毒效果[12],降低污染率,迅速建立宜昌荚蒾无菌体系。关于不同灭菌时间对外植体存活率和污染率的效果有待进一步研究,以期探究最佳消毒处理时间。本试验能实现叶片快速脱分 化形成有效愈伤组织,愈伤组织诱导的最适培养基为1/2MS+6-BA0.05 mg·L-1+NAA1.0 mg·L-1,脱分化仅15 d 就能获得色泽透明浅绿、结构致密的愈伤组织,其诱导率为100%.;对愈伤组织进行再分化培养14 d 后,就有不定芽形成,再分化的最佳培养基为N6+6-BA0.5 mg·L-1+TDZ0.7 mg·L-1+IBA0.5 mg·L-1+IAA0.2 mg·L-1,愈伤组织再分化率为100%。将不定芽进行生根培养,最佳生根培养基为1/2MS+6-BA0.05 mg·L-1+NAA0.50 mg·L-1+活性炭1g·L-1,培养15 天后生根率为100%。通过本试验从建立无菌体系到植株生根,在组培室经展叶培养(10 d)、愈伤组织诱导(脱分化15 d)、不定芽发生(再分化14 d)、增殖培养(一个增殖周期是10 d)、生根培养(15 d),总计64 d 即可获得大量完整的宜昌荚蒾植株,解决了宜昌荚蒾繁育困难的问题,并显著提高了宜昌荚蒾的育苗效率,节约了生产成本,有利于宜昌荚蒾的种质资源的保存,为宜昌荚蒾工厂化育苗提供技术支持。
