超声协同酶法提取红菇多糖工艺优化及不同产地红菇多糖分析
2023-11-09钟碧萍吴晓青
钟碧萍,吴晓青
((福建生物工程职业技术学院,福建 福州 350002))
红菇(Russula)被誉为“中国纯自然高级野生山珍”之一[1],在我国多个省市均有分布,较多出现在福建、云南、辽宁、江苏、江西、广东、广西、四川等地[2],它不仅仅是一类珍稀的野生菌类,还富含蛋白质、氨基酸、多糖和其他人类健康所必需的营养素物质[3],红菇多糖是红菇中重要的成分之一,不同产地红菇中多糖成分有所差异,但都具有抗氧化[4]、抗肿瘤[5]、抗肝功能衰退[6]、降血压、降血脂[7]等方面的药理作用。
目前文献报道的红菇多糖提取方法主要有热水提取[8-9]、微波辅助提取[10-11]、超声辅助提取[12-13]等方法。热水提取法环保、经济安全,需要仪器简单,但有耗时长,容易得到酸性多糖的缺点;微波提取法耗时短、节能,但容易产生局部高温导致多糖结构发生改变;单独的超声波辅助提取法效率高、耗时短,但有效范围较小,现有的三种红菇提取方法各有优缺点。而超声波协同酶法可兼具两种提取方法的优点,与这几种方法相比,具有提取效率高、耗时少、操作简单等优点。
近年来,超声波-酶解法已经成为植物多糖提取的重要手段,梁乐欣等[14]使用超声波协同纤维素酶法提取紫苏叶多糖;孙燕丽等[15]使用超声波-复合酶法协同提取马齿苋多糖;秦令祥等[16]使用超声波协同复合酶法提取香菇多糖。然而,红菇多糖的提取技术尚未得到充分的研究,目前还没有用超声波-酶法提取红菇多糖的相关文献,因此,本文将探索采用超声波-纤维素酶法来提取红菇多糖以及对不同产地的红菇多糖含量差异进行分析,旨在为红菇多糖提取提供新研究方法。
1 材料与方法
1.1 材料与试剂
红菇:产自福建省三明市、云南省、广东省,均为市售干货;纤维素酶(50 000 U/g)购自上海阿拉丁化学试剂公司;葡萄糖、硫酸、苯酚、乙醇、三氯化铁、氯仿、正丁醇等均购自上海国药集团化学试剂有限公司。
1.2 仪器设备
UV-1810型紫外可见光分光光度计(购自上海市美普达仪器设备服务公司)、AL204型电子天平仪器(购自浙江省永康市金穗机械制造厂)、KQ-500B型超声清洗器(购自昆山市超声仪器服务公司)、HH-2S数显恒温式水浴锅(购自常州市国旺仪器设备服务公司)、电热鼓风恒温式风干箱(购自上海市东星建筑实验机械设备服务公司)、TG16-WS型离心机(购自长沙湘智离心机仪器设备服务公司)、SHD-Ⅲ循环水式多用真空泵(购自保定高新区阳光科教仪器厂)。
1.3 实验方法
1.3.1 葡萄糖标曲制备
称取无水葡萄糖0.15 g,精密称定,置于100 mL容量瓶中,用水稀释至刻度,摇匀,即得1.5 mg/mL葡萄糖标准溶液。分别移取标准溶液1.0,2.0,4.0,6.0,8.0,10.0 mL置于100 mL容量瓶中,加水至刻度,摇匀。分别吸取系列浓度溶液1.0 mL再加入新配制的5%的苯酚溶液1.0 mL,浓硫酸4.0 mL,混匀,沸水浴30 min,冷却。在490 nm波长处测定吸光度,而后绘制标准曲线,用于红菇多糖测定。
1.3.2 红菇多糖制备
将野生红菇烘干至恒重后用粉碎机粉碎,用密封袋分装后放入干燥箱中备用。精密称取0.25 g,根据实验设计的液料比、超声时间、超声功率、酶解时间和酶解温度提取多糖,过滤后,再将其和Sevage溶剂(氯仿和正丁醇的体积配比为4∶1)以体积比 5 ∶ 1 加以混匀,除去蛋白质[17]。分离有机相和水相,水相使用旋转蒸发仪将其加以浓缩,然后将其与3倍体积量的无水乙醇混匀,抽滤,沉淀用丙酮经过3遍清洗,抽滤干燥,最终得到红菇多糖的粗品。
1.3.3 多糖含量计算
采用苯酚-硫酸法[18]测定红菇多糖含量,将按照1.3.2所述方法操作得到的粗多糖,溶解定容至500 mL,摇匀。取1.0 mL加入新配制的5%的苯酚溶液1.0 mL,浓硫酸4.0 mL,混匀,沸水浴30 min,冷却,在490 nm波长处测定吸光度,测定红菇多糖含量,参考文献[19]计算多糖质量。多糖得率=多糖质量/原料取样质量。
1.3.4 单因素试验设计
1.3.4.1 液料比试验
选取20,30,40,50,60 mL/g五种浓度的液料比,在超声时间40 min、超声功率150 W、酶解时间30 min、酶解温度40 ℃时,按照苯酚-硫酸法测定吸光度,得到红菇多糖提取率。
1.3.4.2 超声时间试验
选取30,40,50,60,70 min五种不同超声时间,在液料比30 mL/g、超声功率150 W、酶解时间30 min、酶解温度40 ℃时,按照苯酚-硫酸法测定吸光度,得到红菇多糖提取率。
1.3.4.3 超声功率试验
选取100,150,200,250,300 W五种超声功率,在液料比30 mL/g、超声时间40 min、酶解时间30 min、酶解温度40 ℃时,按照苯酚-硫酸法测定吸光度,得到红菇多糖提取率。
1.3.4.4 酶解时间试验
选取20,30,40,50,60 min五种酶解时间,在液料比30 mL/g、超声时间40 min、超声功率150 W,酶解温度40 ℃时,按照苯酚-硫酸法测定吸光度,得到红菇多糖提取率。
1.3.4.5 酶解温度试验
选取30,35,40,45,50 ℃五种酶解温度,在液料比30 mL/g、超声时间40 min、超声功率150 W,酶解时间30 min时,用苯酚-硫酸法测定吸光度,得到红菇多糖提取率。
1.3.5 正交试验
根据单因素实验结果,将超声功率定为200 W,选择液料比(A)、超声时间(B)、酶解时间(C)和酶解温度(D)四个因素作为变量,将红菇多糖的提取百分率为响应值,进行了四因素三水平正交测定,见表1。
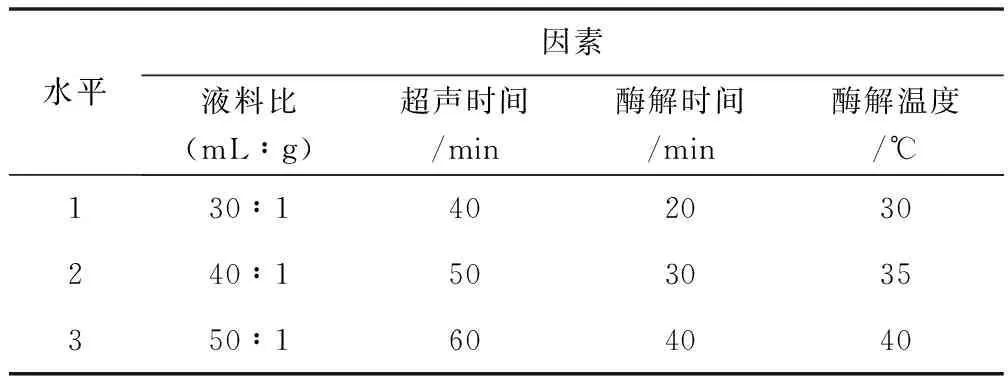
表1 正交设计因素与水平表
1.3.6 验证试验
以选定的四因素三水平正交实验确定出的最优提取条件进行验证实验,测出红菇多糖提取率,验证方法可靠性。
1.3.7 不同产地野生红菇多糖含量测定
以正交试验确定的最优提取条件测定福建三明、云南、广东三种产地红菇多糖的提取率,比较不同产地红菇多糖含量差异性。
2 结果分析
2.1 单因素试验结果
2.1.1 液料比对多糖得率的影响
选取20∶1,30∶1,40∶1,50∶1,60∶1(mL∶g)五种液料比,在超声时间40 min、超声功率150 W、酶解时间30 min、酶解温度40 ℃时,测定三种不同产地红菇多糖提取得率(图1)。结果显示,液料比为40∶1(mL∶g)时多糖得率最高,原因可能是足够的溶剂量是多糖溶出的必要条件,而当液料比达到一定时,多糖溶出率基本饱和,提取率趋于平稳,故不再继续增加[20]。因此液料比40∶1(mL∶g)为最佳提取料液比,选择液料比 30∶1,40∶1,50∶1(mL∶g)进行正交实验。

图1 液料比对多糖得率的影响
2.1.2 超声时间对多糖得率的影响
选取30,40,50,60,70 min五种不同超声时间,在液料比30 mL/g、超声功率150 W、酶解时间30 min、酶解温度40 ℃时,测定提取多糖得率(图2)。结果显示,超声时间50 min时多糖得率最高,随着超声时间继续增加,多糖提取率反而下降,原因可能是超声时间超过一定时,会破坏多糖的分子结构,故而多糖提取率降低[21]。因此超声时间选取50 min为最佳超声时间,选择超声时间40,50,60 min进行正交实验。

图2 超声时间对多糖得率的影响
2.1.3 超声功率对多糖得率的影响
选取100,150,200,250,300 W五种超声功率,在液料比30 mL/g、超声时间40 min、酶解时间30 min、酶解温度40 ℃时,测定多糖得率(图3)。结果显示,超声功率200 W时多糖得率最高,继续增加超声功率,提取率反而下降,超声功率不宜太大原因是功率太大,会破坏多糖分子的结构[22]。因此超声功率选取200 W为最佳超声功率。在正交试验中选取200 W超声功率用于红菇多糖提取。

图3 超声功率对多糖得率的影响
2.1.4 酶解时间对多糖得率的影响
选取20,30,40,50,60 min五种酶解时间,在液料比30 mL/g、超声时间40 min、超声功率150 W,酶解温度40 ℃时,测定红菇多糖提取得率(图4)。结果显示,酶解时间30 min时,多糖得率最高,继续增加酶解时间,得率不再增加,原因是超过30 min时,多糖提取已经较为完全,得到的多糖会出现分解,因此酶解时间选取30 min为最佳酶解时间,选择酶解时间 20,30,40 min进行正交实验。

图4 酶解时间对多糖得率的影响
2.1.5 酶解温度对多糖得率的影响
选取30,35,40,45,50 ℃五种酶解温度,在液料比30∶1(mL∶g)、超声时间40 min、超声功率150 W,酶解时间30 min时,测定红菇多糖得率(图5)。结果显示,酶解温度35 ℃时,红菇多糖得率最高,温度超过35 ℃,多糖提取得率反而有所下降,原因是温度太高,会导致多糖的降解,因此酶解温度选取35 ℃为最佳酶解温度,选择酶解温度 30,35,40 ℃进行正交实验。
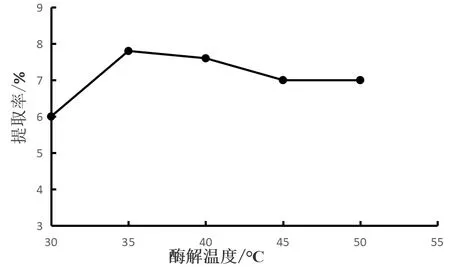
图5 酶解温度对多糖得率的影响
2.2 正交试验结果与分析
进行四个不同的因素的三水平正交试验,将液料比(A)、超声时间(B)、酶解时间(C)和酶解温度(D)作为四个重要的参数,液料比选择30∶1,40∶1,50∶1(mL∶g),超声时间选择40,50,60 min,酶解时间选择20,30,40 min,酶解温度选择30,35,40 ℃,将红菇多糖的提取率(%)作为评估的指标,实验结果见表2。

表2 正交试验结果与分析表
由表2可知,四个因素对红菇多糖的提取率均有影响,比较极差R可以看出,料液比(A)对多糖提取率的影响最大,而后依次为酶解时间、超声时间、酶解温度。采用A2B2C2D2作为提取红菇多糖的最佳参数,即液料比40∶1(mL∶g)、超声时间50 min、酶解时间30 min、酶解温度35 ℃。
2.3 验证性试验
通过正交试验得到最优条件下,即液料比40∶1(mL∶g)、超声时间50 min、酶解时间30 min、酶解温度35 ℃条件下做 3 次平行试验,得到红菇多糖提取率为8.753%。经过实验,我们发现提取率与正交实验最高提取率略高,说明了提取方法稳定可靠。
2.4 不同产地野生红菇多糖含量测定
以正交试验确定的最优提取条件,即液料比40∶1(mL∶g)、超声时间50 min、酶解时间30 min、酶解温度35 ℃条件下做3次平行试验,测定福建三明产地的红菇多糖提取率为8.753%、云南产地的红菇多糖提取率为7.953%、广东产地的红菇多糖的提取率为8.836%。从数据中可知,福建、广东产地的红菇多糖提取率差别并不显著,而云南产地的多糖提取率与其余两种产地相比多糖含量较低,原因可能与红菇生长土壤、环境及天气有关,文献中得知,目前红菇属有300多种,国内有90多种[23],后续可研究其他产地种属红菇,以期发现多糖含量更高的种属,文章所研究的三种产地红菇均可作为多糖进一步开发利用的原料。
3 结论
本试验通过单因素试验和正交试验设计,得出超声波-酶法协同提取红菇多糖在液料比40∶1(mL∶g)、超声时间50 min、酶解时间30 min、酶解温度35 ℃时,可以获得红菇多糖的最优提取效果,福建三明产地的红菇多糖提取率为8.753%、云南产地的红菇多糖提取率为7.953%、广东产地的红菇多糖的提取率为8.836%。提取方法为超声协同纤维素酶法,可以兼具两种提取方法的优点,与现有文献报道的红菇多糖方法相比,试剂用量小、耗时短、生物活性强且提取率更高,故此方法可为后续红菇多糖研究提供更多参考,为红菇在保健与食品等方面的应用提供依据。
