钒化合物作为钒电池电极材料的稳定性及电化学行为研究
2023-11-08张一敏
潘 东, 刘 涛, 张一敏, 刘 红, 魏 莲
(1.武汉科技大学 资源与环境工程学院, 湖北 武汉 430081;2.国家环境保护矿冶资源利用与污染控制重点实验室, 湖北 武汉 430081;3.战略钒资源利用省部共建协同创新中心, 湖北 武汉 430081;4.湖北省页岩钒资源高效清洁利用工程技术研究中心, 湖北 武汉 430081;5.六盘水师范学院 矿业与机械工程学院, 贵州 六盘水 553004)
钒元素是过渡金属元素,在元素周期表中位于VB族,原子序数23,原子的外层电子排列为3d34s2,因此,钒能够以多种价态的形式存在各种钒化合物中,形成的化学键具有与共价键、金属键、离子键相似的性质,表现出独特的物理化学性质,钒及其化合物被广泛应用于化工、冶金、能源领域[1-3]。钒化合物结构的多样性,使得其可作为Li、Na、K、Ca、Zn、Mg、Al等离子电池的电极材料[4-5];钒元素的多价态特性,使得其可直接作为电子存储载体,构建全钒液流电池[6];钒元素独特的电子结构,使得其化合物或单质可以作为催化材料,在氧气还原、甲醇氧化、一氧化氮还原等方面被广泛使用[7-9]。
全钒液流电池作为重要的大规模储能装置,低电化学活性的电极材料限制了钒电池的发展。为了提高电极电化学活性,可引入金属(Pt[10]、Bi[11]、Ir[12]、Sn[13]等)、金属氧化物(TiO2[14]、ZrO2[15]、Ta2O5[16]、Cr2O3[17]等)、金属碳化物(TiC[18]、NbC[19])、金属氮化物(TiN[20]、WN[21])等催化材料。虽然这些催化材料表现出较好的催化活性,提升了钒电池的能量效率,但对电解液的污染问题无法避免。钒化合物具有良好的电化学活性,同时能够避免对电解液造成污染。有研究者将钒化合物作为电极催化材料引入全钒液流电池中以提升电池性能,BUSACCA等[22]利用静电纺丝制备了V2O3与碳纳米纤维复合的电极材料,用于催化V5+/V4+和V3+/V2+电对反应,结果表明相比于碳纳米纤维,复合电极材料对V5+/V4催化效果更好,峰电位差为20 mV,峰电流密度达到0.37 A·cm-2,并且在100次循环伏安测试中能够保持比较好的稳定性。WANG等[23]通过将钒氧化物沉积于电极表面,再高温转化为V2O5,最后在稀硫酸溶液中溶解V2O5,实现了对石墨毡电极的活化,主要是增加了石墨毡电极表面含氧官能团,增强了电极的亲水性,最终V2O5活化的石墨毡电极组装的电池容量保持率相比于普通热活化石墨毡提高了7.09%。钒化合物作为催化材料被引入钒电池,一方面会接触酸性含钒电解液,另一方面其表面会催化电解液中的钒离子电对发生氧化还原反应。因此,钒化合物在酸性含钒电解液中的稳定性、对钒离子电对的催化活性、催化过程中是否参与氧化还原反应是选择合适催化材料的关键。目前钒化合物作为全钒液流电池电极材料的研究较少,特别是对于钒化合物在酸性含钒电解液中的稳定性及电化学行为缺乏研究。
因此,本文选取VO2、V2O3、NaV2O5、V2O5、VN 5种典型的钒化合物作为研究对象,首先构建E-pH图,对上述钒化合物在不同pH值、电位区间的稳定性进行分析,然后结合开路电位测试和溶解试验研究5种钒化合物在酸性电解液中的溶解规律,最后通过循环伏安测试研究钒化合物在酸性电解液中的电化学氧化行为以及对V5+/V4+和V3+/V2+电对反应的电催化行为,以期为钒化合物用于提升全钒液流电池电极性能提供有利的支撑。
1 试验介绍
1.1 试验原料与装置
1)试验原料。钒化合物VO2、V2O3、NaV2O5,纯度>98%,实验室合成;V2O5,纯度99.9%,上海慧言化工产品有限公司;VN,纯度99.9%,国药集团化学试剂有限公司;以上均为粉末样品。浓硫酸,纯度98%,国药集团化学试剂有限公司;硫酸氧钒,纯度99%,沈阳市海中天精细化工;乙炔黑,碳含量>99%,深圳市红海实验仪器有限公司;无水乙醇,分析纯,国药集团化学试剂有限公司;5% Nafion 117,分析纯,上海阿拉丁生化科技股份有限公司。
2)主要装置。三电极装置,来自武汉高仕睿联科技有限公司;普林斯顿电化学工作站,PARSTAT 4000A,来自阿美特克商贸有限公司。
1.2 试验方法
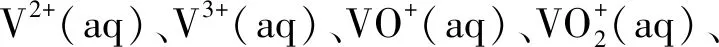

表1 在25 ℃下V-H2O系物质热力学数据
2)溶解试验。分别取50 mg V2O5、VO2、NaV2O5、V2O3、VN,置于5 mL 2.0 mol·L-1H2SO4溶液中浸泡并观察溶解情况。
3)电化学测试过程。首先分别取6 mg V2O5、VO2、NaV2O5、V2O3、VN,与乙炔黑6 mg分散于1.5 mL的无水乙醇中,然后加入30 μL Nafion溶液(5‰)超声分散30 min,取30 μL分散液滴于玻碳电极表面,玻碳电极置于真空干燥箱中60 ℃真空干燥30 min,制得负载钒化合物的玻碳电极。以负载钒化合物的玻碳电极作为工作电极、铂电极作为对电极、饱和甘汞电极作为参比电极,考虑到实际电解液中钒浓度一般在1.2~1.8 mol·L-1,因此选择在1.5 mol·L-1VOSO4+2.0 mol·L-1H2SO4电解液中进行开路电位测试以研究钒化合物的稳定性,在2.0 mol·L-1H2SO4电解液中进行循环伏安测试以研究钒化合物的电化学氧化行为,测试电压范围为-0.8~1.5 V,扫描方向为开路电位→-0.8 V→1.5 V→-0.8 V的循环,扫描速度为10 mV/s;考虑电解液中较低的钒浓度有利于循环伏安测试,相关研究中钒浓度一般在0.01~0.5 mol·L-1[25],因此选择在0.1 mol·L-1V4++2.0 mol·L-1H2SO4、0.1 mol·L-1V3++2.0 mol·L-1H2SO4电解液中进行循环伏安测试以研究钒化合物的电催化行为,测试电压范围分别为-0.8~-0.2 V和0.4~1.5 V,扫描速度为10 mV/s。
2 结果与讨论
2.1 钒化合物的E-pH图
2.1.1 V-Na-O-H系
为了研究NaV2O5在酸性溶液中的稳定性,构建了V-Na-O-H系E-pH图,固相选择Na0.27V2O5,如图1所示。
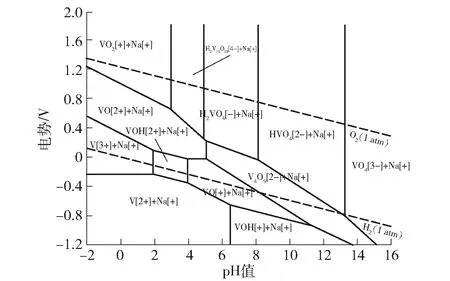
图1 V-Na-O-H 系E-pH图

2.1.2 V-O-H系
为了研究V2O5、VO2、V2O3在酸性溶液中的稳定性,构建了V-O-H系E-pH图,固相包括V2O5、VO2、V2O3,如图2所示。
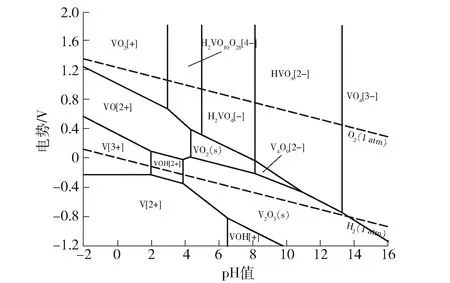
图2 V-O-H 系E-pH图

2.1.3 V-N-O-H 系
为了研究VN在酸性溶液中的稳定性,构建了V-N-O-H系E-pH图,固相包含VN、V2O5、VO2和V2O3,如图3所示。
图3 V-N-O-H 系E-pH图
从图3可以看出,在温度25 ℃、溶液中离子活度10-5、电势-1.8~1.8 V、pH值-2.0~16.0,及电势-0.19~-1.8 V、pH值-2.0~16.0区域内,固相VN出现稳定区;在pH 值为4.0~8.0的区域,VN会向VO2、V2O3转变,而在pH 值-2.0~2.0范围内,电势超过-0.19 V时,VN不能稳定存在。
通过对V-O-H、V-Na-O-H、V-N-O-H系E-pH图分析,发现V2O5、VO2、Na0.27V2O5、V2O3在pH值-2.0~2.0范围内不能稳定存在,而VN在pH值-2.0~2.0范围内,电势低于-0.19 V时能够稳定存在。
2.2 钒化合物的稳定性
2.2.1 溶解性
将V2O5、VO2、NaV2O5、V2O3、VN浸泡于2.0 mol·L-1H2SO4的稀硫酸溶液中并进行观察,结果如图4所示。

图4 不同浸泡时间下钒化合物的溶解照片(从左到右依次为V2O5、NaV2O5、VO2、V2O3、VN)
从图4可以看出,在未加入钒化合物的5支玻璃瓶中,稀硫酸溶液呈现为无色透明;按从左至右的顺序,向5支玻璃瓶中分别加入V2O5、NaV2O5、VO2、V2O3、VN粉末,静置3 min后5种钒化合物固体粉末均沉于玻璃瓶底部,而稀硫酸溶液呈现出不同的颜色,一般硫酸溶液中V5+、V4+、V3+、V2+会分别呈现为黄色、蓝色、绿色、紫色,由此表明5种钒化合物固体粉末在稀硫酸溶液中发生溶解,产生了不同价态的钒离子;静置3 h后发现5支玻璃瓶中的稀硫酸溶液颜色加深,表明5种钒化合物固体粉末在稀硫酸溶液中发生持续溶解,而添加NaV2O5、VO2的玻璃瓶中底部已无法观察到固体粉末,表明NaV2O5、VO2完全溶解;继续静置364 h后发现添加V2O5的玻璃瓶底部无法观察到固体粉末,表明V2O5完全溶解,相应的稀硫酸溶液呈现为淡黄色;添加V2O3、VN的玻璃瓶底部依然能够观察到黑色固体,而添加VN的玻璃瓶中稀硫酸溶液颜色更接近无色,表明在稀硫酸溶液中VN的溶解更慢。因此,在2.0 mol·L-1H2SO4稀硫酸溶液中V2O3、VN比V2O5、NaV2O5、VO2更加稳定。
2.2.2 开路电位
将V2O5、VO2、NaV2O5、V2O3、VN负载在玻碳电极上,利用开路电位法测试各钒化合物在1.5 mol·L-1VOSO4+2.0 mol·L-1H2SO4电解液中的开路电位,如图5所示。
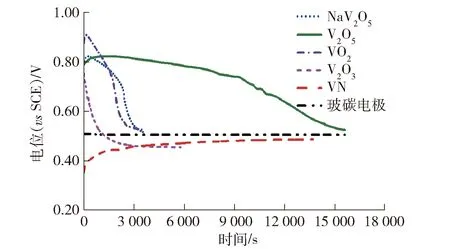
图5 不同钒化合物在1.5 mol·L-1 VOSO4+2.0 mol·L-1 H2SO4电解液中的开路电位
2.2.3 小结
通过溶解观察、开路电位检测,对比了V2O5、VO2、NaV2O5、V2O3、VN在2.0 mol·L-1H2SO4稀硫酸溶液和1.5 mol·L-1VOSO4+2.0 mol·L-1H2SO4电解液中的稳定性,发现V2O5、VO2、NaV2O5会发生溶解,V2O5比VO2、NaV2O5溶解速度慢一些,而V2O3、VN相对稳定,但也会发生溶解。
2.3 钒化合物的电化学氧化行为
由于VO2和NaV2O5在2.0 mol·L-1H2SO4中快速溶解,且避免电解液中V的影响,所以研究V2O5、V2O3、VN在2.0 mol·L-1H2SO4的电化学氧化行为,将3种钒化合物均负载在玻碳电极上,以空白玻碳电极作为参照,结果如图6所示。

图6 3种钒化合物在2.0 mol·L-1 H2SO4中的循环伏安曲线
从图6(a)可以看出,在-0.8~-0.2 V和0.4~1.5 V的循环伏安测试中,玻碳电极并未出现氧化峰和还原峰,表明玻碳电极在2.0 mol·L-1H2SO4具有很好的稳定性,不发生氧化还原反应;V2O5在2.0 mol·L-1H2SO4中进行3圈循环伏安测试,第1圈测试在0.98 V出现了氧化峰,峰电流密度为0.45 mA·cm-2,在0.7 V和0.4 V出现了还原峰,峰电流密度为-0.78 mA·cm-2和-0.63 mA·cm-2,在-0.8~-0.2 V的低电位区未出现明显的氧化峰和还原峰,表明V2O5在0.4~1.5 V的循环伏安测试中发生了明显的氧化还原反应,在-0.8~-0.2 V没有发生明显的氧化还原反应;第2圈测试在0.99 V出现了氧化峰,峰电流密度为 0.20 mA·cm-2,在0.75 V和0.51 V出现了还原峰,峰电流密度为-0.35 mA·cm-2和-0.22 mA·cm-2,相比于第1圈,氧化峰和还原峰电流密度明显降低,主要是在第1圈测试中负载的V2O5已经发生氧化还原反应,加速了其溶解和消耗,在-0.8~-0.2 V的低电位区也没有出现明显的氧化峰和还原峰;第3圈测试在0.96 V出现了氧化峰,峰电流密度为0.10 mA·cm-2,在0.75 V出现了还原峰,峰电流密度为-0.12 mA·cm-2,相比于第1圈,氧化峰和还原峰电流密度明显降低,主要是在第1圈测试中负载的V2O5已经发生氧化还原反应,加速了其溶解和消耗,在-0.8~-0.2 V的低电位区也没有出现明显的氧化峰和还原峰。
从图6(b)可以看出,V2O3在2.0 mol·L-1H2SO4中进行3圈循环伏安测试,第1圈测试在0.98 V出现了氧化峰,峰电流密度为0.80 mA·cm-2,在0.76 V出现了还原峰,峰电流密度为-0.19 mA·cm-2,在-0.8~-0.2 V的低电位区没有出现明显的氧化峰和还原峰,表明V2O3在0.4~1.5 V的循环伏安测试中发生了明显的氧化还原反应,在-0.8~-0.2 V没有发生明显的氧化还原反应;第2圈测试中在-0.8~-0.2 V和0.4~1.5 V的电位区没有出现明显的氧化峰和还原峰;第3圈测试中在-0.8~-0.2 V和0.4~1.5 V的电位区也没有出现明显的氧化峰和还原峰。
从图6(c)可以看出,VN在2.0 mol·L-1H2SO4中进行3圈循环伏安测试,第1圈测试在1.22 V出现了氧化峰,峰电流密度为1.72 mA·cm-2,在0.74 V出现了还原峰,峰电流密度为-0.17 mA·cm-2,在-0.8~-0.2 V的低电位区没有出现明显的氧化峰和还原峰,表明VN在 0.4~1.5 V的循环伏安测试中发生了明显的氧化还原反应,在-0.8~-0.2 V没有发生明显的氧化还原反应;第2圈测试中在-0.8~-0.2 V和 0.4~1.5 V的电位区没有出现明显的氧化峰和还原峰;第3圈测试中在-0.8~-0.2 V 和0.4~1.5 V的电位区也没有出现明显的氧化峰和还原峰。
从图6(d)可以看出,V2O5、V2O3、VN在2.0 mol·L-1H2SO4中进行环伏安测试时,在0.4~1.5 V的电位区均发生了明显的氧化还原反应,氧化峰电位分别为0.98 V、0.98 V、1.22 V,相应的氧化峰电流密度分别为0.45 mA·cm-2、0.80 mA·cm-2、1.72 mA·cm-2;3种钒化合物在-0.8~-0.2 V的电位区均没有出现明显的氧化还原峰,在-0.8~-0.6 V的电位区VN表面析氢反应对应的电流密度高于V2O5和V2O3。
综合以上,V2O5,V2O3、VN会在0.4~1.5 V发生氧化还原反应,VN的氧化反应更加显著,在-0.8~-0.2 V均不会发生明显的氧化还原反应。
2.4 钒化合物的电催化作用
由于VO2和NaV2O5在2.0 mol·L-1H2SO4中快速溶解,所以将V2O5、V2O3、VN负载在玻碳电极上,研究3种钒化合物对V5+/V4+、V3+/V2+电对反应的催化作用,如图7和图8所示。
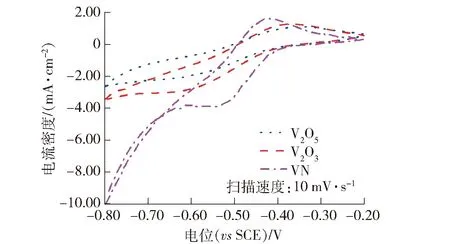
图7 V2O5、V2O3、VN在0.1 mol·L-1 V3++2.0 mol·L-1 H2SO4中的循环伏安曲线
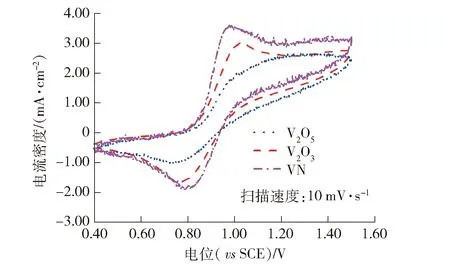
图8 V2O5、V2O3、VN在0.1 mol·L-1 V4++2.0 mol·L-1 H2SO4中的循环伏安曲线
从图7可以看出,3种钒化合物在0.1 mol·L-1V3++2.0 mol·L-1H2SO4中的循环伏安曲线均表现出明显的氧化峰和还原峰,表明他们对于V3+/V2+电对反应均具有一定的催化作用;V2O5、V2O3、VN的氧化峰电流密度分别为1.09 mA·cm-2、1.29 mA·cm-2、1.66 mA·cm-2,还原峰电流密度分别为-2.03 mA·cm-2、-2.74 mA·cm-2、-3.87 mA·cm-2,峰电位差分别为270 mV、230 mV、100 mV;由于氧化峰或还原峰电流密度越大,氧化峰与还原峰电位差越小,催化剂的催化效果越好,所以VN对V3+/V2+电对反应具有较好的催化作用,V2O3的催化作用次之,V2O5的催化作用最弱。
从图8可以看出,3种钒化合物在0.1 mol·L-1V4++2.0 mol·L-1H2SO4中的循环伏安曲线也表现出明显的氧化峰和还原峰,表明他们对于V5+/V4+电对反应均具有一定的催化作用,但氧化峰右侧的曲线明显上移,表明各钒化合物自身也发生氧化反应,这与图6中3种钒化合物在1.0 V附近出现的氧化峰相对应;V2O5、V2O3、VN的氧化峰电流密度分别为2.43 mA·cm-2、3.00 mA·cm-2、3.56 mA·cm-2,还原峰电流密度分别为-0.95 mA·cm-2、-1.62 mA·cm-2、-1.86 mA·cm-2,峰电位差分别为420 mV、260 mV、180 mV;VN对V5+/V4+电对反应具有一定的催化作用,V2O3的催化作用次之,V2O5的催化作用最弱,同时3种钒化合物自身均会发生氧化反应。
3 结论
采用E-pH、开路电位法、循环伏安法等方法研究了V2O5、VO2、V2O3、NaV2O5、VN等钒化合物在酸性含钒电解液中的稳定性和电化学行为,得到如下结论。
1)在1.5 mol·L-1VOSO4+2.0 mol·L-1H2SO4电解液中,V2O5、VO2、NaV2O5可溶解,就溶解速度而言,V2O5比VO2、NaV2O5溶解慢一些,而V2O3、VN相对稳定,有少量溶解。
2)V2O5、V2O3、VN会在0.4~1.5 V发生显著的氧化还原反应,在-0.8~-0.2 V均不会发生明显的氧化还原反应。
3)VN对V5+/V4+、V3+/V2+电对反应的具有较好的催化作用,V2O3的催化作用次之,V2O5的催化作用最弱。由于3种钒化合物对V5+/V4+电对反应进行催化的同时自身会发生氧化反应,V2O5、V2O3、VN不适合用于全钒液流电池正极电极材料的制备,V2O3、VN比较适合用于全钒液流电池负极电极材料的制备。
