火焰原子吸收分光光度法测量拜耳法赤泥中钠
2023-11-08廖曼琦尹建国张辉宝周雪娇袁晓丽向小艳夏文堂
廖曼琦, 尹建国, 张辉宝, 周雪娇, 袁晓丽, 向小艳, 安 娟, 夏文堂
(1.重庆科技学院 冶金与材料工程学院, 重庆 401331; 2.贵州大学 材料与冶金学院, 贵州 贵阳 550025)
赤泥是氧化铝生产过程中产生的强碱性固体残渣,常含氧化铁,显红色[1]。随着氧化铝行业的持续发展,全球赤泥总量超46亿t,而我国就占世界总量的30%以上,且呈继续增长态势[2-3]。目前,赤泥主要采用筑坝堆存,但堆存成本高,占用土地,污染土壤、地下水和大气,且存在滑坡与溃坝隐患,严重威胁人们生命及财产安全[4]。由于碱性强、含水率高、组成复杂,赤泥的无害化、资源化难度大[5]。当前赤泥仅少量应用于水泥[6]、筑路材料[7]、墙体材料[8]、塑料填充剂[9]及絮凝剂[10]等生产,或从中提取铝、铁、稀有金属及稀土金属[11-13]。赤泥的化学组成显示其在水泥行业具有大规模应用潜力,且产出的水泥具有早期抗压强度高、抗硫酸盐腐蚀性强等优点,赤泥中碱含量远超硅酸盐水泥标准[14],但碱含量偏高会导致水泥制品出现开裂、鼓包、泛霜和后期强度低等问题[15-17],限制了赤泥在水泥中掺和比例。因此,为实现赤泥在水泥等领域的大宗应用,亟待开发赤泥高效脱碱技术和快速准确的钠含量分析检测技术。
采用X荧光光谱法[18]、ICP光谱法[19-20]可实现赤泥中钠含量快速、准确测量,但仪器昂贵,常规实验室难以满足条件。火焰原子吸收分光光度法具有准确度高、精密度好、操作简便、测量元素种类多等优点,适用于赤泥中钠含量的分析检测。郭端阳[21]研究采用氢氧化钾熔融赤泥样品后再用盐酸消解,样品消解过程复杂且需使用较贵重的银坩埚。宋丽莉[22]采用硝酸对赤泥进行消解,取得了较好的分析结果,但未研究电离抑制剂对钠检测的影响。为了更好推广该方法用于检测赤泥中钠量,本研究尝试采用实验室常见的盐酸(1+1)对赤泥进行有效消解,并对电离抑制剂用量进行了校偏,取得了较好的效果。在常规试验条件下建立了火焰原子吸收分光光度法测量拜耳法赤泥中钠的技术方法,研究结果可为赤泥高效脱碱技术和赤泥综合利用技术的开发提供可靠的分析检测支撑。
1 试验介绍
1.1 主要仪器设备
本试验所采用的主要仪器设备见表1。

表1 本试验所采用的主要仪器设备
1.2 主要试剂和样品
本试验所采用的主要试剂:钠标准溶液、钾标准溶液(1 000 μg/mL),均来自国家有色金属及电子材料分析测试中心研究总院;浓盐酸(1.149 2 g/mL)、浓硝酸(1.84 g/mL)、浓硫酸(1.84 g/mL)、六水三氯化铝,分析纯,均来自国药集团化学试剂有限公司。
赤泥标准样品来自郑州轻金属研究院;赤泥原料则取自重庆某氧化铝厂。
试验所用水均为超纯水。
1.3 仪器工作条件
TAS-986AFG型原子吸收分光光度计参数设置见表2。

表2 TAS-986AFG型原子吸收分光光度计工作条件
1.4 试验原理
1)盐酸消解。拜耳法赤泥一般包含Al2O3、SiO2和Fe2O3等物质,Na2O含量一般为2.93%~12.9%[23-24]。根据存在形态,可将赤泥中各类碱性物质划分为化合碱和可溶性碱,其中化合碱有方钠石([Na6Al6Si6O24]·[2NaX或Na2X])、钙霞石(Na6[Al6Si6O24]·2CaCO3)、水化石榴石(Ca3Al2(SiO4)x(OH)12-4x)等,可溶性碱有NaOH、NaAlO2、Na2CO3、Na2SiO3等。为了便于分析,可将消解反应简化为Na2O与盐酸的反应,反应方程见式(1)。通过热力学计算可知,在盐酸消解过程中,赤泥中方钠石、钙霞石、水化石榴石容易被消解[25];浓盐酸(37%,1.1492 g/mL)对赤泥中Na元素消解率可达100%[26]。赤泥-盐酸消解反应属于液-固多相反应,该反应可能受到赤泥颗粒表面发生的化学反应控制影响,拟合动力学方程见式(2)。

(1)
k1t=1-(1-x)1/3
(2)
式中:x为钠的浸出率,%;k1为反应速率常数,s-1;t为反应时间,min。
2)电离抑制。电离干扰的机理可能是由于元素在火焰中形成自由原子之后发生电离,使基态原子数目减少,导致测量吸光度值降低。在标准溶液和试样中加入电离电位低的消电离剂,如KCl,可以提供大量自由电子,从而抑制或消除钠元素的电离干扰[27]。同时,共存离子Ca2+的存在也会造成电离干扰,通常加入三氯化铝-硫酸溶液,使其生成难离解化合物,难以在火焰中离子化,从而消除钙元素的干扰[28]。生成难离解化合物的方程式见式(3)。
(3)
1.5 试验方法
1.5.1 溶液的配置
1)三氯化铝-硫酸溶液。称取1 500 g结晶六水三氯化铝溶解于水中,加入1 000 mL硫酸(1+1),用超纯水稀释至10 L混匀待用。
2)钠、钾标准溶液。分别将钠、钾标准溶液(质量浓度1 000 μg/mL)稀释成含钠、钾(质量浓度 10 μg/mL)的标准溶液。分别移取钠的标准溶液0.0、0.5、1.0、2.0、3.0、4.0 mL于100 mL容量瓶中,加入0.5%的浓硝酸和适量钾的使用液,用超纯水定容,配制成含钠0.0、0.05、0.1、0.2、0.3、0.4 μg/mL标准系列溶液。按仪器工作条件测量钠标准系列溶液,在0~0.4 μg/mL范围内钠元素标准曲线呈良好线性。
1.5.2 试样的预处理与消解
将工业块状赤泥原料破碎后,在105 ℃下烘干,于干燥器中冷却至室温,采用密封式制样粉碎机粉碎30 s,过200目筛网,筛下物混匀后置于干燥器内保存备用。
称取赤泥样品0.250 0 g于聚四氟乙烯烧杯中,加20 mL盐酸(1+1),加盖表面皿,置于电热板上加热消解45 min,微沸1 min后,取下,冷却,移入250 mL容量瓶中,加20 mL三氯化铝-硫酸溶液,定容,摇匀,静置澄清30 min后待用。
1.5.3 测定
取1.5.2所述消解液1.0 mL置于250 mL容量瓶,加入0.5%的浓硝酸和适量钾标准溶液,定容。按试验确定的仪器工作条件,以不含钠标准溶液的试液为空白溶液,调零并扣除空白值后依次进行测定。仪器自动拟合吸收曲线并直接获得样品测定值。
1.5.4 计算
赤泥中氧化钠含量以百分比表示,按式(4)计算。
(4)
式中:C测为实际测量液浓度,μg/mL;C空白为空白液浓度,μg/mL;m为赤泥样品的重量,g;250、250分别为消解液体积及其稀释倍数;1.347 8即62/46,为换算系数。
1.6 试验流程
试验步骤流程如图1所示。

图1 试验步骤流程图
2 结果与讨论
2.1 电离干扰及消除
对于电离抑制剂KCl的浓度,在原子吸收分光光度计操作手册和部分参考文献中均指明为2 000 μg/mL。为验证该KCl浓度的合理性,本文配制了K+浓度2 000 μg/mL的系列钠标准溶液,测得的钠元素吸光度值超标严重(2.747~2.923),且标准曲线相关系数仅为51.48%。综合试验结果和原子吸收分光光度计使用常识来判断,该K+浓度明显过大,需要进一步优化。经多次试验表明,加入20 mL三氯化铝-硫酸溶液足以消除Ca2+干扰,后续试验中取三氯化铝-硫酸溶液加入量20 mL。
经系列试验,确定了KCl用量为0~1 μg/mL较适宜。进一步对比研究不加KCl、0.1 μg/mL KCl、1.0 μg/mL KCl对标准工作曲线的影响,结果见表3。

表3 KCl浓度对标准工作曲线的影响
由表3可知,当不加KCl时,标准工作曲线在高浓度范围内向下弯曲,线性相关系数仅为0.992 09,该现象产生的原因可能是试液中Na+在火焰中发生了电离损失;加入0.1 μg/mL KCl时,标准工作曲线线性相关系数达0.999 83,电离干扰得到有效抑制;加入1.0 μg/mL KCl时标准工作曲线线性相关系数达0.999 06,但相比0.1 μg/mL KCl略有下降。后续试验均选用0.1 μg/mL KCl来消除Na+的电离干扰。
2.2 标准工作曲线
在选定KCl 浓度0.1 μg/mL的试验条件下对系列钠标准溶液进行测量,分别以钠质量浓度x(μg/mL)为横坐标、吸光度y为纵坐标,得到回归方程、线性范围和相关系数。以0.5% HNO3+0.1 μg/mL KCl为空白溶液,在仪器最佳条件下平行测量11次,测得的吸光度值分别为0.056、0.057、0.058、0.060、0.057、0.055、0.054、0.055、0.054、0.057、0.053。根据空白溶液吸光度值计算标准偏差(SD),根据标准偏差计算得出检出限。按式(5)计算,得出钠元素的检出限为0.006 6 μg/mL。标准工作曲线及检出限见表4。

表4 标准工作曲线及检出限
DL=3SD/k
(5)
式中:DL为检出限;SD为Na+空白溶液测量的标准偏差;k为校准曲线斜率。
2.3 样品分析
2.3.1 样品消解时间的影响
样品消解时间对钠的分析检测具有重要影响,对比研究样品消解15 min和消解45 min对分析检测结果的影响,结果见5。
从表5可知,当赤泥原料消解15 min时,赤泥原料测量值(n=4)相对误差范围为-17.46%~-7.41%、测量平均值为3.27%,测得的氧化钠含量偏低且相对误差较大,出现该现象可能是因为15 min时赤泥未完全消解所致;当赤泥原料消解 45 min时,赤泥原料测量值(n=4)相对误差范围为-1.85%~0.79%、测量平均值为3.76%,测得的氧化钠含量接近赤泥原料氧化钠含量标准值且相对误差较小。因此,后续试验样品消解时间选用45 min。

表5 消解时间对赤泥原料分析检测结果的影响
2.3.2 方法准确度
采用标准加入法,往同一样品中加入0.06、0.10、0.12 μg/mL钠标准溶液,与样品同样操作,同浓度做5次重复性试验,加标回收试验结果见表6。

表6 加标回收试验结果(n=5)
由表6中可知,Na+的加标回收率为99.17%~105.00%,误差在允许范围之内。
为进一步评价本方法的准确性,对赤泥标准样品进行多次平行测量试验,试验结果见表7。

表7 赤泥标准样品准确度实验结果(n=3)
从表7中可知,对氧化钠含量3.40%的赤泥标准样品,3次测量结果的绝对误差为+0.01、相对误差为0.29%;对氧化钠含量4.60%的赤泥标准样品,3次测量结果的绝对误差为-0.01、相对误差为-0.22%。通过标准加入法和与赤泥标准样品进行比较,该方法准确度高。
2.3.3 方法精密度
将赤泥原样和赤泥标准样品进行多次重复性测量,根据其实际测量值计算出相对标准偏差(RSD),评价本方法的精密度。试验结果见表8、表9。
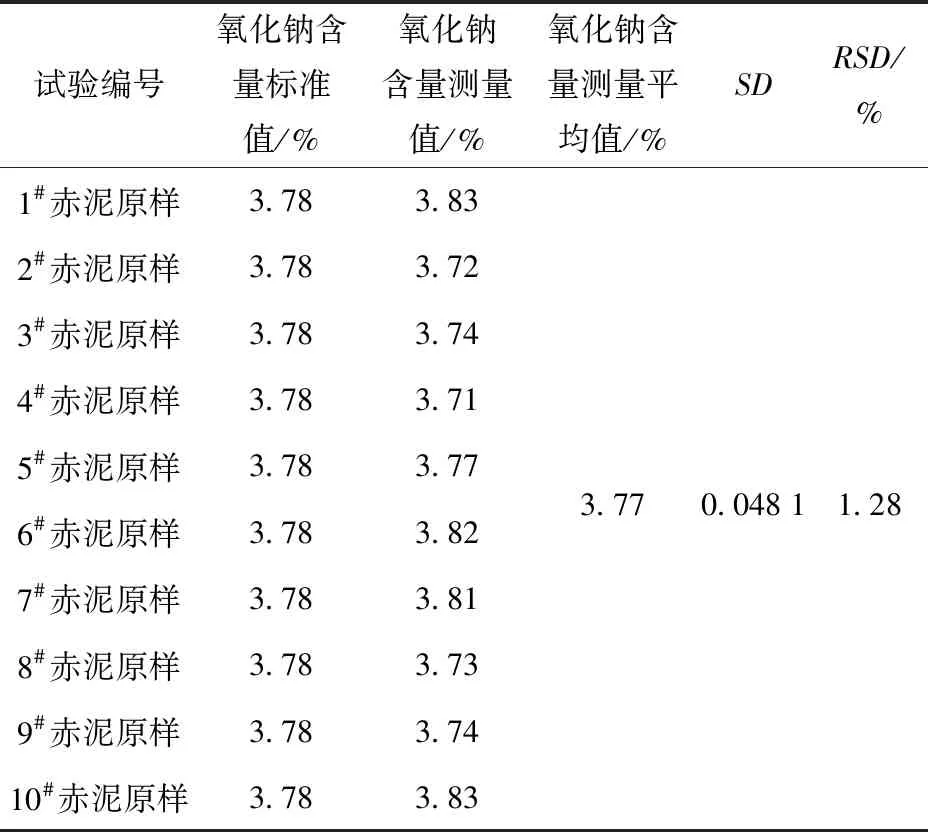
表8 赤泥原样精密度试验结果(n=10)
由表8、表9可知,赤泥原料氧化钠含量测量值的相对标准偏差RSD(n=10)为1.28%,2个赤泥标准样品氧化钠含量测量值的相对标准偏差RSD(n=3)分别为0.85%、2.72%。测量结果的相对标准偏差在误差允许范围之内,满足试验检测要求,测量的精密度好。
3 结论
1)选用试验室常见的盐酸溶液实现了赤泥样品的消解,操作简单、效果良好,且无需使用贵金属坩埚,并优化了赤泥样品消解时间,采用KCl有效消除钠的电离干扰,并纠正了文献[21]中KCl浓度的量程范围,建立了火焰原子吸收分光光度计测量拜耳法赤泥中钠的分析方法。
2)在优化测量条件下,测得标准工作曲线线性相关系数为0.999 83,检出限为0.006 6 μg/mL,加标回收率为99.17%~105.00%、赤泥标准样品测量相对误差为-0.22%~0.29%;赤泥原样测量相对标准偏差RSD(n=10)为1.28%,赤泥标准样品测量相对标准偏差RSD(n=3)为0.85%~2.72%。
3)本文建立的火焰原子吸收分光光度法测量拜耳法赤泥中钠量的分析方法,精密度好,操作简便,测量结果能满足试验要求。该研究可为拜耳法赤泥脱碱技术的开发和钠的分析检测提供技术支撑。
