葱白提取物对心肌梗死大鼠促血管新生作用及机制研究
2023-11-08罗雨佳段刚峰
罗雨佳,雷 杰,祝 炜,段刚峰
(武汉市中西医结合医院 心血管内科,湖北 武汉 430022)
据2020 年《中国心血管健康与疾病报告》显示,自2002 年以来中国心肌梗死患病率与病死率呈持续增长趋势[1]。心肌梗死是指在严重冠状动脉狭窄的情况下,出现供血区心肌严重且持续缺血,导致左心室功能障碍[2]。临床上常予以冠脉介入等方法快速有效地恢复心肌血供,避免心肌梗死的进一步严重发展。而若患者为冠状动脉远端弥漫性病变、缺血梗死病变范围广泛或不能耐受手术等情况,介入等传统血管重建手术治疗在此时出现一定的局限性[3]。所以在发生心肌梗死后,通过促进相应部位血管新生建立侧支循环代偿或许能达到更好的治疗效果,“治疗性血管新生”的观念应运而生[4]。
本团队前期研究发现,以葱白为代表的益气温阳治法能改善心肌缺血情况,减小心肌梗死区域面积,减轻心肌梗死后再灌注损伤[5-6]。本次试验拟探讨葱白提取物(fistulan onion bulb,FOB)促进血管新生的具体机制,行左冠状动脉结扎构建心肌梗死大鼠模型,通过CD34 免疫组化染色观察新生血管情况,并研究葱白提取物对TGF-β 及MEK/ERK 通路的调控作用,发掘葱白提取物对于心肌梗死后相应区域新生血管的影响及机制。
1 材料和方法
1.1 材料
1.1.1 试验动物 SPF 级SD 大鼠40 只,雄性,3~ 4 月龄,体重(200 ± 20)g,购于湖北省实验动物研究中心(42000600004917)。
1.1.2 药物 葱白提取物(武汉市中西医结合医院提供,批号2081205)配成浓度300 mg/mL 混悬液;麝香保心丸(上海和黄药业有限公司,批号:Z31020068),配成浓度7.5%混悬液。
1.1.3 试剂 TGF-β 试剂盒(欣博盛生物科技有限公司),RIPA 裂解液、50*cooktail、PMSF、磷酸化蛋白酶抑制剂、SDS-PAGE 凝胶制备试剂盒、ECL、显影定影试剂(武汉谷歌生物科技有限公司),三氯甲烷、异丙醇、无水乙醇、二甲苯、H2O2(国药集团化学试剂有限公司),抗兔/鼠通用型免疫组化试剂盒(丹麦Agilent Dako 公司),BSA(罗氏制药公司)。
1.1.4 主要仪器 分光光度仪、高精度加液器(美国GeneRay 公司,UV-photomete 型),TGL-16c 台式离心机(上海安亭科学仪器厂),荧光定量PCR 仪(上海宏石医疗科技有限公司),纯水仪(青岛富勒姆科技有限公司,FBZ2001-up-p 标准试剂型),WD-9405A 脱色摇床、DYY-6C 电泳仪(北京六一仪器厂),AX-Ⅱ暗匣(广东粤华医疗器械厂有限公司),感光胶片(美国Eastman Kodak 公司),V300 扫描仪(日本EPSON 公司),alphaEaseFC 灰度分析软件(Alpha Innotech 公司),HX200 动物人工呼吸机(成都春盟科技有限公司)。
1.2 方法
1.2.1 大鼠心肌梗死造模 将大鼠于SPF 级动物房分笼适应性饲养1 周,再行造模。首先将大鼠经腹腔注射麻醉(10%水合氯醛,3 mL/kg),再取仰卧位固定大鼠四肢于无菌操作台上,颈、胸部备皮及消毒处理,连接心电图记录仪,记录术前正常心电图。用小型动物呼吸机行有创呼吸支持,而后打开胸腔,充分暴露心脏术野,4 号线结扎大鼠冠状动脉左前降支。根据心电图记录仪Ⅰ、Ⅱ导联出现ST 段上抬,同时左室心肌组织颜色变浅为结扎成功标准[7]。术毕将心脏回纳,缝合胸腔。假手术组操作步骤同上,但只放置手术线不结扎冠脉(造模后死亡3 只大鼠,当即予以补充,步骤同前)。
1.2.2 分组、给药 将造模成功大鼠编号,通过随机数字表分成模型组、葱白提取物组、麝香保心丸组、假手术组,每组10 只。于造模后给药,葱白提取物组及麝香保心丸组各以2 mL/kg 的剂量标准灌胃给药,模型组和假手术组予同体积生理盐水灌胃,每日1 次,持续28 d。
1.2.3 标本采集、指标检测 持续给药28 d 后,次日清晨开始行腹腔麻醉(方法同上),麻醉完全后,从腹主动脉处采血3 mL,立即置于离心机离心15 min(3 000 r/min),用移液枪取上层血清于EP 管,采用ELISA 法快速检测大鼠血清TNF-β 含量,具体步骤依照TGF-β 试剂盒说明书进行。剪取心脏左心室组织,0.9%氯化钠溶液冲洗后,放入4%多聚甲醛溶液浸没固定24 h,再依次行多梯度酒精脱水、二甲苯透明处理、石蜡包埋,切片,烤片,存储。
1.2.4 CD34 染色并检测微血管数量及密度 以ELPS(Enhance Labeled Polymer System)[8]法将预处理好的心肌切片先行TBS 处理、蒸馏水漂洗,再依次置入一抗、EnVision、色源底物溶液孵育30 min,蒸馏水漂洗封片。每组内每张切片随机选取200 倍3 处视野进行拍照记录,运用Image 6.0图像分析软件分析出每张照片心肌组织面积和相应微血管计数数量(MVQ),平均微血管计数数量比上心肌面积就能得到微血管密度(MVD)。
1.2.5 Western Blot 法检测MEK、ERK 蛋白含量 取冻存心肌组织常温解冻,剪碎成小块置于组织液中进行匀浆,取1.5 mL 匀浆液离心,收集上清液,即为总蛋白溶液。采用Bradford 法测定蛋白浓度,计算上样量值。随后进行SDS-PAGE 电泳,100 V 上样电泳60 min,200 mA 转膜60 min,5%脱脂牛奶封闭60 min,加入一抗(稀释1∶1 000)4 ℃孵育过夜,TBST 清洗3 次,加入二抗(稀释1∶3 000)孵育30 min,再次TBST 清洗3 次。行化学发光显影,样本灰度值用AlphaEase FC 软件分析。
1.2.6 RT-PCR 法检测MEK mRNA、ERK mRNA 扩增倍数 取100 mg 心肌组织加入匀浆器研磨至无小块状组织,加入250 μL 三氯甲烷颠倒混匀随后平放3 min,在4 ℃下离心8 min(13 000 r/min),用移液枪移取上清液,再加异丙醇继续颠倒混匀,-20 ℃平放15 min 后离心10 min(13 000 r/min),吸去液体,继续加入75%乙醇1.5 mL 洗涤,再次4 ℃、13 000 r/min 离心5 min,去除液体,即能得到总RNA。然后于PCR 机上,使RNA 溶液与10 mmol/L dNTPs、RNA inhibitor、反转录酶混合反应30 min,结束时灭活反转录酶(80 ℃保温5 min)得到cDNA。取20 μLPCR 管配置PCR 反应体系(2 × qPCR Mix 12.5 μL、7.5 μmol/L 基因引物2.0 μL、cDNA 2.5 μL、ddH2O 8.0 μL),95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火60 s,循环40 次,60 ℃延伸5 min,将得到的扩增结果以2-ΔΔCT 法进行处理并整理呈图表。各引物信息见表1。
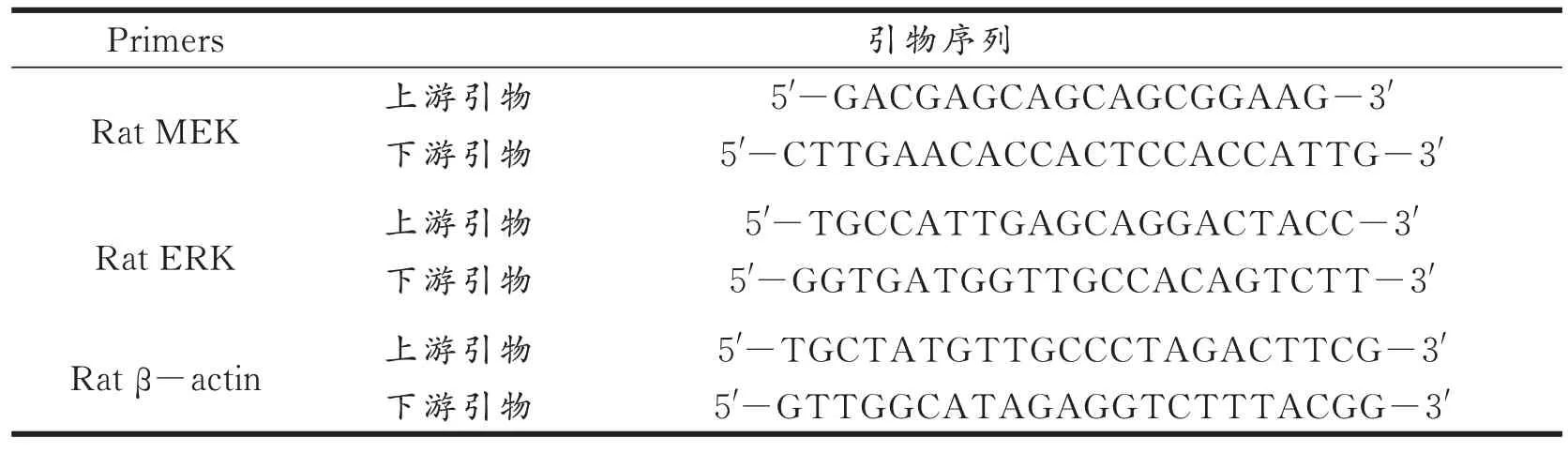
表1 各PCR 引物序列Tab.1 PCR primer sequences
1.2.7 统计学方法 实验中使用SPSS19.0 统计软件对数据进行分析,结果以均数±标准差(xˉ±s)表示,使用单因素方差分析比较多组间的均值,以P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠心肌梗死边缘区微血管密度及CD34 免疫组化染色
结果见表2 和图1。由表2 结果可知,与假手术组相比,心梗模型大鼠心肌微血管密度升高(P<0.01);且与模型组相比,应用葱白、麝香保心丸治疗的大鼠MVD 数值均进一步升高(P<0.01)。
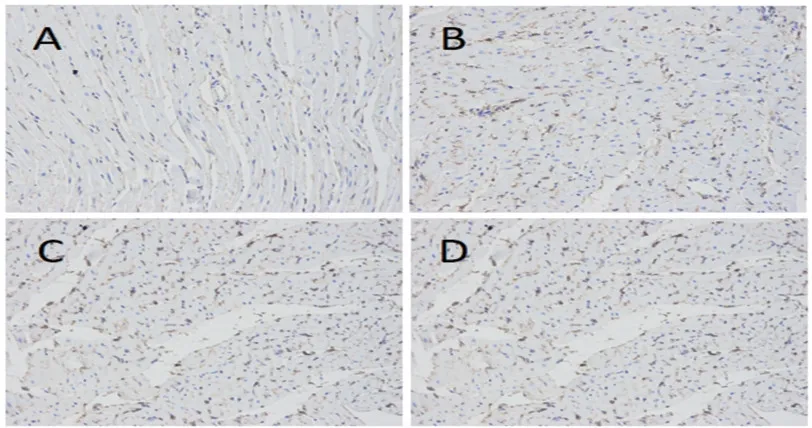
图1 四组大鼠心梗边缘区心肌组织CD34 染色结果(×200)Fig.1 CD34 staining results of myocardial tissue in the marginal zone of myocardial infarction in four groups of rats (× 200)

表2 各组大鼠心梗边缘区微血管密度Tab.2 MVD in the marginal area of myocardial infarction in rats of each group(xˉ± s)(n=10)
2.2 各组大鼠血清TGF-β 水平比较
结果如表3 所示。模型组大鼠血清TGF-β 水平较假手术组明显升高(P<0.01)。与模型组相比,麝香保心丸组、葱白组大鼠血清TGF-β 水平均升高(P<0.05,P<0.01),且葱白组血清TGF-β 与麝香保心丸组比较无统计学差异(P>0.05)。

表3 各组大鼠血清TGF-β 含量比较Tab.3 Serum TGF-β content comparison of rats in each group(xˉ± s)(n=10)
2.3 各组大鼠心肌边缘区MEK、ERK 灰度比值比较
结果见图2。由图2 可知与假手术组比较,模型组大鼠心肌ERK/actin 比值下降(P<0.01),MEK/actin 比值无明显差别(P>0.05)。与模型组比较,麝香保心丸组、葱白组心肌MEK/actin、ERK/actin 比值均明显上升(P<0.01);与麝香保心丸组比较,葱白组心肌MEK/actin 比值无明显差异(P>0.05),ERK/actin 比值有所降低(P<0.01)。
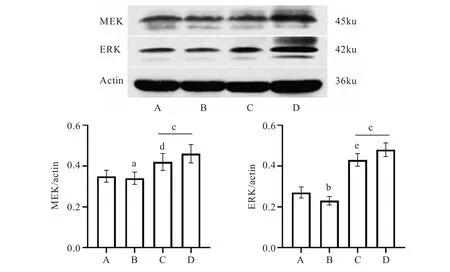
图2 各组大鼠心梗边缘区MEK、ERK 蛋白表达(n=10)Fig.2 Expression of MEK and ERK proteins in the marginal zone of myocardial infarction in rats of each group(n=10)
2.4 各组大鼠心梗边缘区MEK mRNA、ERK mRNA 表达比较
结果见图3。由图3 可知,以假手术组为参照对比,记录其余各组大鼠心梗边缘区MEK mRNA、ERK mRNA 扩增倍数。葱白组和麝香保心丸组较模型组而言,上述指标均极显著增加(P<0.01);与麝香保心丸组比较,葱白组MEK mRNA、ERK mRNA 扩增倍数均明显降低(P<0.01,P<0.05)。
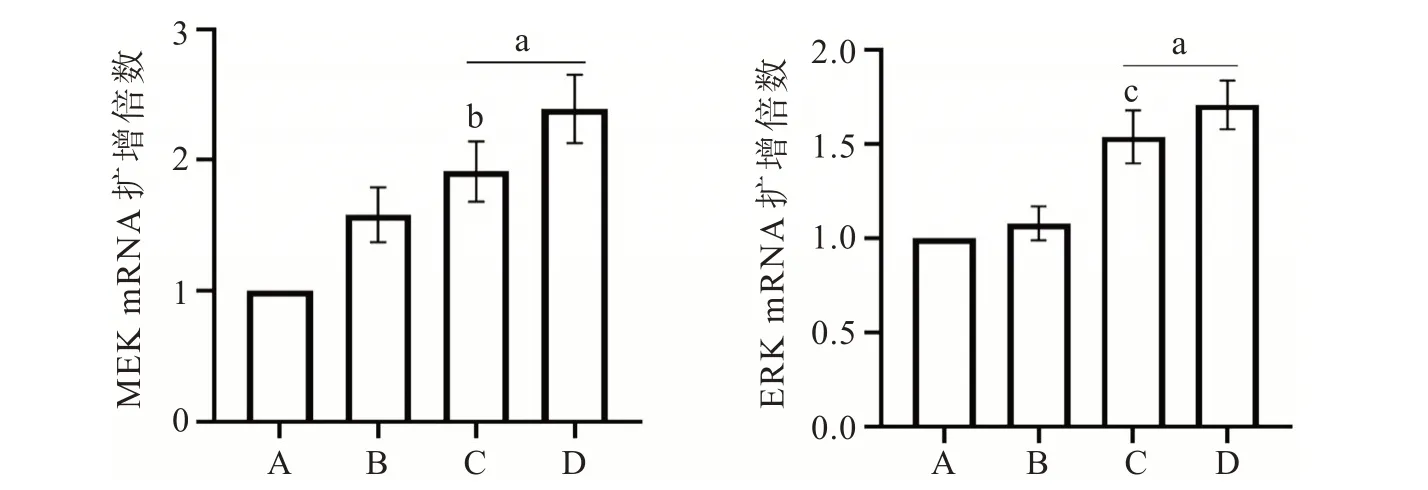
图3 各组大鼠心梗边缘区MEK mRNA、ERK mRNA 表达情况Fig.3 Expression of MEK mRNA and ERK mRNA in the marginal zone of myocardial infarction in rats of each group
3 讨论
中医药在心血管系统疾病治疗方面有着悠久的历史,如《金匮要略》所言:“夫脉当取太过不及,阳微阴弦,即胸痹而痛”指出胸痹主要病机为上焦心阳虚衰,治当以温阳通脉[9]。葱白为辛温通阳药,具有温通心脉,宣通胸阳的作用。且葱白提取物能抗氧化损伤、抑制炎症反应,对心肌缺血损伤大鼠心肌有保护作用[10]。
当冠状动脉的血供急剧减少或中断时,冠脉微循环也遭受巨大损伤,梗死区发生微血管解体和毛细血管狭窄,相应供血区域心肌组织能量和氧气都会急剧减少,血管内皮细胞缺氧诱导因子被激活,静止的内皮细胞重新调整血管形状来优化血流[11]。但仅靠自发性代偿性血流调节远远不够,目前临床常见的治疗手段如血管介入和冠脉搭桥手术均旨在尽快改善心肌组织缺血情况,若为冠状动脉远端弥漫性病变或不能耐受手术,采用促血管新生治疗建立侧支循环也不妨是一种更合适的治疗手段。
血管新生是一个复杂的过程。首先是血管活化阶段,血管基底膜降解、通透性增加,使血管内皮细胞可以迁移到缺血区,以出芽的方式形成新的毛细血管,其次是血管稳定阶段,血管内皮细胞分泌TGF-β 将间充质细胞召集到血管周围,并分化为周细胞和成纤维细胞,紧密保护新生血管[12]。TGF-β1 可以启动周细胞祖细胞的分化,也能推动神经嵴或间充质来源的祖细胞分化为平滑肌样细胞[13]。内皮素敲除小鼠的实验证实了TGF-β1 在这一过程中的功能意义,这些小鼠由于血管重构缺陷和平滑肌细胞分化而无法存活[14]。内皮素是一种TGF-β 结合蛋白,也被称为TGF-β III 型受体。也有研究[15]发现,麝香通心滴丸可促进心梗大鼠的心肌梗死区血管新生,减小梗死面积,上调心肌TGF-β1 蛋白表达。
TGF-β 的下游信号通路,除了经典的Smad 通路外,还有丝裂原活化蛋白激酶(MAPK)信号通路[16]。MAPK 通路是由Ras、Raf、MEK 和ERK 组成的一系列蛋白激酶,在所有真核细胞中都具有高度保守特性[17]。ERK 是介导血管生成的重要信号蛋白,可被细胞外生长因子刺激,然后通过其下游细胞质或细胞核中的信号分子调控内皮细胞的细胞周期、增殖、迁移、凋亡和血管生成[18]。研究[19]发现,丹红注射液可通过激活ERK 信号通路,上调ERK、MEK 磷酸化水平,减小心肌梗死模型小鼠的心梗面积、增加心梗边缘区毛细血管密度、提高心脏射血分数。
本试验通过CD34 免疫组化染色发现,葱白提取物能增加心肌梗死边缘区新生血管数量,有促血管新生作用,同时其也能明显提升血清TGF-β 及心肌组织中MEK、ERK 表达含量。综上所述,葱白提取物促血管新生改善心肌缺血情况有正向作用,其作用机制可能通过上调TGF-β及MEK/ERK 信号通路水平有关,最终实现促血管新生促进心肌梗死区侧支循环血管建立。
