黄芦木内生真菌Talaromyces tiftonensis SN34的次生代谢产物研究
2023-11-08谷荆洲任文静鲍梦雨陈志武
谷荆洲,任文静,鲍梦雨,李 想,陈志武,姜 荣
黄芦木内生真菌Talaromyces tiftonensis SN34的次生代谢产物研究
谷荆洲1, 4,任文静2, 3,鲍梦雨2, 3,李 想4,陈志武1*,姜 荣2*
1. 安徽医科大学基础医学院,安徽 合肥 230022 2. 澳门科技大学中医药质量研究国家重点实验室,澳门 999078 3. 山东中医药大学药学院,山东 济南 250355 4. 安徽医科大学第一附属医院,安徽 合肥230022
研究黄芦木叶片内生真菌SN34的次生代谢产物及生物活性。采用正相硅胶、Sephadex LH-20凝胶、ODS等柱色谱和反相高效液相柱色谱对SN34的次生代谢物进行分离纯化,利用HRESIMS、NMR等谱学技术对化合物进行结构鉴定,并通过体外实验评价化合物抗菌、抗神经炎、细胞毒活性。从SN34 的大米发酵物中分离得到7个化合物,分别鉴定为(2)-4-甲氧基-2-羟基丙烷-6-甲基-2,3-二氢苯并呋喃-5-硫代甲酸酯(1)、()-4-羟基-2-羟基丙烷-6-甲基-2,3-二氢苯并呋喃-5-甲酸甲酯(2)、赤散囊菌素A(eurothiocin A,3)、2,3-二氢-2-(1-甲基乙烯基)-5-苯并呋喃甲醇(4)、意大利鼠李素(alaternin,5)、1,3,6-三羟基-7-(1-羟乙基)-9,10-蒽二酮(6)和BK223-B(7)。其中,化合物5对耐甲氧西林金黄色葡萄球菌(methicillin-resistant,MRSA)菌株的最小抑菌浓度为31.25 μg/mL。20 μmol/L的化合物3和5对脂多糖(lipopolysaccharides,LPS)诱导的BV2细胞产生一氧化氮(nitric oxide,NO)的抑制率分别为(69.90±1.34)%和(54.50±4.15)%。此外,化合物5和7可以抑制胰腺癌细胞PANC-1和BxPC的细胞增殖。化合物1为新型含硫苯并呋喃衍生物,命名为赤散囊菌素C;化合物2~7为首次从SN34中分离得到。化合物5对MRSA菌株具有一定的抑制作用。化合物3和5可以抑制LPS诱导的小鼠小胶质细胞系BV2细胞中NO的产生,具有一定的抗神经炎活性。此外,化合物5和7对PANC-1和BxPC细胞增殖具有抑制作用。
黄芦木;植物内生菌;SN34;生物活性;赤散囊菌素C;赤散囊菌素A;意大利鼠李素
植物内生菌几乎普遍存在于植物的各个组织中,它们是植物防御共同体,由内生菌代谢的生物活性化合物又是内生菌进化的关键[1-2]。植物能够产生多样性生物活性次生产物,但需要大量的植物原料才能获取少量的目标产物[3]。随着对天然产物研究的不断增加,作为具有结构多样性的生物活性代谢物的重要来源,内生菌越来越广泛的被探索[4]。内生菌及其次生代谢产物极大地丰富了天然产物的化学和生物多样性[5]。黄芦木Rupr. 属于小檗科(Berberidaceae)的落叶灌木,具有清热燥湿、泻火解毒的功效,其根和茎用于治疗高血压、炎症、痢疾、肠炎、黄疸等疾病[6],有广泛的药理作用和药用价值。然而,对该植物内生菌代谢产物的研究却鲜有报道。属菌株颇为丰富,其次生代谢产物物类型具有多样性,包括苯并二氢吡喃酮类、异香豆素类、苯并呋喃衍生物、蒽酮类及类萜类成分。其中苯并呋喃衍生物及蒽酮类曾多次被分离得到,其具有细胞毒、抗神经炎、抗菌、α-葡萄糖苷酶抑制等活性,而关于菌株SN34次生代谢产物尚未报道[7]。因此本研究以内生菌SN34的大米发酵物为研究对象,旨在获得更多具有生物活性的苯并呋喃衍生物及蒽酮类化合物。最终分离得到7个化合物,分别鉴定为 (2)-4-甲氧基-2-羟基丙烷-6-甲基-2,3-二氢苯并呋喃-5-硫代甲酸酯赤散囊菌素 C [-methyl ()-2-(2-hydroxypropan-2-yl)-4-methoxy-6-methyl-2,3-dihydrobenzofuran-5-carbothioate,1]、()-4-羟基-2-羟基丙烷-6-甲基-2,3-二氢苯并呋喃-5-甲酸甲酯[methyl()-4-hydroxy-2-(2-hydroxypropan-2-yl)-6-methyl-2,3-dihydrobenzofuran-5-carboxylate,2]、赤散囊菌素A(eurothiocin A,3)、2,3-二氢-2-(1-甲基乙烯基)-5-苯并呋喃甲醇 [2,3-dihydro-2-(1-methylethenyl)-5-benzofuranmethanol,4]、意大利鼠李素(alaternin,5)、1,3,6-三羟基-7-(1-羟乙基)-9,10-蒽二酮[1,3,6-trihydroxy-7-(1-hydroxyethyl)-9,10-anthracenedione,6]和BK223-B(7)。其中,化合物1为新的含硫苯并呋喃衍生物,命名为赤散囊菌素C;化合物2~7均为首次从内生菌SN34获得;以上化合物的抗菌、抗神经炎和细胞毒活性实验表明,化合物5对MRSA菌株具有一定的抑制作用。化合物3和5可以抑制LPS诱导的小鼠小胶质细胞系BV2细胞中NO的产生,具有一定的抗神经炎活性。此外,化合物5和7对胰腺癌细胞系PANC-1和BxPC细胞增殖具有抑制作用。
1 仪器与材料
1.1 仪器与试剂
Autopol III旋光仪(美国鲁道夫公司),Evolution 300紫外光谱仪(美国赛默飞世尔科技公司),Bruker Tensor 27红外光谱仪(德国布鲁克公司),Bruker Avance III 500 MHz型核磁共振波谱仪(德国布鲁克公司),安捷伦Agilent 6210 TOF LC-MS液质联用(美国安捷伦公司),安捷伦Aligent 1100高效液相色谱仪(美国安捷伦公司),SPH 3332型大型双层敞开式摇床(上海世平实验设备有限公司),Biotek ELx800酶标仪(美国Biotek公司)。柱色谱硅胶(300~400目)和GF254薄层色谱硅胶板(青岛海洋化工有限公司),反相RP-18(日本富士硅化学株式会社),Sephadex LH-20(美国通用电气公司),Aligent Eclipse XDB-C18色谱柱(250 mm×9.4 mm,5 µm;美国安捷伦公司),色谱级甲醇和乙腈(美国TEDIA公司),其他试剂为成都科隆试剂有限公司。DMEM培养基、特级胎牛血清(FBS)和青霉素-链霉素溶液(×100,美国Gibco公司),美罗培南(美国MedChemExpress公司,批号274875),阿霉素(美国MedChemExpress公司,批号251055),槲皮素、脂多糖(lipopolysaccharides,LPS)和噻唑蓝(Thiazolyl Blue,MTT,美国Sigma-Aldrich公司),一氧化氮试剂盒(上海碧云天生物技术有限公司)。
1.2 菌株来源
菌株SN34分离自新鲜黄芦木叶片(2021年7月采自中国陕西省安康市),植物经西北农林科技大学吴振海高级实验师鉴定为黄芦木Rupr.,菌株经北京麦克罗科技有限公司鉴定为SN34,现存放于安徽医科大学基础医学院。
1.3 细胞株
小鼠小胶质细胞BV-2细胞系和胰腺癌细胞株 PANC-1、BxPC均购买自北京协和医学院细胞资源中心。
2 方法
2.1 发酵培养
2.1.1 菌株培养基制备 土豆液体/固体培养基:将200 g的土豆去皮切成1 cm3小块,开水煮20 min,加入20 g葡萄糖,最后定容至1 L。固体培养基则加入20 g琼脂粉。大米固体培养基:将40 g大米置于500 mL锥形瓶中,加入60 mL去离子水,置于高压蒸汽灭菌锅中在121 ℃灭菌30 min,备用。
2.1.2 菌株发酵 将菌株SN34接种于马铃薯葡萄糖琼脂平板(potato glucose agar plates,PDA)上,置于培养箱中培养7 d。观察到菌丝长满且菌落正常后,再将菌块接种于多个PDA平板上,继续孵育7 d。将约十几块菌块(约0.5 cm2)接种于马铃薯葡萄糖(potato glucose,PD)液体培养基中,在120 r/min摇床上培养7 d后,将200 μL种子液接种于大米固体培养基中,室温培养28 d。
2.2 次生代谢产物的提取与分离
将内生真菌SN34的发酵物用甲醇浸提3次,粗提液用醋酸乙酯萃取后得到醋酸乙酯部位浸膏约26.7 g,将该浸膏经硅胶柱色谱(石油醚-醋酸乙酯10∶1、5∶1、2∶1;二氯甲烷-甲醇100∶1、50∶1、25∶1)进行梯度洗脱,经薄层色谱(TLC)检识后合并得到分成8个组分(Fr. A~H);Fr. A经Sephadex LH-20柱色谱(甲醇)得到7个组分Fr. A1~A7。Fr. A5经过反相ODS柱色谱(30%→80%甲醇-水)梯度洗脱,又通过制备 HPLC(50%乙腈-水,2 mL/min)进一步纯化,得到化合物1(R=27.2 min,7.3 mg)、2(R=29.5 min,5.2 mg)和3(R=22 min,64.8 mg)。Fr. B经过Sephadex LH-20柱色谱(甲醇)及制备HPLC(50% 甲醇-水,2 mL/min)得到化合物4(R=31.5 min,4.5 mg)。Fr. C经过Sephadex LH-20柱色谱(甲醇-二氯甲烷3∶1)分离后得到Fr. C1~C4。Fr. C3经过反相ODS柱色谱(30%→80%甲醇-水)梯度洗脱及反复重结晶(甲醇)得到化合物5(28.1 mg)和6(35.3 mg)。Fr. D经过反相ODS柱色谱(50%→90%甲醇)和Sephadex LH-20柱色谱(甲醇-二氯甲烷3∶1)分离后得到Fr. D4.1~D4.4。其中Fr. D4.2经过反相ODS柱色谱(30%→80%甲醇-水)梯度洗脱及制备HPLC(60%乙腈-水,2 mL/min)得到化合物7(R=21.5 min,16.2 mg)。
2.3 抗菌活性测试
将在Luria-Bertani(LB)固体平板上活化好的MRSA ATCC43300接种到Mueller-Hinton液体培养基上,在37 ℃下培养过夜,在4000 r/min离心10 min,弃上清,将收集的菌体重新悬浮于Mueller- Hinton培养基中,并稀释至600 nm下吸光度()值为0.5。用Mueller-Hinton培养基将菌体进一步稀释至约1×105CFU/mL,并接种至96孔板(100 μL/孔)。配制化合物终质量浓度为0~125 µg/mL。不含化合物的作为阴性对照;美罗培南作为阳性对照药。在37 ℃下培养24 h后观察没有菌生长的最小浓度即为最小抑制浓度(minimal inhibit concentration,MIC)[8]。
2.4 抗神经炎活性测试
采用Griess试剂法测定化合物对LPS诱导的BV2细胞NO产生的影响。将BV-2细胞培养于DMEM(10% FBS和1%青霉素/链霉素双抗)培养基中,在37 ℃、5% CO2条件下培养至对数生长期,以2×104/孔的密度接种于96孔板中,培养24 h;加入1 μg/mL LPS和不同浓度的待测化合物同时处理24 h,槲皮素作为阳性对照;NO的生成量采用NO检测试剂盒测定,最后用酶标仪测定550 nm处的值[9]。
2.5 细胞毒活性测试
采用MTT法测定化合物对2种胰腺癌细胞系(PANC-1和BxPC)的细胞毒活性。将2种胰腺癌细胞PANC-1和BxPC细胞培养于DMEM(10% FBS和1%青霉素/链霉素双抗)培养基中,培养至对数生长期,以2×104/孔的密度接种于96孔板中,继续培养24 h。再加入待测化合物(50 μml/L)处理48 h,阿霉素作为阳性对照。每孔加入5 mg/mL MTT溶液10 μL,静置4 h,弃上清,每孔加入100 μL DMSO溶液,最后用酶标仪测定570 nm处的值[10]。
2.6 统计学处理
3 结果
3.1 结构鉴定
与化合物3不同之处在于,化合物1中含有1个甲氧基,根据HMBC谱图中H-14 (3.86, 3H, s) 与C-4相关确定了甲氧基位于C-4位。HMBC谱中显示,H-7 (6.37, 1H, s) 与C-3a和C-5相关,H-12 (2.47, 3H, s) 与C-11相关,以及H-13 (2.23, 3H, s) 与C-5和C-7相关,因此确证结构中苯并硫酸甲酯片段(图1)。通过实测和计算的ECD光谱分析,推断出化合物1的绝对构型为(图2)。综上所述,化合物1鉴定为 (2)-4-甲氧基-2-羟基丙烷-6-甲基- 2,3-二氢苯并呋喃-5-硫代甲酸酯,经检索,该化合物为新化合物,命名为赤散囊菌素C(eurothiocin C)。
化合物2:无色油状物;[α]25 D-83.9(0.5, CHCl3);HR-ESI-MS/289.104 6 [M+Na]+,推测其分子式为C14H18O5;1H-NMR (500 MHz, CDCl3): 11.8 (1H, s, 4-OH), 6.25 (1H, s, H-7), 4.71 (1H, dd,= 9.6, 8.2 Hz, H-2), 3.92 (3H, s, H-12), 3.14 (1H, dd,= 15.6, 9.6 Hz, H-3α), 3.05 (1H, dd,= 15.6, 8.3 Hz, H-3β), 2.50 (3H, s, H-13), 1.33 (3H, s, H-9), 1.21 (3H, s, H-10);13C-NMR (125 MHz, CDCl3): 172.3 (C-11), 164.6 (C-4), 160.2 (C-7a), 143.8 (C-6), 111.0 (H-3a), 105.7 (C-5), 105.3 (C-7), 91.2 (C-2), 72.0 (C-8), 51.8 (C-12), 27.7 (C-3), 25.9 (H-9), 24.7 (H-13), 23.7 (H-10)。上述数据与文献报道一致[12],推测该化合物为()-4-羟基-2-羟基丙烷-6-甲基-2,3-二氢苯并呋喃-5-甲酸甲酯。
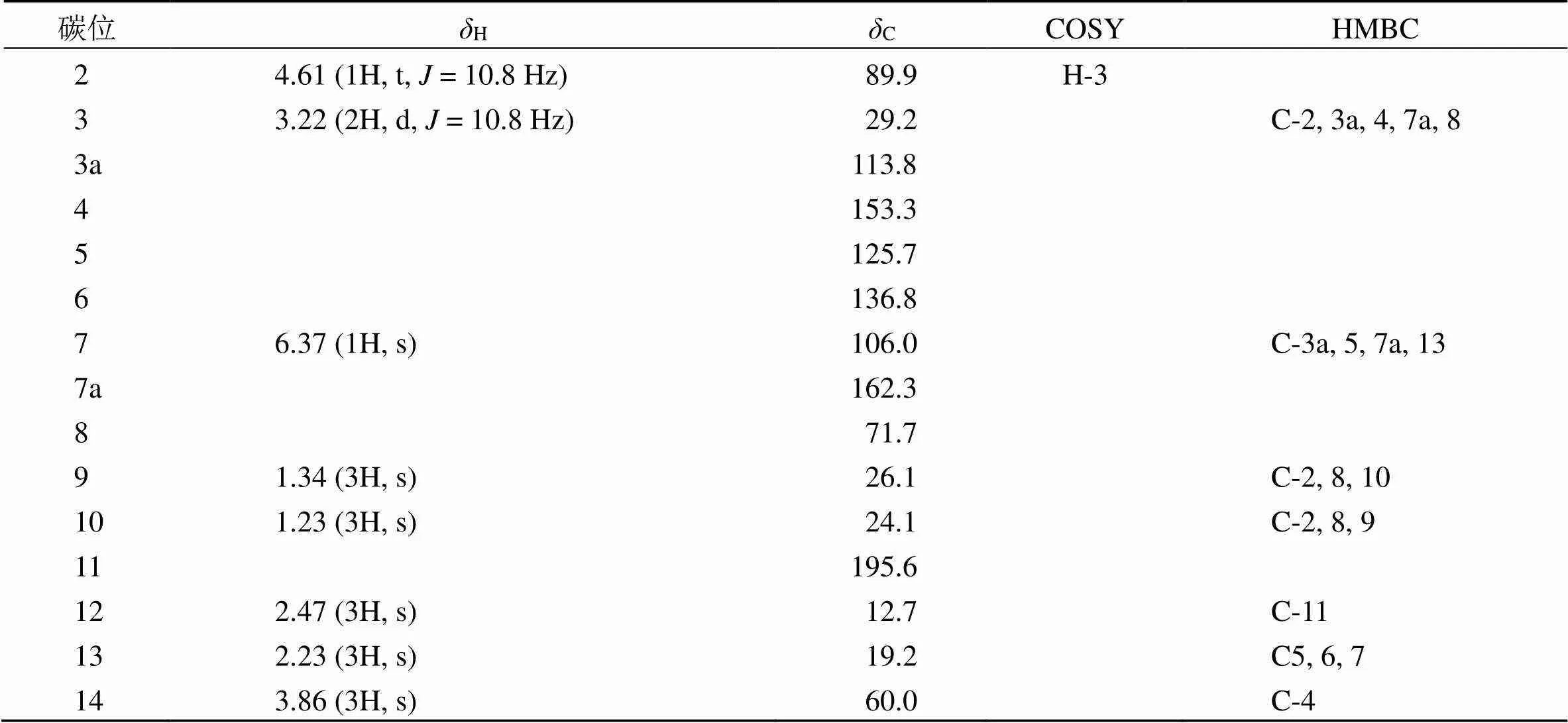
表1 化合物1的核磁波谱数据(500/125 MHz, CDCl3)
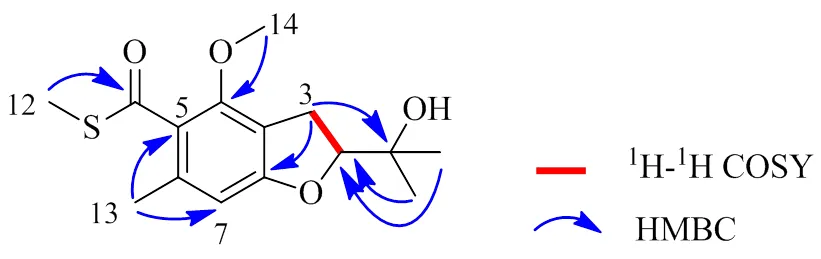
图1 化合物1的主要1H-1H COSY和HMBC相关
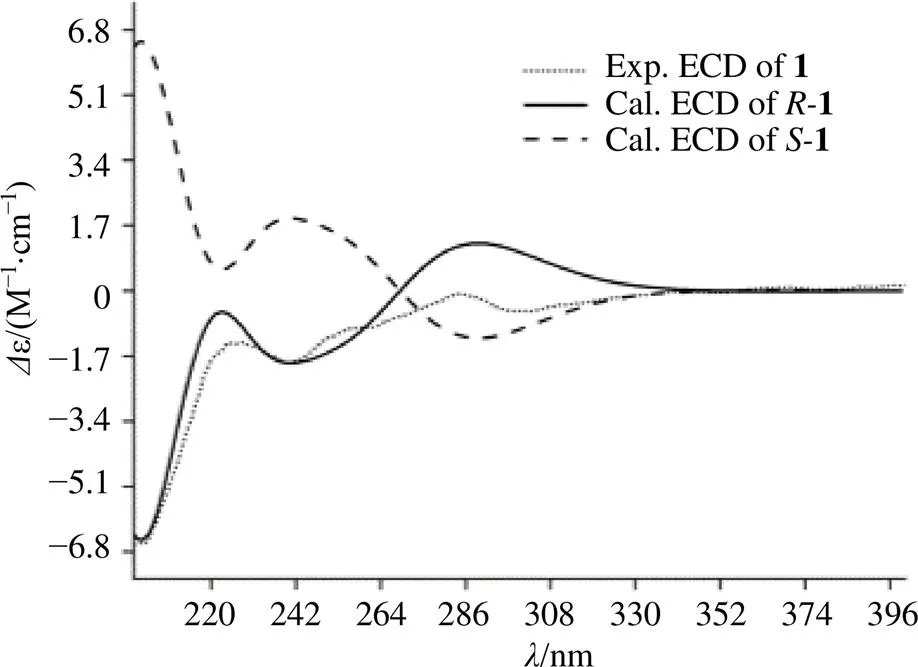
图2 化合物1的实测和计算ECD谱图
化合物3:无色油状物;[α]25 D-148.7(0.5, CHCl3);HR-ESI-MS/: 305.081 6 [M+Na]+,推测其分子式为C14H18O4S;1H-NMR (500 MHz, CDCl3): 11.9 (1H, brs, 4-OH), 6.24 (1H, s, H-7), 4.70 (1H, t,= 8.9 Hz, H-2), 3.12 (1H, dd,= 15.6, 9.6 Hz, H-3α), 3.04 (1H, dd,= 15.6, 8.3 Hz, H-3β), 2.66 (3H, s, H-13), 2.45 (3H, s, H-12), 1.30 (3H, s, H-9), 1.20 (3H, s, H-10);13C-NMR (125 MHz, CDCl3): 197.8 (C-11), 164.3 (C-7a), 157.9 (C-4), 141.7 (C-6), 116.2 (C-5), 111.5 (C-3a), 105.7 (C-7), 91.3 (C-2), 71.9 (C-8), 27.7 (C-3), 25.5 (C-9), 24.9 (C-13), 24.0 (C-10), 13.0 (C-12)。上述数据与文献报道一致[11],推测该化合物为赤散囊菌素A。
化合物4:无色油状物;HR-ESI-MS/: 213.089 3 [M+Na]+,推测其分子式为C12H14O2;1H-NMR (500 MHz, Acetone-6): 7.17 (1H, s, H-4), 7.08 (1H, d,= 8.1 Hz, H-6), 6.69 (1H, d,= 8.1 Hz, H-7), 5.18 (1H, t,= 8.8 Hz, H-2), 5.06 (1H, s, H-9α), 4.87 (1H, s, H-9β), 4.51 (2H, d,=3.6 Hz, H-11), 3.36 (1H, dd,= 15.7, 9.6 Hz, H-3α), 3.00 (1H, dd,= 15.7, 8.0 Hz, H-3β), 1.75 (3H, s, H-10);13C-NMR (125 MHz, Acetone-6): 159.0 (C-7a), 144.7 (C-8), 134.6 (C-5), 126.7 (C-4), 126.7 (C-6), 123.8 (C-3a), 110.8 (C-9), 108.2 (C-7), 85.4 (C-2), 63.8 (C-11), 34.4 (C-3), 16.5 (C-10)。上述数据与文献报道一致[13],推测该化合物为2,3-二氢-2-(1-甲基乙烯基)-5-苯并呋喃甲醇。
化合物5:橘黄色粉末;HR-ESI-MS/: 309.036 4 [M+Na]+,推测其分子式为C15H10O6;1H-NMR (500 MHz, Acetone-6): 7.28 (1H, brs, H-4), 7.01 (1H, brs, H-5), 6.75 (1H, s, H-7), 2.32 (3H, s, H-15);13C-NMR (125 MHz, Acetone-6): 190.6 (C-9), 182.5 (C-10), 165.6 (C-3), 165.4 (C-1), 161.9 (C-8), 148.4 (C-6), 134.2 (C-14), 132.2 (C-11), 123.4 (C-7), 120.6 (C-5), 113.7 (C-12), 109.6 (C-13), 107.5 (C-4), 107.5 (C-2), 21.4 (C-15)。上述数据与文献报道一致[14],推测该化合物为意大利鼠李素。
化合物6:黄色粉末;HR-ESI-MS/: 323.052 5 [M+Na]+,推测其分子式为C16H12O6;1H-NMR (500 MHz, CD3OD): 8.23 (1H, s, H-5), 7.40 (1H, s, H-8), 7.03 (1H, d,= 2.4 Hz, H-1), 6.45 (1H, d,= 2.4 Hz, H-3), 5.18 (1H, q,= 6.5 Hz, H-15), 1.46 (3H, d,= 6.5 Hz, H-16);13C-NMR (125 MHz, CD3OD):187.3 (C-10), 183.7 (C-9), 166.3 (C-2), 166.0 (C-4), 160.9 (C-7), 140.9 (C-6), 136.6 (C-11), 135.3 (C-13), 126.9 (C-14), 126.4 (C-5), 113.4 (C-8), 110.8 (C-12), 109.2 (C-1), 108.9 (C-3), 65.8 (C-15), 23.6 (C-16)。上述数据与文献报道一致[15],推测该化合物为1,3,6-三羟基-7-(1-羟乙基)-9,10-蒽二酮。
化合物7:无色油状物;[α]25 D-23.1(0.5, MeOH);HR-ESI-MS/: 685.210 9 [M+Na]+,推测其分子式为C32H38O15;1H-NMR (500 MHz, Acetone-6): 6.35 (1H, t,= 2.1 Hz, H-6), 6.34 (1H, t,= 2.1 Hz, H-24), 6.27 (1H, dd,= 2.5, 1.5 Hz, H-4), 6.26 (1H, dd,= 2.5, 1.5 Hz, H-22), 5.58 (1H, m, H-17), 5.50 (1H, m, H-31), 5.11 (1H, m, H-27), 5.02 (1H, m, H-9), 4.21 (1H, m, H-13), 4.16 (1H, d,= 4.8 Hz, H-14α), 4.04 (1H, dd,= 10.8, 5.3 Hz, H-14β), 3.57 (1H, dd,=13.3, 7.0 Hz, H-8α), 3.40 (1H, dd,= 13.7, 6.4 Hz, H-26α), 3.08 (1H, d,= 7.7 Hz, H-26β), 2.96 (1H, m, H-16α), 2.92 (1H, m, H-30α), 2.86 (1H, m, H-8β), 2.78 (2H, m, H-16β, 30β), 2.54 (1H, dd,= 15.4, 5.4 Hz, H-12α), 2.45 (1H, dd,= 15.4, 7.4 Hz, H-12β), 1.46 (3H, d,= 6.3 Hz, H-18), 1.43 (3H, d,= 6.3 Hz, H-32), 1.22 (3H, d,= 6.2 Hz, H-28), 1.17 (3H, d,= 6.2 Hz, H-10);13C-NMR (125 MHz, Acetone-6): 171.0 (C-1), 171.0 (C-19), 170.7 (C-15), 170.4 (C-29), 170.2 (C-11), 165.6 (C-23), 165.0 (C-5), 163.0 (C-3), 162.8 (C-21), 143.0 (C-7), 143.0 (C-25), 112.4 (C-6), 111.9 (C-24), 105.9 (C-2), 105.4 (C-20), 102.2 (C-22), 102.1 (C-4), 72.5 (C-27), 72.3 (C-9), 69.8 (C-17), 69.6 (C-31), 67.9 (C-14), 66.3 (C-13), 41.3 (C-8), 41.0 (C-26), 40.6 (C-30), 40.3 (C-16), 39.6 (C-12), 19.7 (C-18), 19.7 (C-10), 19.5 (C-32), 19.3 (C-28)。上述数据与文献报道一致[16],推测该化合物为BK223-B。
3.2 活性测试结果
分别对化合物1~7进行抗菌活性、抗神经炎活性、细胞毒活性筛选。其中抗菌活性试验发现化合物5具有明显抑制MRSA的活性,MIC值为31.25 μg/mL,阳性对照美罗培南的为0.5 μg/mL。以NO为指标进一步测定了化合物1~7的抗炎活性,发现在20 μmol/L的浓度下,化合物3和5可以抑制由LPS诱导的BV2小胶质细胞中NO的产生,抑制率分别为(69.90±1.34)%和(54.50±4.15)%;阳性对照槲皮素的为(85.30±0.89)%。然而与化合物3相比,化合物1没有表现出抗神经炎活性,提示赤散囊菌素C中C-4处的甲氧基的存在可能降低了抗炎活性。此外,评估了化合物1~7对2种胰腺癌细胞系PANC-1和BxPC的细胞毒活性,发现化合物5和7具有一定的细胞毒性。在50 μmol/L浓度下,化合物5对PANC-1和BxPC细胞增殖的抑制率分别为(85.0±2.9)%和(74.20±6.11)%;化合物7对PANC-1细胞株的增殖抑制率为(77.90±5.34)%,稍弱于阳性药阿霉素 [PANC-1为(99.20±1.56)%,BxPC为(97.60±3.97)%]。
4 讨论
植物内生菌种类丰富且广泛分布在植物组织中,内生菌在与宿主协同进化的过程中具备了产生结构多样性的次生代谢产物的能力,这些次生代谢产物被发现具有抑菌、抗肿瘤和神经细胞保护等多种生物活性,在医药应用和人类健康问题上展示出巨大的潜力和用途,也因此备受关注。目前,关于黄芦木内生菌的次生代谢产物报道仍较少,有进一步研究的必要性。鉴于此,本研究以内生菌SN34大米发酵物为研究对象,分离得到1个新的苯并呋喃衍生物(1)及6个已知化合物(2~7),并测定了它们的抗菌、抗神经炎和细胞毒活性。植物内生菌通过产生具有抗菌活性的物质从而抑制植物病原菌生长,是植物抗病原菌的重要机制,从植物内生菌次生代谢产物中发现具有抗菌活性的某些化合物,具有开发成为抗菌药物的可能性。MRSA是一种具有广谱耐药性的耐药菌,是引起社区健康人群和医疗服务机构患者感染的重要原因,不仅对甲氧西林耐药,对其他与甲氧西林具有相同母核的β-内酰胺类和头孢类抗生素均耐药,对氨基糖苷类、大环内酯类、磺胺类、利福平均产生不同程度的耐药,本研究分离筛选出的化合物5对MRSA有抑制作用,为后期进行其抗菌机制提供理论依据,为进一步开发抗耐药菌先导化合物提供了模板分子。通常,在中枢神经损伤、感染、毒素刺激下或自身免疫的作用下会出现神经炎症。LPS是革兰阴性细菌细胞壁的主要成分,通过与膜受体Toll样受体4(Toll-like receptor 4,TLR 4)相互作用来触发一系列小胶质细胞反应,从而导致促炎性介质的产生,长期激活的小胶质细胞会在中枢神经系统中引起过度的炎症反应,从而导致并发症,如认知功能障碍、抑郁症行为等,化合物3和5可以抑制由LPS诱导的BV2小胶质细胞NO的产生,具有良好的抗神经炎性活性,为相关药物的研究提供了先导化合物和理论依据。胰腺癌是消化系统常见恶性肿瘤之一,由于临床症状隐匿且不典型,对放射治疗不敏感,诊断和治疗都具有很高的挑战性,据统计其五年生存率不足10%,化合物5和7对胰腺癌细胞PANC-1和BxPC细胞株增殖有一定的细胞毒活性,为抗癌药物研发提供了备选的先导化合物,具有开发成为抗胰腺癌治疗药物的潜力。综上所述,体外活性筛选中发现化合物5具有一定的抑制MRSA生长,BV2细胞NO的产生及胰腺癌细胞株PANC-1和BxPC增殖的作用,提示化合物5可能是潜在的具有良好活性的药源分子,后期可对其活性作用机制进行深入研究,以期为新药研发提供坚实基础。
利益冲突 所有作者均声明不存在利益冲突
[1]Liu X, Zhou Z Y, Cui J L,. Biotransformation ability of endophytic fungi: From species evolution to industrial applications [J]., 2021, 105(19): 7095-7113.
[2]Bastías D A, Balestrini R, Pollmann S,. Environmental interference of plant-microbe interactions [J]., 2022, 45(12): 3387-3398.
[3]Gómez O C, Luiz J H H. Endophytic fungi isolated from medicinal plants: Future prospects of bioactive natural products from/endophytes [J]., 2018, 102(21): 9105-9119.
[4]Tiwari P, Bae. Endophytic fungi: Key insights, emerging prospects, and challenges in natural product drug discovery [J]., 2022, 10(2): 360.
[5]Ben S H, Chenari B A, Alenezi F N,. Potentials of endophytic fungi in the biosynthesis of versatile secondary metabolites and enzymes [J]., 2021, 12(12): 1784.
[6]Radziejewska-Kubzdela E, Szwengiel A, Ratajkiewicz H,. Effect of ultrasound, heating and enzymatic pre-treatment on bioactive compounds in juice fromRupr [J]., 2020, 63: 104971.
[7]Nicoletti R, Andolfi A, Salvatore M M. Endophytic fungi of the genusand plant health [A]//[M]. Amsterdam: Elsevier, 2023: 183-213.
[8]Nigussie D, Davey G, Legesse B A,. Antibacterial activity of methanol extracts of the leaves of three medicinal plants against selected bacteria isolated from wounds of lymphoedema patients [J]., 2021, 21(1): 2.
[9]Grottelli S, Amoroso R, Macchioni L,. Acetamidine-based iNOS inhibitors as molecular tools to counteract inflammation in BV2 microglial cells [J]., 2020, 25(11): 2646.
[10]Ren W J, Bao M Y, Zhang J,. Phelliribsin B: A new styrylpyrone derivative from the medicinal fungus[J]., 2022, 19(11): e202200682.
[11]Liu Z M, Xia G P, Chen S H,. Eurothiocin A and B, sulfur-containing benzofurans from a soft coral-derived fungusrubrum SH-823 [J]., 2014, 12(6): 3669-3680.
[12]Zhang G Y, Pan X, Yang B B,. The asymmetric total synthesis of (-)-eurothiocin A and its enantiomer [J]., 2022, 85(4): 997-1005.
[13]Li G H, Yu Z F, Li X,. Nematicidal metabolites produced by the endophytic fungussp. AL4 [J]., 2007, 4(7): 1520-1524.
[14]温露, 杜敦帅, 刘凡, 等. 红树林共生真菌sp. tree 1-7代谢产物的研究 [J]. 中山大学学报: 自然科学版, 2007, 46(3): 125-127.
[15]王军, 马文哲, 汪夕芳, 等. 来自海南红树林内生真菌ZSU-H85 (L.K) 的新蒽醌 [J]. 中山大学学报: 自然科学版, 2010, 49(4): 150-152.
[16]Breinholt J, Jensen G W, Nielsen R I,. Antifungal macrocyclic polylactones from[J]., 1993, 46(7): 1101-1108.
Secondary metabolites of endophytiesSN34 from
GU Jing-zhou1, 4, REN Wen-jing2, 3, BAO Meng-yu2, 3, LI Xiang4, CHEN Zhi-wu1, JIANG Rong2
1. School of Basic Medical Sciences, Anhui Medical University, Hefei 230022, China 2. State Key Laboratory of Quality Research in Chinese Medicine, Macau University of Science and Technology, Macau 999078, China 3. School of Pharmacy, Shandong University of Traditional Chinese Medicine, Jinan 250355, China 4. First Affiliated Hospital of Anhui Medical University, Hefei 230022, China
To study the secondary metabolites and biological activities of the endophytiesSN34 derived from the leaves of..The secondary metabolites ofSN34 were isolated and purified by normal-phase silica gel, Sephadex LH-20 gel, ODS column chromatography and reversed-phase high performance liquid column chromatography. The structures of isolated compounds were identified by HRESIMS and NMR. The antibacterial, antineuritis and cytotoxic activities of the compounds were evaluated byexperiments.A total of seven compounds were isolated from the rice fermentation ofSN34 and identified as-methyl ()-2-(2-hydroxypropan-2-yl)-4-methoxy-6-methyl-2,3-dihydrobenzofuran-5-carbothioate (1), methyl()-4-hydroxy-2-(2-hydroxypropan-2-yl)-6-methyl-2,3- dihydrobenzofuran-5-carboxylate (2), eurothiocin A (3), 2,3-dihydro-2-(1-methylethenyl)-5-benzofuranmethanol (4), alaternin (5), 1,3,6-trihydroxy-7-(1-hydroxyethyl)-9,10-anthracenedione (6), and BK223-B (7). Among them, compound 5 exhibited inhibition of methicillin-resistant(MRSA) bacterial strain, with a minimal inhibitory concentration (MIC) value of 31.25 μg/mL. At a concentration of 20 μmol/L, the inhibitory rates of compounds 3 and 5 on the production of nitric oxide (NO) in lipopolysaccharides (LPS)-induced mouse microglial cell line BV2 cells were (69.90±1.34)% and (54.50±4.15)%, respectively. In addition, compounds 5 and 7 could inhibit the proliferation of pancreatic cancer cell lines PANC-1 and BxPC.Compound 1 is a novel sulfur-containing benzofuran derivative, which is named eurothiocin C. Compounds 2—7 are isolated fromSN34 for the first time. Compound 5 has inhibitory effect on MRSA strains. Compounds 3 and 5 could inhibit NO production in the LPS-induced BV2 cells, suggesting that above compounds have antineuritis activity. In addition, compounds 5 and 7 exhibited inhibitory effects on the proliferation of PANC-1 and BxPC cells.
Rupr.; endophyties;SN34;bioactivities; eurothiocin C; eurothiocin A; alaternin
R284.1
A
0253 - 2670(2023)21 - 6946 - 07
10.7501/j.issn.0253-2670.2023.21.003
2023-07-10
国家自然科学基金资助项目(81973510)
谷荆洲,男,硕士研究生在读,研究方向为天然药物化学。E-mail: gujingzhou2022@163.com
通信作者:陈志武,男,教授,博士生导师,研究方向为心脑血管药理学和神经药理学。
姜 荣,女,博士,研究方向为天然药物化学成分与活性研究。E-mail: jrong8727@163.com
[责任编辑 王文倩]
