健脾合剂对腹泻型肠易激综合症大鼠结肠miRNA表达谱的影响*
2023-11-07王萌吴婷婷丁姮月梁国强杨欣张培培孙宏文
王萌,吴婷婷,丁姮月,梁国强,3,杨欣,张培培,孙宏文**
(1.南京中医药大学附属苏州市中医医院 苏州 215009;2.苏州科技城医院 苏州 215153;3.苏州市吴门医派研究院 苏州 215009)
肠易激综合征(Irritable bowel syndrome,IBS)是一种与心理、社会、环境因素有密切关系的躯体疾病[1]。我国IBS患病率为1.4%-11.5%并有增高趋势,其症状主要表现为反复发作性的腹痛、腹胀或腹部不适,与排便相关或伴随排便习惯改变[2]。IBS虽预后尚可,但其病程迁延不愈,常伴有焦虑、抑郁、神经质等心理异常情况,严重影响患者的生活质量。目前治疗IBS的药物种类很多,包括解痉剂、止泻剂、肠道不吸收的抗生素、益生菌、神经递质药物等,但疗效并不理想[3]。因此,探讨IBS的发病机制,寻找有效的干预方法,具有重要的临床意义。
中医药在IBS的治疗中越来越受到重视。根据IBS的临床表现将其归属于中医学“泄泻”、“便秘”、“腹痛”等病范畴[4]。全国著名脾胃病专家黄一峰先生在长期临床工作中总结经验,在四君子汤基础上加用陈皮、山药等药物组成健脾合剂,该方临床应用近30年,疗效确切。前期临床研究发现健脾合剂可以改善IBS-D患者腹痛、腹胀、腹泻等症状,缓解倦怠乏力、神疲懒言等脾虚表现,提高有益菌布劳特士菌属(Blautia)、罗斯氏菌属(Roseburia)、粪球菌(Coprococcus)、瘤胃球菌属(Ruminococcus)水平[5]。
中医药是系统性强、整体性强的多靶点协同作用,健脾合剂治疗IBS-D也是多方面、多角度的。因此,本研究拟借助转录组学基因测序技术(RNAsequencing,RNA-seq),分析出细胞中所有基因的表达量及差异情况,探索健脾合剂治疗IBS-D的转录组学特征,寻找其治疗靶点,为后续研究健脾合剂治疗IBS-D的作用机制奠定基础。
1 材料
1.1 动物
SPF级SD雄性大鼠28只,体质量(200±20)g,由苏州希诺赛生物科技有限公司提供,许可证号:2021伦动批070,饲养于苏州市中医医院研究所动物实验室,12 h光照/黑暗循环,室温控制在20-24℃,相对湿度45%-70%,分笼、自由饮用水饲养。
1.2 药物、试剂
健脾合剂:药物组成:党参5 g、炒白术5 g、茯苓5 g、炙甘草3 g、炒陈皮5 g、炒山药5 g,所有饮片由苏州市春晖堂药业有限公司提供,符合2020年《中国药典》规范,批号分别为200117,200410,200617,200108,211021015,210827015;番泻叶(苏州市春晖堂药业有限公司,批号:170909);戊巴比妥钠(美国sigma公司,批号:20089104);TRIzol试剂(美国Invitrogen公司,批号1596026);无水乙醇(国药集团,批号:100092680);多聚甲醛组织固定液(北京兰杰柯科技有限公司,批号:70081800)。
1.3 仪器
NanoDrop-2000分光光度计(美国赛默飞世尔科技)、Agilent 2100生物分析仪(美国Agilent公司)、Illumina Novaseq 6000基因DNA测序仪(美国Illumina公司)、mini protean 3 cell电泳仪(Bio-Rad公司);Sorvall ST 40型离心机(美国赛默飞公司)、JB-P5型石蜡包埋机(武汉俊杰电子有限公司)、RM2016型石蜡切片机(上海徕卡仪器有限公司)。
2 方法
2.1 健脾合剂的制备
取健脾合剂一剂共28 g生药,将药物浸泡30 min,按常规中草药煎煮方法,煎煮提取2次,过滤后合并提取液,置于旋转蒸发仪(真空压力、温度80℃)中浓缩得1 g·mL-1的中药原液,冷却分装后置于4℃冰箱保存。健脾合剂所选浓度为前期研究筛选出的疗效较好浓度,按人与大鼠体表面积计算得出给药剂量为7.56 g·kg-1。
2.2 造模、分组及处理
28只大鼠标准普通饲料喂养3天适应实验环境,随机选取10只大鼠作为空白组。其余18只大鼠使用急-慢应激法联合番泻叶灌胃法建立IBS-D模型。急-慢应激法[6]:包括以下刺激:12 h夜间持续照明,5 min闷热环境(45℃);24 h禁水,3 min寒冷环境(4℃);1 min夹尾;40 min水平震动(120次·min-1);24 h禁食。每周按随机顺序给予大鼠上述刺激,每连续2天不能重复相同的刺激顺序,以免大鼠提前预知,连续刺激3周后休息1周,并在第4周最后1天,给予纸带束缚大鼠1 h。从第23天开始进行番泻叶灌胃(取番泻叶饮片2000 g,浸泡30 min后用蒸馏水煎煮提取2次,过滤后合并提取液,置于旋转蒸发仪中浓缩得1 g·mL-1的中药原液,冷却分装后置于4℃冰箱,灌胃时水浴法加热药液至25℃,以10 mL·kg-1灌胃给予18只大鼠),每天2次,连续5天,制定IBS-D模型。造模第28天随机选取正常对照组2只和模型组2只大鼠,处死后采集结肠黏膜,并对黏膜进行HE染色,观察结肠组织表面层是否完整、有无溃疡、杯状细胞形态及数量变化、水肿及炎性细胞浸润等情况,判断造模是否成功。造模成功后,将大鼠随机分为空白组、模型组及中药组,每组8只。空白组和模型组按10 mL·kg-1生理盐水灌胃,中药组以健脾合剂(10 mL·kg-1)灌胃。造模成功当天开始给药,以蒸馏水稀释健脾合剂,加热至25℃进行灌胃,每日给药1次,持续给药14天。每日观察大鼠的一般情况,包括活动、饮食、毛色以及粪便情况,给药第1天和第14天分别记录大鼠的体重,收集大鼠粪便进行Bristol粪便积分,并依据大便性状记为1-7分[7]。
2.3 HE染色
各组末次给药后,禁食不禁水24 h,称重后按50 mg·kg-1注射戊巴比妥钠麻醉后断颈法处死大鼠,迅速剖腹,肛缘处向上取4-8 cm结肠组织,并沿肠系膜纵轴切开,用蒸馏水冲洗干净,4%多聚甲醛固定结肠组织,乙醇逐步脱水,石蜡包埋切片后,60℃烘箱过夜烤片,HE染色后在光学显微镜下对结肠组织进行观察。
2.4 RNA提取和RNA定量
取大鼠结肠组织,使用TRIzol试剂提取总RNA,并使用脱氧核糖核酸酶I(Deoxyribonuclease I,DNase I,TaKaRa公司)去除基因组DNA。在1%琼脂糖凝胶上监测RNA降解和污染。使用NanoDrop-2000分光光度计测量RNA浓度。最后,使用Agilent 2100 生物分析仪评估RNA完整性。仅使用高质量的RNA样本(OD260/280=1.8-2.2,OD260/230≥2.0,RI N≥728 S:18 S≥1.0,>3 µg)构建测序文库。
2.5 miRNA测序数据统计及比对分析
从总RNA中电泳切胶得到small RNA,分别连接5’接头和3’接头,用接头引物进行反转录·聚合酶链反应(Reverse transcription-polymerase chain reaction,RT-PCR),构建小RNA文库。用Illumina Novaseq 6000基因DNA测序仪进行测序,测序部分交由上海美吉公司完成;对原始测序数据进行测序相关质量评估;将质控后的数据,即clean data(reads)与参考基因组进行比对,参考基因来源:Rattus_norvegicus,参考基因组版本:Rnor_6.0,参考基因组来源:http://asia.ensembl.org/Rattus_norvegicus/Info/Index,比对到的reads数从9952451到17785312不等。
2.6 表达量及表达差异分析
使用miRDeep软件统计miRNA表达量,基于表达定量结果,使用DESeq2软件进行组间差异基因分析,获得发生差异表达的基因,筛选阈值为:差异倍数fold change(|log2FC|)>1且显著性水平P(Padjust)≤0.05。
2.7 miRNA靶基因分析
采用软件Goatools对靶基因集中的基因进行GO富集分析,从而获得该基因集中的基因主要具有哪些GO功能。使用方法为Fisher精确检验,当P<0.05时,认为此GO功能存在显著富集情况。采用R脚本对靶基因集中的基因进行KEGG通路富集分析,当P<0.05时,认为此KEGG通路功能存在显著富集情况,按富集程度筛选排名前20的目标。
3 结果
3.1 大鼠一般情况
造模前,所有大鼠精神良好,活泼好动,毛色光亮,饮食正常,大便干稀适中;造模开始后,模型大鼠逐渐出现精神萎靡,活动减少,毛色枯燥,饮食减少,大便稀溏,甚至呈水样,伴见体重下降,初步提示造模成功;给药后,中药组大鼠体重逐渐上升,精神、活动好转,毛色恢复光亮,大便转干。如图1表示,给药第1天,模型组与中药组大鼠体重明显低于空白组(P<0.01);给药第14天,中药组体重较模型组明显增加(P<0.01)。
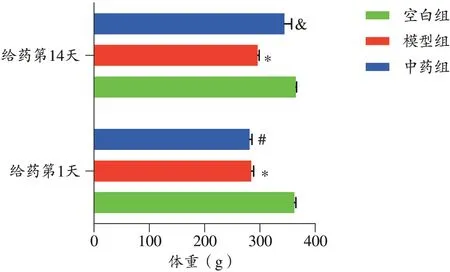
图1 各组大鼠体重比较(n=8)
3.2 大鼠粪便Bristol评分
造模后,模型大鼠粪便Bristol评分显著上升(P<0.01);给药14天后,模型组粪便积分仍较高,粪质稀薄呈水样,中药组较之明显好转,Bristol评分显著下降(P<0.01),具体见图2。

图2 各组大鼠粪便Bristol评分比较(n=8)
3.3 病理结果
大鼠结肠HE染色结果显示,空白组大鼠黏膜上皮完整,固有层腺体排列整齐规则,间质无明显淋巴细胞浸润;模型组见黏膜上皮轻度破损及水肿,上皮细胞排列不整,周围少许炎性细胞浸润;中药组与模型组相比较,上皮破损及水肿减轻,上述情况得到有效改善,见图3。

图3 大鼠结肠组织病理组织学观察(HE染色,×100,×200)
3.4 miRNA差异表达基因筛选
RNA-seq测序结果表明(图4A-4C),空白组与模型组相比,差异表达的miRNA共109个,其中80个上调,29个下调;模型组与中药组相比,差异表达的miRNA共109个,其中19个上调,90个下调。通过韦恩图将两次比较结果进行比对,共有81个miRNA相同,见图4D;在模型组与空白组比较中下调、中药组与模型组比较中上调的有7个;在模型组与空白组比较中上调、中药组与模型组比较中下调的有74个,具体见表1。

表1 大鼠结肠组织显著差异表达miRNA

续表

图4 组间有统计学差异的miRNA
3.5 差异miRNA靶基因GO功能富集分析
对受健脾合剂调控差异表达miRNA的靶基因进行GO功能富集分析,结果显示,差异表达的miRNA靶基因所涉及的功能及过程主要集中在囊泡定位、髓鞘形成、突触囊泡转运、细胞器膜融合、发育性生长负调控等生理过程。具体见图5、图6。

图5 GO富集分析(空白组VS模型组)
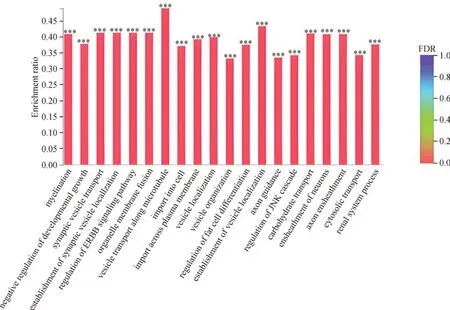
图6 GO富集分析(模型组VS中药组)
3.6 差异miRNA靶基因KEGG富集分析
对受健脾合剂调控差异表达miRNA的靶基因进行KEGG通路富集分析,结果显示,差异表达的基因主要富集在MAPK、Hippo、Wnt、Toll-like receptor等信号通路,见图7、图8。

图7 KEGG富集分析(空白组VS模型组)

图8 KEGG富集分析(模型组VS中药组)
4 讨论
肠易激综合症的发病机制复杂多样,目前尚无定论,一般认为,内脏高敏和胃肠动力异常是其基本的病理生理特点[8]。本实验采用急-慢应激法联合番泻叶灌胃的复合造模方法构建大鼠IBS-D模型。急-慢应激法通过给予大鼠随机反复多因素刺激,从脑-肠-轴角度改变大鼠内脏敏感性[6];番泻叶短期灌胃可以造成大鼠功能性腹泻状态[9]。在本实验中,前期急-慢应急法刺激下的模型大鼠逐渐活动减少、情绪激动易激惹、毛发枯燥无光泽、大便稀烂、体重下降,加用番泻叶灌胃后,体重进一步下降,Bristol粪便积分显著上升,解剖取大鼠结肠组织进行观察,发现结肠组织未见出血糜烂、水肿溃疡等明显器质性病变,HE染色见有少量炎性细胞浸润,基本符合腹泻型肠易激的临床症状和镜下特征,证明该造模方法可以成功模拟IBSD患者的基本特征,且持久稳定、可重复性好,值得推广应用。
中医根据IBS-D腹痛腹泻的基本特征,一般将其归属于“泄泻”范畴,并认为脾虚湿盛贯穿于IBS-D全过程,是其发病的总病机[4]。感受外邪、饮食不节、劳倦体虚、七情内伤等各种病因导致脾胃虚弱,运化功能失常,脾失健运,湿浊阻于大肠而发为泄泻,故治疗上以健脾化湿为主。健脾合剂包括党参、白术、茯苓、甘草、山药和陈皮六味药。方中党参补脾养胃,健运中气。现代药理研究发现党参可以抑制胃肠道平滑肌痉挛,通过增加前列腺素含量保护消化道黏膜[10]。白术益气健脾,燥湿利水。白术多糖可以调节脾虚型大鼠肠道菌群失衡,白术内脂可以有效降低促炎因子肿瘤坏死因子α、白介素1β、白介素6水平,发挥抗炎作用[11]。茯苓渗湿利水,健脾宁心。研究表明茯苓通过抑制肠粘膜内皮细胞一氧化碳、内皮素-1及血栓素A2的分泌,改善肠道微循环,修复肠粘膜屏障[12]。炙甘草益气和中,调和阴阳。甘草苷有明显的抗抑郁、抗炎作用[13]。山药补脾养胃生津,山药多糖可以抑制小鼠胃和小肠排空功能[14]。陈皮理气健脾,燥湿化痰,具有双向调节胃肠道平滑肌的作用[15]。综上所述,健脾合剂具有益气健脾,渗湿止泻功效,是治疗IBS-D的良方。
转录组测序的研究对象为特定细胞在某一功能状态下所能转录出来的所有RNA的总和,其中主要包括miRNA等。miRNA是一类长度约为20-24个核苷酸的小RNA,其在细胞内的调节具有多样性,广泛参与机体各项生理病理过程及信号通路的激活与抑制。本实验对空白组、模型组、中药组大鼠结肠组织进行转录组学分析,在空白组与模型组、模型组与中药组各组间差异表达的miRNA共有109个,两组比较结果互相比对则发现其中有81个miRNA是相同的,包括miRNA-665、miRNA-132-5p、miRNA-132-3p、miRNA-21-3p、miR-146a-5p等。miRNA-665在模型组中上调,在中药组中则表现为下调,而研究发现miRNA-665参与结肠细胞的凋亡[16],说明健脾合剂可以通过抑制miRNA-665的表达,减少细胞凋亡,保持肠粘膜完整性;Kim等[17]研究发现miRNA-132通过负调节FOXO3a促进炎症细胞因子的表达,本实验中,miRNA-132-5p、miRNA-132-3p在模型组显著上调,在中药组显著下调,说明健脾合剂通过抑制miRNA-132-5p、miRNA-132-3p的表达发挥抗炎作用;同时,本实验中miRNA-21-3p也在中药组中呈现低表达,该miRNA也与肠道炎症反应密切相关[18];与之相反的则是miRNA-146a-5p,其在模型组中显著下调,在中药组中显著上调,miR-146可以改善肠上皮屏障功能[19],提示健脾合剂通过促进miRNA-146a-5p的表达从而发挥修复肠粘膜屏障功能的作用。
差异表达miRNA的靶基因GO功能富集和KEGG通路富集分析结果显示,健脾合剂参与多种生物过程包括生物调节、细胞代谢,参与多种分子功能及细胞组分,更参与了机体多条生命活动的重要通路,包括MAPK、Wnt、Hippo等信号通路。MAPK信号通路参与细胞增殖与分化、免疫反应等一系列生理、病理过程,它能从增加内脏高敏性、激活异常免疫调控等方面导致IBS-D的发病[20-21]。Hippo信号通路参与细胞再生与肠粘膜修复过程,并在维持肠上皮细胞间连接方面也有积极影响[22]。Wnt信号通路参与调控肠隐窝干细胞的分化过程,其在维持肠道干细胞稳态和修复损伤方面有重要作用[23-24]。在本实验中,miRNA-337-5p、miRNA-495、miRNA-126b、miRNA-299b-5p、miRNA-299a-5p等在模型组显著上调,在中药组显著下调,而这些miRNA与MAPK相关通路的激活有关[25-27];miRNA-31a-5p在模型组显著下调,在中药组则表现为上调,此基因可以激活Hippo、Wnt信号通路[28]。由此可见,健脾合剂可以通过抑制MAPK信号通路的活性,上调Hippo、Wnt信号通路的表达,降低内脏敏感性,维持肠道干细胞稳态,修复肠粘膜屏障,最终达到治疗IBS-D的效果。
综上所述,健脾合剂能够调节相关miRNA的表达,通过调控MAPK、Hippo、Wnt等信号通路发挥干预腹泻型肠易激综合症的作用。但其对上述基因、信号通路的影响仍需应用实时荧光定量聚合酶链反应(qRT-PCR)等方法进行下一步研究与验证。本研究从转录因子的角度为健脾合剂治疗腹泻型肠易激综合症的作用机制提供了线索与思路,为健脾合剂的下一步基础研究与临床应用提供了理论指导。
