电针激活CB2受体增强细胞自噬功能缓解炎性痛的机制*
2023-11-07武彩花高芳向宏春蓝渝叶万科幸高珊杨金梅李熳毛红蓉
武彩花,高芳,向宏春,蓝渝叶,万科幸,高珊,杨金梅,李熳,毛红蓉**
(1.武汉市第一医院 武汉 430030;2.华中科技大学同济医学院 武汉 430030)
炎性痛通常由组织损伤与炎症一起发生,广泛存在于各种急、慢性疾病的进程中,当炎症反应继续存在,这种疼痛就会持续存在[1-2],严重影响患者生活质量。研究表明,细胞自噬与炎症反应之间存在着密切联系[3],自噬能通过清除受损的线粒体,进而抑制炎症小体的激活以及白介素-1β(Interleukin-1 β,IL-1β)的分泌[4]。自噬是一种胞内膜转运系统[5],控制着物质向溶酶体转运,使有缺陷的细胞器、错误折叠的蛋白质等物质降解[6],以维持细胞稳态[7]。已有研究表明,电针治疗炎性痛疾病具有消炎、镇痛的作用[8-10],前期工作表明,电针能通过上调外周内源性大麻素含量,激活CB2受体,进而显著下调大鼠炎症皮肤组织中IL-β等致炎细胞因子的表达,从而发挥消炎、镇痛作用[11-13]。而电针能否通过激活炎性痛病灶皮肤组织中的CB2受体,增强其炎症皮肤组织细胞自噬功能,促进受损线粒体的清除,从而发挥镇痛作用,目前尚不清楚。本研究首先观察电针对野生型小鼠和CB2受体基因敲除小鼠CFA诱导炎性痛的缓解作用和炎症皮肤组织细胞自噬功能的影响,激活CB2受体模拟电针作用,观察其对NR8383巨噬细胞自噬功能以及线粒体受损情况的影响,探讨电针能否通过激活CB2受体增强炎症皮肤组织细胞自噬功能以及促进受损线粒体的清除从而缓解炎性痛。
1 材料与方法
1.1 实验动物
CB2受体基因敲除小鼠购于Jackson实验室(货号005786)。小鼠饲养于华中科技大学同济医学院实验动物中心SPF级动物房,4周龄时打耳标并剪尾,提取尾组织DNA,采用PCR进行基因型的鉴定,鉴定方法依据Buckley等[14]的文献报道。引物序列见表1。

表1 基因引物序列
PCR反应温度体系为:95℃反应1 min;60℃反应1 min,72℃反应2 min,共30个循环;72℃延伸10 min。
实验采用健康野生型(Wild type,WT)为CB2基因敲除小鼠同窝,鉴定方法同上,为阴性,以下简称野生型小鼠。
1.2 动物模型
动物模型实验中的所有动物操作及方案均经过华中科技大学同济医学院动物伦理委员会批准。实验小鼠饲养条件:环境洁净,室内温度22±2℃、12 h白昼/12 h黑夜自动交替的动物房,饮食自由。在实验前驯养适应1周,野生型小鼠和CB2受体基因敲除小鼠均随机分为:溶媒对照组(control组)、CFA模型组(CFA模型组)、电针组(CFA+EA组)和假电针组(CFA+ sham EA组),每组8只。其中CFA模型组、电针组和假电针组在小鼠左后肢足背皮下注射50 µL CFA诱导炎性痛模型,溶媒对照组在同部位注射50 µL石蜡油;电针组小鼠在造模后第2、4、6天,采用LH202H型韩氏穴位电针仪针刺小鼠的左侧胆经“环跳穴”(GB30)和“阳陵泉穴”(GB34),电针参数为:电流强度1 mA,频率2 Hz,刺激30 min;假电针组仅将毫针刺入相同穴位,不通电,留针30 min。
1.3 痛行为学检测
采用热板测痛法测定小鼠热痛阈值。在室温为25-27℃的安静环境中,设置热板温度为55℃,将小鼠放入热板上,同时开始计时,小鼠出现缩腿或舔爪信号时停止计时,并及时取出小鼠避免烫伤,每只小鼠测3次后取平均值,每次间隔5 min。
采用von Frey丝(Stoelting, Wood Dale, IL),以“up and down”方法[15]测定小鼠机械痛阈。在室温25-27℃的安静环境中,采用双盲实验方法,将小鼠置于底为5 mm × 5 mm的金属丝网眼垫的透明有机玻璃箱中,适应20-30 min,等其安静后测定机械痛阈。将校准的von Frey丝垂直地作用于小鼠左后肢足底,稍用力,直至其弯曲成S形,每次持续时间最长不超过6 s,小鼠出现快速的缩足反射或舔足反应,则记为阳性反应。每次测试重复2次,计算平均值。造模前所有小鼠连续测定3天基础痛阈,造模后连续测6天。
1.4 细胞培养
采用的NR 8383来源于肺灌洗时的正常大鼠肺泡巨噬细胞,购于武汉普诺赛生命科技有限公司。用含20%胎牛血清(Biological Industries公司,以色列)及1%双抗(Gibco公司,美国)的DMEM高糖培养基(Gibco公司,美国)于37℃、5% CO2细胞培养箱中培养,待细胞融合度至90%以上后进行传代培养。NR 8383为贴壁和悬浮混合状态生长的细胞,其传代方法为直接用移液器吹打细胞,将其从培养瓶底部吹下来,收集细胞悬液至15 mL离心管中,室温800 r·min-1转速离心5 min,弃掉上清,加入新鲜培养基,轻轻吹打重悬细胞,以1∶2的比例将细胞种于新的培养瓶中。
1.5 Western blot检测p62、LC3B蛋白表达
检测各组小鼠p62、LC3B蛋白表达。取制备的皮肤组织及收集的细胞悬液,提取总蛋白,使用加强型BCA试剂盒(碧云天)测定蛋白浓度。取80 µg总蛋白上样,采用SDS聚丙烯酰胺凝胶电泳(80V,恒压2 h)。电泳结束后切取目的条带,将目的条带转至PVDF膜上,200 mA恒流转膜。转膜完毕后,取出PVDF膜,封闭1 h后,4℃孵育一抗(兔抗p62、兔抗LC3B)过夜。加入辣根过氧化物酶标记的羊抗兔IgG二抗(1∶20 000)后室温孵育1 h,在暗室用ECL化学发光显色液显色5 min,压胶片,取出胶片并依次放入显影液、定影液中显影。将胶片洗净晾干后扫描,使用Image J对条带进行灰度分析。Western blot实验所用一抗有兔抗p62(1∶1000),购于Cell Signaling;兔抗LC3B(1:1000),购于Cell Signaling;小鼠抗β-actin(1:4000),购于Santa Cruz;使用的二抗为辣根过氧化物酶标记的羊抗小鼠/羊抗兔IgG(1∶20000),购于Jackson ImmunoResearch。
1.6 流式细胞术
受损线粒体检测:NR8383细胞加药处理完成后,避光操作,加入线粒体染料MitoTracker Green(绿色荧光可染所有的线粒体,100 nmol·L-1)和MitoTracker deep Red(红色荧光,依赖于线粒体的膜电位,只能染有活性的线粒体,100 nmol·L-1)(均购于Life Technology),于37℃孵育30 min;吹打细胞,收集细胞悬液,室温用800 r·min-1转速离心5 min,弃上清;加1 mL PBS 37℃洗涤细胞2次,每次5 min,再离心弃上清;加入300 µL PBS重悬细胞,上流式细胞仪进行分析,使用FlowJo 7.6.2软件分析结果并作图。
线粒体活性氧(Reactive oxygen species,ROS)检测:NR8383细胞加药处理完成后,避光操作,加入线粒体相关ROS染料MitoSOX(MitoSOX™Red,线粒体超氧化物指示剂,Invitrogen公司,Thermo Fisher Scientific Inc)对细胞进行2.5 µmol·L-1染色,于37℃孵育30 min;用PBS溶液洗涤细胞3次,再悬浮在含1%胎牛血清的冷PBS溶液中,上流式细胞仪进行分析。使用FlowJo 7.6.2软件分析结果并作图。
1.7 数据分析
数据均以均数±标准误(means±SEM)表示,采用单因素方差分析和LSD(最小显著差异)和S-N-K方差后分析来检测各组的统计差异,分析均在SPSS(11.5版)程序中进行,P<0.05表示差异具有统计学意义
2 结果
2.1 电针显著改善野生型炎性痛模型小鼠热痛觉过敏和机械痛觉超敏
与溶媒对照组相比,野生型小鼠CFA造模后第1天各组热痛阈、机械痛阈值均较溶媒对照组显著下降(P<0.01,图1A、1C);与CFA模型组相比,给予2 Hz电针治疗后,电针组的热痛阈在第3-6天均显著回升(P<0.05,图1A),电针组的机械痛阈值在第2-6天均显著回升(P<0.05,图1C)。假电针组的热痛阈和机械痛阈较模型组均无显著差异(P>0.05)。说明电针可显著改善炎性痛模型野生型小鼠的热痛觉过敏和机械痛觉超敏。

图1 电针对野生型和CB2受体基因敲除小鼠热痛阈值和机械痛觉阈值的影响(means±SEM,n=8)
与溶媒对照组相比,CB2受体基因敲除小鼠造模后第1天各组热痛阈、机械痛阈值均显著下降(P<0.01,图1B、1D),而给予2 Hz电针治疗后对CB2受体基因敲除炎性痛模型小鼠的热痛阈和机械痛阈均无显著影响(P>0.05,图1B、1D)。以上结果提示,电针通过激活CB2受体缓解CFA诱导的炎性痛。
2.2 电针显著改善野生型炎性痛模型小鼠炎症皮肤组织细胞中自噬功能
在野生型小鼠皮肤组织中,CFA模型组p62蛋白表达较溶媒对照组显著升高,LC3-Ⅱ/Ⅰ比值显著下降(P<0.05,图2A、2B、2D),与CFA模型组比较,电针组p62蛋白水平显著下降,LC3-Ⅱ/Ⅰ比值显著上升(P<0.05,图2A、2B、2D),假电针组无明显变化(P>0.05)。以上结果提示,CFA诱发炎性痛时小鼠皮肤组织中自噬减弱,而给予电针治疗后可促进自噬功能。
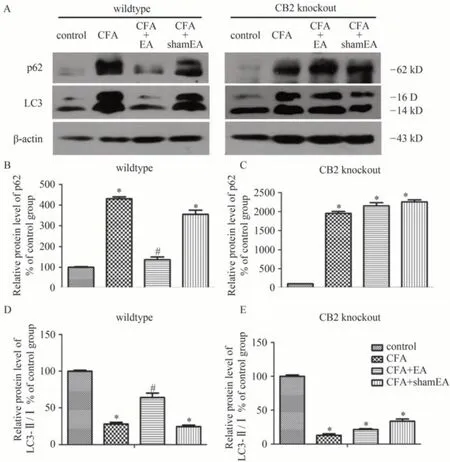
图2 电针对野生型和CB2受体基因敲除小鼠炎症皮肤组织中p62蛋白表达,LC3-Ⅱ/Ⅰ比值的影响(means±SEM,n=8)
在CB2受体基因敲除小鼠皮肤组织中,与溶媒对照组相比,CFA模型组p62蛋白表达显著升高,LC3-Ⅱ/Ⅰ的比值显著下降(P<0.05,图2A、C、E),给予电针或假电针治疗后,p62蛋白表达和LC3-II/I的比值均与CFA 模型组无显著差异(P>0.05)。以上结果表明,电针促进炎症皮肤组织的自噬功能依赖于CB2受体的参与。
2.3 在NR8383巨噬细胞中激活CB2受体可改善CFA引起的自噬功能减弱
与DMSO对照组相比,给予CFA处理后会导致NR8383细胞自噬底物p62蛋白表达显著升高,LC3-Ⅱ/Ⅰ的比值显著降低(P<0.05,图3),提示CFA显著抑制NR8383巨噬细胞的自噬功能;采用CB2受体激动剂AM1241预处理再加入CFA后,NR8383巨噬细胞中p62蛋白表达显著下调,LC3-Ⅱ/Ⅰ比值显著升高(P<0.05,图3),CB2受体拮抗剂AM630可逆转上述作用。以上结果提示:CB2受体激活剂AM1241可显著改善CFA引起的NR8383巨噬细胞自噬功能障碍,该作用是由CB2受体介导的。

图3 CB2受体激动剂AM1241对CFA处理后NR8383巨噬细胞自噬功能的调节作用(means±SEM,n=8)
2.4 在NR8383巨噬细胞中激活CB2受体可减少线粒体受损的数量
采用流式细胞术检测NR8383巨噬细胞中受损的线粒体。如图4A所示,P2区表示膜活性受损的线粒体,只染上绿色荧光。CFA可诱发膜活性受损的线粒体增多(P<0.05,图4B);CB2受体激动剂AM1241预处理后,与CFA模型组相比,受损线粒体的数量显著减少,而CB2受体拮抗剂AM630可逆转此作用。以上结果提示:CB2受体激活剂AM1241可明显减少受损线粒体的数量,该作用是CB2受体介导的。

图4 CB2受体激动剂AM1241对CFA处理后NR8383巨噬细胞中受损线粒体数量的影响(means±SEM,n=8)
3 讨论
炎性痛是由于损伤或者感染的组织释放的炎症介质作用于痛觉神经末梢,增强其兴奋性,导致痛觉过敏的发生[1,16]。足部皮下注射CFA是一种常用的炎性痛模型[17-18],被用来研究炎性疼痛。有研究表明自噬参与了炎症反应的调节作用,如能增强自噬作用,就可以清除体内更多的受损线粒体等细胞器,以实现细胞本身代谢需要和某些细胞器的更新,是机体的一种保护机制[19-20],调节线粒体自噬或许成为一些疾病治疗新的方向。
近来研究表明,自噬与炎性痛之间存在着密切联系[21-22],炎症可以激活或抑制自噬,而自噬可以调节炎症因子的产生和分泌从而调控机体的炎症反应[23-24]。在自噬启动期间,p62与自噬体膜结合,已被广泛用作自噬发生的蛋白质标记物。LC3是一类泛素样蛋白,能促进炎症小体的形成[25-26],也可作为与自噬密切相关的主要标记物。其中P62通过LC3相互作用区结构域参与自噬-溶酶体的形成,LC3包括LC3-Ⅰ与LC3-Ⅱ型,发生自噬时,LC3-Ⅰ脂质化形成LC3-Ⅱ,并定位在胞内自噬体膜上,在自噬过程中被降解[27-28]。因此,LC3-Ⅰ转化为LC3-Ⅱ和p62清除被认为是自噬通量的标志[29-30]。大量的临床研究表明,电针治疗各种疼痛类疾病效果显著,在临床得到广泛的应用[31-33]。外周机制被认为是炎症反应过程中内源性镇痛的重要机制[34-35],阿片肽、内源性大麻素、生长抑素和抗炎细胞因子等是常见的内源性镇痛化合物[35]。本课题组前期研究结果表明,在CFA诱导的炎性痛模型中,电针能通过上调炎症皮肤组织中内源性大麻素的合成[10,13],激活外周CB2受体,显著抑制皮肤组织中细胞因子IL-1β、IL-6和肿瘤坏死因子α(Tumour necrosis factor alpha,TNF-α)的表达[36]。同时,电针通过CB2受体能抑制NLPR3炎症小体的活化和IL-1β成熟片段的产生,从而抑制CFA炎性痛模型中的热痛觉过敏和机械痛觉超敏[11]。有研究表明,CB2激活后通过增强自噬作用发挥抗炎、抑制膀胱炎的作用[37-39]。和此研究相一致,本研究通过CB2受体基因敲除小鼠首次发现,电针能通过激活CB2受体,促进炎症组织细胞中自噬功能,从而缓解炎性痛。
由于电针能促进炎症皮肤组织中内源性大麻素的合成并激活CB2受体,在离体实验中采用CB2受体激动剂AM1241来模拟电针作用,以探讨电针激活CB2受体促进自噬后缓解炎性痛的机制。结果 表明,AM1241激活CB2受体后可显著促进NR8383巨噬细胞的自噬功能,改善CFA引起的细胞自噬功能减弱。同时,通过检测受损线粒体数量,发现CFA可增加膜活性受损的线粒体数量,说明CFA减弱细胞自噬功能,不能清除受损的细胞器;而经CB2受体激动剂AM1241预处理后,受损线粒体的数量显著减少,而CB2受体拮抗剂AM630可翻转这一作用。以上结果提示,CB2受体激活后改善自噬功能障碍,从而有效清除受损的线粒体等细胞器。由于受损线粒体可以产生ROS,继而激活NLRP3炎症小体,增加IL-1β成熟片段的分泌[40-41],从而敏化外周伤害性感受器,导致炎性痛[11]。CB2受体激活减少受损线粒体的数量后,可减少炎症小体的活化和IL-1β等炎症因子的分泌,从而缓解炎性痛。
电针疗法是在刺入人体穴位的毫针上通以接近人体生物电的微量电流,利用针和电两种刺激相结合,以防治疾病的一种方法。以往的研究表明,电针通过激活CB2受体增加内源性阿片肽受体等镇痛物质,从而减轻炎性痛[42]。而经皮神经电刺激疗法则是刺激感觉纤维而设计的,将其电极置于特殊点,有关穴位和运动点,另外可置于病灶同节段上,因为电刺激可引起同节段的内啡肽释放而镇痛,跟电针有相似之处。但是电针刺激在针刺后施加,针刺的深浅与得气以及疗效都有关系,因此电针对穴位深层的刺激作用是经皮电刺激达不到的。
综上所述,电针可能通过激活CB2受体,增强炎症皮肤组织细胞的自噬功能,清除受损的线粒体,减少炎症因子的释放,从而缓解炎性痛。
