心痛泰含药血清干预PI3K/Akt/HIF-1α通路抑制兔主动脉平滑肌细胞凋亡的作用机制*
2023-11-07易琼彭清华郭志华彭筱平魏佳明
易琼,彭清华,郭志华,彭筱平,魏佳明
(1.湖南中医药大学第一附属医院 长沙 410007;2.湖南中医药大学 长沙 410208;3.湖南省直中医医院 株洲 412008)
我国持续上升的心血管病发病率造成了沉重的社会经济负担。《中国心血管健康与疾病报告2021》[1]研究发现,中国的心血管病患者超过3亿,患有冠心病的人数约1139万,每年发生心源性猝死的病患约54.4万例。动脉粥样硬化是易损斑块形成的病理基础,冠心病患者发生心源性猝死的主要原因是易损斑块中纤维帽破裂导致出血,因此,纤维帽的稳定性至关重要。平滑肌细胞(Aortic vascular smooth muscle cell,VSMC)是斑块纤维帽的重要成分之一,参与合成细胞外基质来稳定斑块,在氧化应激、缺血缺氧、ox-LDL等刺激下,VSMC可发生凋亡、坏死[2]。易损斑块中存在大量VSMC凋亡和纤维帽中VSMC数量减少[3]。因此,对调控某些关键通路来减轻VSMC凋亡,是稳定易损斑块的重要治疗方向。
心痛泰在“心受气于脾”的理论基础上组方,全方具有化痰祛瘀通络之功,适用于痰瘀互结型冠心病的患者。饮食不节、肝郁气滞等因素导致脾气虚弱,脾虚生痰,痰凝脉道,久而成瘀,痰瘀互结则形成病理产物——“斑块”。课题组的前期研究显示,心痛泰可减轻炎症反应、改善血管重构、减少斑块纤维帽中的胶原分解,从而稳定动脉斑块,初步阐释了心痛泰干预斑块VSMC的潜在作用[4-7]。VSMC是斑块纤维帽的主要成分,因此,在前期基础上,进一步探索心痛泰对斑块纤维帽中VSMC的具体作用机制。
网络药理学是采用网络拓扑结构分析来解释药物、靶标、信号通路、疾病之间的关联性的一种方法,为中药复方的有效成分、药理机制、作用靶点提供精准的研究思路[8]。课题组通过生物信息学方法,预测心痛泰作用靶点PI3K/Akt/HIF-1α信号通路,构建信息网络分析靶蛋白及其功能,采用TCMSP、TCMID、TCMIP等多个数据库及文献报道,分析了心痛泰对动脉斑块中平滑肌细胞凋亡的潜在作用机制,再通过细胞实验验证心痛泰含药血清对兔VSMC凋亡的效果,人兔基因同源,本研究采用ox-LDL诱导兔VSMC凋亡,模拟动脉硬化斑块中的平滑肌细胞模型[9]。文献报道,PI3K/Akt/HIF-1α通路的上调参与了脂质核心的增大、斑块胶原的缺失、炎症因子的释放等过程,直接影响斑块的稳定性[10-11]。PI3K抑制剂可以减轻动脉粥样硬化的发生和发展[12]。本研究通过CCK8法筛选出干预实验兔主动脉VSMC的最适心痛泰含药血清浓度;构建ox-LDL导致VSMC凋亡的细胞模型,探讨心痛泰含药血清干预VSMC后,PI3K/Akt/HIF-1α通路以及凋亡相关因子的变化,采用TUNEL法和流式细胞术检测VSMC凋亡程度和凋亡率,细胞荧光染色检测VSMC中α-SMA的荧光强度,从而探索心痛泰抑制VSMC凋亡的具体分子机制。
1 材料与方法
1.1 动物与细胞
雄性日本大耳白兔,10-12周龄,体质量(2.19±0.135)kg。由湖南中医药大学实验动物中心提供,合格证号:SCXK(湘)2009-0012,许可证号:湘医动字D20-006号。实验已通过湖南中医药大学实验动物伦理委员会审查(伦理批号:ZYFY20160515)。实验兔主动脉平滑肌细胞购自赛百慷(上海)生物技术股份有限公司(批号:RAB-iCell-c004)。
1.2 药物
心痛泰具体药物组成及来源:丹参(批号HH23032102)、川芎(批号2212120112)、三七(批号20220620)、郁金(批号2022030201)、山楂(批号2212028)、枳壳(批号HY23032302)、葛根(批号GW23032702)、木香(批号220201),购于湖南中医药大学第一附属医院门诊中药方。按丹参∶川芎∶三七∶郁金∶山楂∶枳壳∶葛根∶木香=1.5∶1∶1∶1∶1∶1∶1∶0.5的比例组成,经过标准流程制成药粉,每克药粉相当于15 g生药。由湖南中医药大学第一附属医院药剂科制备,严格控制每一批次的药品质量浓度,符合标准质量浓度的方可用于后续研究。由于本实验探讨心痛泰含药血清对PI3K通路的抑制作用,因此选择PI3K通路抑制剂LY294002(Cell Signaling Technology,批号9901S)作为通路对照。
1.3 仪器与试剂
CO2细胞培养箱(上海博迅实业有限公司,BCJ160S);荧光倒置显微镜(Nikon,DS-Ri2);高速冷冻离心机(Thermo Fisher,Multifuge X1R);流式细胞仪(美国BD公司,FACSCanto11);电热恒温鼓风干燥箱(上海精宏实验设备有限公司,DHG-9123A);CCK-8检测试剂(日本北仁,批号CK04);T25细胞培养瓶(Coming,430639);24孔板专用细胞爬片(Solarbio,YA0350);平滑肌细胞完全培养基(赛百慷上海生物技术股份有限公司,PriMed-iCell-004);人源ox-LDL(上海懋康生物科技有限公司,MP6009-2MG);FITC Annexin V apoptosis detection kit I凋亡试剂盒(美国BD公司,556547);四甲基罗丹明-dUTP(Tetramethyl-Rhodamine-5-UTP,TMR)红色荧光染料(武汉赛维尔生物科技有限公司,G1502-50T);即用型4',6-二脒基-2-苯基吲哚(DAPI)染液(凯基生物,KGA215-50);0.25%胰蛋白酶(Gbico,1734858);山羊血清(Solarbio,S9070);α-SMA(北京博奥森生物技术有限公司,Bsm-33188M);Fluoromount-G荧光封片剂(SourthernBiotech,0100-01);PI3K抗体(北京博奥森生物技术有限公司,批号:bsm-52218R);Akt抗体(北京博奥森生物技术有限公司,批号:bs-3346R);HIF-1α抗体(北京博奥森生物技术有限公司,批号:bs-0737R);caspase-3抗体(abcam公司,批号:32351);caspase-9抗体(北京博奥森生物技术有限公司,批号:bsm-52566R);内参β-actin(北京博奥森生物技术有限公司,批号:bsm-33036m);羊抗兔HRP标记二抗(碧云天生物技术研究所,批号:A0208);羊抗鼠HRP标记二抗(碧云天生物技术研究所,批号:A0216)。
1.4 数据库与软件
中药系统药理学数据库与分析平台TCSMP(http://tcmspw.com/tcmsp.php),中医药综合数据库TCMID(http://www.megabionet.org/tcmid/),中医药整合药理学网络计算研究平台TCMIP(http://www.tcmip.cn/),三维结构显示软件,药物信息综合数据库PubChem(PC)数据库(https://pubchem.ncbi.nlm.nih.gov/),人类基因综合分析数据库GeneCards(GC)(https://www.genecards.org/),生物信息学数据库Bioinformatics Gent(BG)中的Van de Peer Lab在线工具(http://bioinformatics.psb.ugent.be/webtools/Venn/),小分子药物靶点预测在线分析平台SwissTargetPrediction(STP)(http://www.swisstargetprediction.ch/),蛋白相互作用数据库STRING在线分析平台(https://string-db.org/),Cytoscape软件,WebGestalt(WG)数据库(http://www.webgestalt.org/#),Funtional Database(FD)数据库(WG的子数据库),生物信息学数据库DAVID在线分析数据库(https://david.ncifcrf.gov/summary.jsp),蛋白质结构(ProreinData Bank,PDB)数据库(https://www.rcsb.org/)。
1.5 细胞培养、传代及鉴定
复苏实验兔主动脉VSMC,2000 r·min-1离心5 min,去掉上清液,加入胎牛血清和培养基接种于培养瓶中,置于37℃、5% CO2的培养箱中培养,按时更换培养基,细胞融合80%-90%行传代培养,0.05%胰蛋白酶消化传代到3-4代,取3-4代生长良好、纯度90%以上的细胞用于实验。
1.6 心痛泰含药血清的制备及最佳浓度筛选
12只实验兔适应性喂养1周后,随机分为正常对照组、心痛泰低、中、高剂量组,每组3只。按照实验兔与成人的体表面积折算公式进行换算给药剂量。根据人临床等效剂量换算,换算成兔的心痛泰中剂量给药剂量为4.6 g·kg-1·d-1,减半为心痛泰低剂量2.3 g·kg-1·d-1给药组,加倍为心痛泰高剂量9.2 g·kg-1·d-1给药组。正常对照组生理盐水灌胃。每日灌胃2次,连续灌胃1周。各组于末次给药3 h后,2%戊巴比妥腹腔麻醉并左侧股动脉采血,于4℃静置4 h,3500 r·min-1离心10 min取血清,56℃水浴灭活30 min,0.22 µm无菌微孔过滤除菌,分装入小瓶,置于-20℃冰箱中保存备用。
取对数生长期的VSMC,胰蛋白酶消化,制作6×104个·mL-1的单细胞悬液,加入96孔板,细胞分为空白血清、心痛泰各剂量含药血清组分别设置5%、10%、20%、30%四个浓度,培养基中按比例加入含药血清,每组3个复孔,分别于24 h、48 h、72 h后终止培养,培养至所需时间后,每孔加入10 µL的CCK-8试剂,培养中孵育2 h,酶标仪在450 nm波长检测每孔的吸光值(OD),GraphPad软件计算细胞增殖率。选择对VSMC增殖率高的干预浓度进行后续实验。
1.7 细胞分组
VSMC细胞分为5组:空白血清组、模型组(50 mg·L-1ox-LDL)、心痛泰含药血清组(50 mg·L-1ox-LDL+心痛泰含药血清)、LY294002组(50 mg·L-1ox-LDL+10 µmol·L-1LY294002)、心痛泰含药血清+LY294002组(50 mg·L-1ox-LDL+心痛泰含药血清+10 µmol·L-1LY294002)。
1.8 成分及靶点筛选
1.8.1 中药活性化合物收集及筛选
利用TCMSP、TCMID、TCMIP数据库,收集心痛泰中中药饮片的主要化学成分。根据人体药物代谢动力学参数[13-14],以口服生物利用度≥30%,化合物类药性≥0.18为筛选条件,初步筛选出心痛泰有效高活性化合物。
1.8.2 心痛泰作用靶点预测与“中药-疾病-表型”共同靶点筛选
TCMSP收集心痛泰有效高活性化合物成分后,将相关的活性化合物成分导入STP数据库,剔除无关成分,预测心痛泰与动脉粥样硬化和细胞凋亡相关的潜在靶点。将“动脉粥样硬化”、“细胞凋亡”的检索词纳入GeneCards数据库中检索,收集“动脉粥样硬化”、“细胞凋亡”的作用靶点。通过BG数据库中Van de Peer Lab在线工具取交集获得“心痛泰”、“动脉粥样硬化”和“细胞凋亡”三者密切相关的潜在共同靶点,并绘制韦恩图。
1.8.3 共同靶点关键基因筛选及蛋白PPI网络构建
将预测到的靶点导入String数据库,选择Multiple Protenin,限定物种为Homo sapiens,设定最低要求互动分数为最高可信度0.900[15],得到PPI相关数据并导出数值,再将相关数值导入Cytoscape软件,得到可视化的PPI图,软件计算Degree值。使用Cytoscape软件中CytoHubba中的算法分别对PPI网络图进行亚网络拓扑分析,筛出拓扑分析中前20位基因取并集,整合出关键基因。
1.8.4 共同靶点GO和KEGG富集分析
在WG数据库中设定物种为“Homo sapiens”,采用ORA算法分析,选用FD子数据库,进行GO富集分析。进阶参数设定中,设定P<0.05,余为默认设置。收集BP、CC、MF富集分析数据,进行“加权集合覆盖”分析,并绘制火山图。同时对利用DAVID数据库对共同靶点关键基因进行KEGG富集分析,绘制柱状图,并对富集分析结果进行亚网络拓扑分析,绘制“靶点-通路”弦图。
1.9 指标检测及方法
1.9.1 TUNEL法检测VSMC凋亡率
将VSMC细胞接种于24孔板,每孔密度1×105,石蜡切片、脱水,缓冲液及3%过氧化氢溶液中孵育20 min,PBS洗涤3次,按照TUNEL试剂盒说明在样品中加入检测液,避光孵育1 h,PBS洗涤,DAPI孵育5 min复染细胞核,PBS清洗后使用防淬灭封片液封片,荧光显微镜观察。采用MIAS图像分析系统统计阳性(凋亡)细胞数和阴性(正常)细胞数,并计算凋亡细胞占总体细胞中的百分比,随机在5个不重复视野计算,取平均值。
1.9.2 流式细胞术检测VSMC凋亡率
将各组兔主动脉VSMC调整为1×106个·mL-1,与10 µL Annexin V-FITC及PI避光孵育(15 min)后流式仪检测ASMCs细胞凋亡率。
1.9.3 PCR法测定PI3K、Akt、HIF-1α、caspase-3、caspase-9的mRNA表达
按TRIzol试剂盒说明书提取总RNA,VSMC以1×10个·mL-1接种于6孔板中,每孔加入1 mL TRIzol,冰上放置5 min,枪头吹打,将细胞收集到离心管,室温放置5-10 min使细胞充分裂解后,加入4℃的氯仿,震荡15 s,冰盒上静置5 min,75360 r·min-14℃低温高速离心15 min,分层后取水相层(主要含有RNA),加入4℃预冷的无水乙醇,混匀。将上步所得溶液全部加入到吸附柱(Spin Colums RM)中,在4℃,75360 r·min-1条件下离心30 s,保留流出液。在留出液中加入2/3体积无水乙醇(4℃预冷),混匀,弃流出液,离心2 min,将吸附柱装入RNase-Free离心管中,加入38 µL RNase Free H2O(4℃预冷),冰盒上静置3-5 min,充分溶解miRNA,重复上述步骤,得到的miRNA液保存在-80℃冰箱或液氮中,防止降解。使用紫外分光光度计检测所提取的RNA溶液在260 nm、280 nm、320 nm处的吸光值,计算浓度及纯度。利用Primer Premier 5.0软件设计PI3K、Akt、HIF-1α、caspase-3、caspase-9、β-actin的引物序列。按说明书将RNA通过逆转录合成cDNA,以cDNA为模板,配制荧光定量PCR,采用荧光定量PCR法测定VSMC中PI3K、Akt、HIF-1α、caspase-3、caspase-9的mRNA表达。数据采用2-ΔΔCT法计算分析基因表达水平。委托上海生工生物股份有限公司设计与合成,各基因的mRNA引物见表1。

表1 PI3K、Akt、HIF-1α、caspase-3、caspase-9的mRNA引物
1.9.4 Western blot法测定p-PI3K、PI3K、p-Akt、Akt、HIF-1α、cleaved caspase-3、cleaved caspase-9的蛋白表达
弃掉培养液,每孔加入200 µL的RIPA裂解液,细胞破碎仪破碎细胞,离心机(4℃ 75360 r·min-1)离心15 min取上清,稀释BSA标准品,配置BCA工作液。测定BSA标准品及每个样品的吸光值,同时做好记录。绘制标准曲线,计算样品中的蛋白浓度,根据每次上样蛋白量为20 µg计算出每次上样体积。按照配方配好分离胶,无水乙醇压胶,加入一定体积的蛋白样品和Marker上样。配制1×电泳液,用1×电泳液浸没胶板,开始电泳(60 V压缩蛋白,80 V分离蛋白),300 mA恒流转膜30 min。根据说明书(p-PI3K、PI3K、p-Akt、Akt、HIF-1α、cleaved caspase-3、cleaved caspase-9均为1∶1000)封闭膜,孵育一抗的膜用TBST洗涤3次,按照1∶1000稀释HRP标记的二抗,与膜37℃孵育1 h,最后行ECL化学发光检测显影,曝光,扫描蛋白条带。Gel Image ststem ver4.0软件分析。其中,PI3K、Akt的蛋白表达,分别p-PI3K/PI3K、p-Akt/Akt比值进行分析。
1.9.5 免疫荧光染色检测各组VSMC中α-SMA的荧光定量
在培养板中将已爬好VSMC细胞的培养皿用PBS浸洗3次,每次3 min;用4%多聚甲醛固定15 min,PBS浸洗培养皿3次,每次3 min。在玻片上滴加5% BSA,37℃封闭30 min。吸干封闭液,培养皿滴加足够量的稀释好的一抗:α-SMA(1∶100),4℃冰箱一抗孵育过夜,滴加稀释好的荧光二抗488(1∶200),37℃孵育30 min,PBS充分淋洗。滴加DAPI避光孵育3 min,对标本进行染核,用PBS冲洗多余的DAPI,用50%甘油封闭培养皿。洗涤后滴加抗荧光淬灭剂,随后在荧光显微镜下观察并拍照。采用Image J软件对所有样本进行平均荧光强度的半定量分析。
1.10 统计学方法
生信数据统计分析及作图使用GraphPad Prism 8.0.1(244)软件。实验数据使用SPSS 23.0分析,以均值±标准差(±s)表示,所有结果均符合正态分布,多组之间的比较采用单因素方差分析(ANOVA),进一步两两比较,所有结果方差齐,因此采用LSD法。P<0.05有统计学差异,P<0.01有显著统计学差异。
2 结果
2.1 心痛泰含药血清最佳质量浓度(对VSMC增殖的影响)的筛选结果
在5%、10%药物浓度下,与空白组比较,心痛泰低剂量组、心痛泰中剂量组、心痛泰高剂量组含药血清的OD值均升高,差异有统计学意义(P<0.05或P<0.01);心痛泰高剂量组在5%和10%浓度下的OD值较空白组升高(P<0.05或P<0.01),但在20%和30%浓度下的OD值较空白组下降。心痛泰低剂量组在5%、10%、20%、30%浓度下的增殖率分别是134.25%、153.47%、168.16%、136.32%;心痛泰中剂量组在5%、10%、20%、30%浓度下的增殖率分别是147.85%、163.52%、179.35%、135.83%;心痛泰高剂量组在5%、10%、20%、30%浓度下的增殖率分别是157.35%、124.28%、93.65%、82.41%;提示20%心痛泰中剂量组对VSMC的增殖作用最强,故选取其用于体外实验。见图1。

图1 心痛泰不同剂量和浓度的含药血清对VSMC增殖的影响
2.2 心痛泰活性化合物靶点预测与“中药-疾病-表型”共同靶点筛选的结果
通过TCMSP、TCMID、TCMIP等多个数据库共收集心痛泰中化合物905个:其中丹参202个、木香106个、郁金222个、枳壳17个、三七119个、山楂32个、川芎189个、葛根18个;初步筛选后得出心痛泰有效高活性化合物:丹参65个、木香6个、郁金15个、枳壳5个、三七8个、山楂6个、川芎7个、葛根4个。通过STP数据库对心痛泰中活性化合物的相关靶点进行预测,筛出心痛泰中丹参、木香、郁金、枳壳、三七、山楂、川芎、葛根共741个靶点。通过GC数据库数据,收集得到动脉粥样硬化靶点共4063个。通过GC数据库,收集得到“细胞凋亡”的12493个表型靶点。使用BG数据库提取“中药(心痛泰活性化合物)-疾病(动脉粥样硬化)-表型(细胞凋亡)”相交集的共同靶点,共460个。
2.3 共同靶点关键基因筛选及蛋白PPI网络构建的结果
共同靶点导入String数据库,使用String数据库及Cytoscape软件,对心痛泰、动脉粥样硬化和细胞凋亡共同靶点蛋白进行网络分析,得出PPI网络。同时采用PPI网络图亚网络拓扑分析,整合Degree、Betweenness、Closeness三种算法得到的基因,取三者并集,计算得出16个关键基因,排名前10的基因如下:AKT、TNF、VEGF、SRC、IL1β、EGFR、STAT3、JUN、HSP90AA1、Caspase-3。
2.4 共同靶点GO和KEGG富集分析
KEGG富集于171条信号通路,主要富集于PI3K/Akt信号通路、HIF-1α信号通路、细胞凋亡信号通路、MAPK信号通路、cAMP信号通路、肿瘤相关通路、Ras信号通路等,结果绘制成火山图,见图2。可见与心痛泰化合成分与细胞凋亡(图中apoptosis)和动脉粥样硬化(兔中fluid stress and atherosclerosis)密切相关。

图2 KEGG富集分析结果
对KEGG富集分析的主要3条通路构建“靶点-KEGG”弦图,如图3。可见与心痛泰化合成分以及细胞凋亡相关的通路主要集中在PI3K/Akt(图中红色部分)和HIF-1α(图中绿色部分)。

图3 “靶点-KEGG”弦图
2.5 心痛泰含药血清对各组VSMC凋亡情况的比较
分别采用TUNEL法和流式细胞术检测各组VSMC凋亡。在TUNEL检测中,各组细胞分别采用DAPI、TMR染色,正常VSMC细胞核DAPI染色呈蓝染,凋亡VSMC的细胞核TMR染色呈红染。空白血清组DAPI蓝染的细胞较多,TMR红染的细胞很少,提示常规培养模式下,空白血清组仅有极少量的VSMC凋亡;模型组DAPI蓝染的细胞减少,TMR红染的细胞显著增加,提示模型组的VSMC凋亡明显增多;与模型组比较,20%心痛泰中剂量含药血清组(以下简称心痛泰含药血清组)、LY294002组、心痛泰含药血清+LY294002组的DAPI蓝染的细胞显著较多,TMR红染的细胞明显减少,提示心痛泰含药血清和LY294002干预后,VSMC的凋亡明显减轻;与空白组比,模型组VSMC凋亡阳性细胞百分比明显升高;与模型组比,心痛泰含药血清组、LY294002组、心痛泰含药血清+LY294002组的VSMC凋亡阳性细胞百分比明显降低,差异有显著统计学意义(P<0.01);与心痛泰含药血清组比,心痛泰含药血清+LY294002组的VSMC凋亡阳性细胞百分比无显著差异(P>0.05),如图4、图5。流式细胞术结果提示,与空白血清组比较,模型组VSMC的早期凋亡率、晚期凋亡率、总凋亡率均明显增加,差异有显著统计学意义(P<0.01);与模型组比较,心痛泰含药血清组、LY294002组、心痛泰含药血清+LY294002组VSMC的早期凋亡率、晚期凋亡率、总凋亡率均明显降低,差异有显著统计学意义(P<0.01);与心痛泰含药血清组比,心痛泰含药血清+LY294002组的VSMC早期凋亡率、晚期凋亡率、总凋亡率均无明显差异(P>0.05)。如图6、图7。

图4 TUNEL法检测心痛泰含药血清对VSMC凋亡的影响(X200)

图5 TUNEL法检测心痛泰含药血清对VSMC凋亡率的影响

图6 流式细胞术检测心痛泰含药血清对VSMC凋亡率的影响

图7 流式细胞术检测心痛泰含药血清对VSMC凋亡率的影响
2.6 心痛泰含药血清对各组VSMC中PI3K、Akt、HIF-1α、Caspase-3、Caspase-9 mRNA表达的影响
与空白血清组比较,模型组PI3K、Akt、HIF-1α、caspase-3、caspase-9的mRNA表达明显增加(P<0.01);与模型组比较,心痛泰含药血清组、LY294002组、心痛泰含药血清+LY294002组PI3K、Akt、HIF-1α、caspase-3、caspase-9的mRNA表达下降,差异有统计学意义(P<0.05,P<0.01);与心痛泰含药血清组比,心痛泰含药血清+LY294002组的PI3K、Akt、HIF-1α、caspase-3、caspase-9的mRNA表达无明显差异(P>0.05)。归一化处理的数据做成柱状图,见图8。
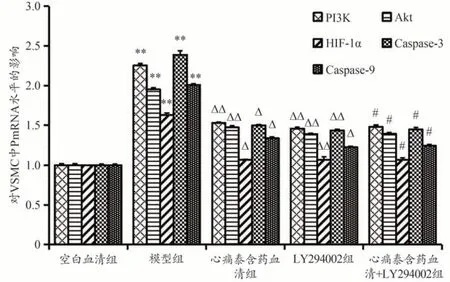
图8 心痛泰含药血清对各组VSMC中PI3K/Akt/HIF-1α通路mRNA表达的影响
2.7 心痛泰含药血清对各组VSMC中p-PI3K/PI3K、p-Akt/Akt、HIF-1α、cleaved caspase-3、cleaved caspase-9蛋白定量的影响
与空白血清组比较,模型组VSMC中p-PI3K/PI3K、p-Akt/Akt、HIF-1α、cleaved caspase-3、cleaved caspase-9的蛋白表达明显增加(P<0.01);与模型组比较,心痛泰含药血清组、LY294002组、心痛泰含药血清+LY294002组VSMC中的PI3K、p-PI3K、Akt、p-Akt、HIF-1α、cleaved caspase-3、cleaved caspase-9的蛋白表达减低,差异有统计学意义(P<0.05,P<0.01)。与心痛泰含药血清组比,心痛泰含药血清+LY294002组的PI3K、Akt、HIF-1α、caspase-3、caspase-9的蛋白表达无明显差异(P>0.05)。见图9、图10。

图9 心痛泰含药血清对VSMC中p-PI3K/PI3K、p-Akt/Akt、HIF-1α、cleaved caspase-3、cleaved caspase-9蛋白表达的影响

图10 心痛泰含药血清对VSMC中p-PI3K/PI3K、p-Akt/Akt、HIF-1α、cleaved caspase-3、cleaved caspase-9蛋白表达的影响
2.8 心痛泰含药血清对各组VSMC中α-SMA荧光含量的影响
免疫荧光染色显示,与空白血清组比较,模型组VSMC中α-SMA荧光含量明显降低(P<0.01);与模型组比较,心痛泰含药血清组、LY294002组、心痛泰含药血清+LY294002组VSMC中α-SMA荧光含量明显增加,差异有统计学意义(P<0.05,P<0.01);与心痛泰含药血清组比,心痛泰含药血清+LY294002组VSMC中α-SMA荧光含量无明显差异(P>0.05)。见图11、图12。

图11 心痛泰含药血清对各组VSMC中α-SMA荧光含量的影响(×400)
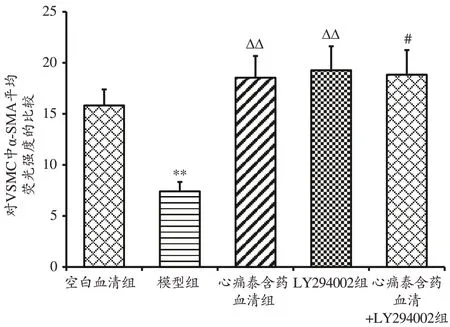
图12 心痛泰含药血清对VSMC中α-SMA平均荧光强度的影响
3 讨论
冠心病急性冠脉综合征患者的动脉内存在较多的易损斑块(Vulnerable plaque,VP),VP致病的机制是纤维帽变薄导致斑块破裂出血、阻塞管腔,引起急性心肌梗塞[16]。纤维帽由增殖的VSMC和细胞外基质(Extracellular matrix,ECM)构成,VSMC凋亡可导致纤维帽变薄,显著推动了易损斑块的进展,主要表现为晚期斑块的破裂[17]。VSMC一方面是纤维帽的骨架细胞,参与纤维帽的构成,另一方面VSMC在炎症介质的刺激下,可合成Ⅰ、Ⅲ型胶原纤维、促进弹力蛋白的分泌,胶原纤维和弹力蛋白可起到稳定纤维帽的作用[18]。晚期斑块中的VSMC凋亡增多可导致VSMC减少,胶原纤维和弹力蛋白和合成减少,致使纤维帽变薄,其肩部极易破裂[19]。Clarke等[20]的研究发现:ApoE-/-小鼠模型中,VSMC凋亡可导致斑块的纤维帽变薄、胶原和基质丢失、细胞碎片堆积和内膜炎症等现象。斑块破裂后,在凝血因子Ⅴ和Ⅶ的影响下,凋亡的VSMC可通过暴露在其表面的磷脂酰丝氨酸(产生凝血酶的底物)直接生成血栓[21],临床上表现为急性冠状动脉综合征。急性冠脉综合征患者的动脉斑块中VSMC凋亡率较高,凋亡的VSMC在血管壁内聚集,释放大量的炎性介质和细胞因子,引发炎症反应和继发性坏死,致使易损斑块的坏死核心不断扩大[22-23]。机制图见图13。

图13 VSMC凋亡导致易损斑块纤维帽破裂的机制
动脉硬化易损斑块常见于冠心病、急性心肌梗塞、脑梗塞,因此中医学中,易损斑块属于“胸痹”、“真心痛”、“缺血性中风”、“脉痹”等范畴。病机以肝、脾、肾亏虚为本,痰浊、血瘀为标,其中,脾虚生痰是痰瘀互结病机的根源,脾虚失运,气血生化无源则新生血管无以稳固[24]。中医认为过食肥甘厚味,损伤脾胃,脾失健运、脾虚生痰,痰浊凝聚,沉积于动脉内膜则发为粥样斑块[25]。文献回顾表明,中医药对于易损斑块中的VSMC凋亡具有抑制作用[26]。本研究的中药复方为心痛泰,心痛泰由丹参、川芎、三七、郁金、山楂、枳壳、葛根、木香等中药组成。其中,丹参、川芎共为君药,具有活血化瘀之功效;枳壳、木香、葛根,升清降浊,可助脾运气、助心行血;三七、郁金,行气活血祛瘀;山楂消积化滞。全方有理气化痰、活血祛瘀之效。课题组的心痛泰前期基础扎实,且前期研究已证实,心痛泰可下调基质金属蛋白酶-9,上调基质金属蛋白酶抑制物-1,减轻斑块中VSMC周围胶原纤维的分解,增加纤维帽的稳定性,从而稳定易损斑块[7]。
磷酯酰肌醇激酶(PI3K)家族是细胞调节具第二信使特征脂类衍生物生成的重要催化酶,直接影响动脉粥样硬化的发生发展,具有增加VSMC凋亡、促进动脉粥样硬化的作用[27]。PI3K/Akt/HIF-1α信号通路与细胞凋亡密切相关,PI3K激活催化产生PIP3,PIP3可以与下游的信号分子Akt结合,Akt可被PDK1和PDK2磷酸化而激活,磷酸化的Akt可调控多种病理生理过程,例如促进蛋白合成和抑制细胞凋亡[28]。抑制PI3K/Akt信号通路可减轻动脉平滑肌细胞的凋亡[29]。HIF-1α是缺氧诱导因子,在缺氧的条件下可调控多种基因的表达。临床研究表明,血清HIF-1α水平的升高与急性心肌梗塞的发生、发展及患者预后有密切的关系[30]。凋亡是一种细胞程序化死亡的形式,可通过内源性或外源性两种途径实现。同型半胱氨酸蛋白酶家族(Caspase)和Bcl-2家族是凋亡的主要调控因子,不论内源性或是外源性凋亡途径的激活均可由Caspase家族介导,且Caspase-3为大多数凋亡途径的执行蛋白,Caspase-3的激活可促进细胞凋亡。实验研究表明,模型大鼠血管中层VSMC凋亡时,Caspase-3的蛋白表达明显增多[31]。
本研究以VSMC为研究对象,采用生物信息学方法初步筛查出与心痛泰、动脉硬化和VSMC凋亡的相关基因和通路,再采用体外研究的方法,探索心痛泰含药血清抑制PI3K/Akt/HIF-1α信号通路及凋亡相关因子的表达情况,从分子生物学水平证实心痛泰对易损斑块中VSMC凋亡的具体作用机制。本研究结果提示,ox-LDL可模拟易损斑块中VSMC凋亡的细胞模型,模型细胞的VSMC凋亡数量和凋亡率显著增加。CCK8法筛选出心痛泰作用于实验兔VSMC的最佳含药血清为20%中浓度含药血清。与模型组相比,心痛泰含药血清组、LY294002组、心痛泰含药血清+LY294002组的斑块内PI3K/Akt/HIF-1α通路的基因与蛋白表达降低,其下游的凋亡相关因子caspase-3、caspase-9的表达明显下降。TUNEL染色显示,与模型组相比,心痛泰含药血清组、LY294002组、心痛泰含药血清+LY294002组的VSMC凋亡阳性细胞百分比明显减少。流式细胞学结果表明,与模型组相比,心痛泰含药血清组、LY294002组、心痛泰含药血清+LY294002组的早期凋亡率、晚期凋亡率、总凋亡率均下降;与心痛泰含药血清组相比,心痛泰含药血清+LY294002组改善VSMC凋亡的效果无明显差异,本次研究结果并未发现心痛泰含药血清与LY294002叠加使用能产生协同抗凋亡效果,分析原因可能是在本研究中,心痛泰含药血清和LY294002均已达最大抗VSMC凋亡作用,叠加使用并不优于单一含药血清和单一LY294002的抗凋亡的效果,说明心痛泰含药血清可能具有LY294002的类似作用,通过抑制PI3K/Akt/HIF-1α通路来减轻兔VSMC凋亡。
综上,心痛泰含药血清可通过抑制PI3K/Akt/HIF-1α通路及caspase-3、caspase-9从而减轻ox-LDL诱导的VSMC的凋亡,有助于维持VSMC结构和功能,这可能是心痛泰稳定斑块纤维帽的潜在机制之一,为心痛泰稳定易损斑块提供了体外研究依据。然而,本研究尚有不足之处,例如需进一步完善心痛泰含药血清的质谱分析,研究心痛泰对人体斑块中的作用机制是否与细胞实验的作用机制相吻合等。
