山桐子性别分子标记的通用性验证
2023-11-07何秀娟王泽琼袁龙义孙中海邱文明
严 莉,仝 铸,何秀娟,肖 翠,王泽琼,袁龙义,孙中海,邱文明
(1.湖北省农业科学院果树茶叶研究所/湖北省农业科技创新中心果树茶叶研究分中心,武汉 430064;2.长江大学园艺园林学院,湖北荆州 434025)
山桐子(Idesia polycarpaMaxim.)是杨柳科(Salicaceae)山桐子属高大落叶乔木,在中国主要分布在秦岭、淮河以南,其果实和种子中富含丰富的油脂,是优质的木本油料树种[1,2]。随着中国木本油料行业的发展,山桐子的栽培面积不断增加,栽培优良新品种具有重要意义[3]。山桐子为雌雄异株植物,雌株果实和种子可用于油料生产,雄株在生产上多作为授粉树,雌株的经济价值明显高于雄株。目前,山桐子的育种工作重点在雌性品种选育方面[4]。生产中,山桐子多用种子繁殖或者无性扦插繁殖[5]。实生繁殖过程中童期漫长,一般要经过4~5 年的营养生长期,才能进入生殖成熟期[4,5];而无性繁殖成活率低,操作难度也较大,成本也较高[6]。雌雄异株植物在幼苗期的性别很难区分,因此,开发用于山桐子幼苗早期性别鉴定的技术,可以极大程度地节约育种成本、缩短育种周期,在生产和育种方面具有极其重要的意义[7,8]。
宋雨[9]利用表型性状、分子标记技术对山桐子的地理分布、遗传多样性及种质资源鉴定等方面进行研究。在表型性状方面,岁立云等[10]根据果实性状自然变异将陕西省的山桐子划分为6 种果实形态变异类型;张小雪等[11]通过对不同种源的2 年生山桐子生长规律差异的分析,发现不同种源山桐子之间具有一定的遗传差异性;李大伟[12]通过对8 省16个不同产地山桐子的15 个表型性状指标的研究,将43 个山桐子单株分为3 类。在DNA 分子标记方面已有一些关于山桐子植物性别鉴定和遗传资源多样性分析的标记被报道。简单重复序列间区扩增多态性(Inter-simple sequence repeat,ISSR)是基于基因组微卫星的分子标记,为通用标记,该标记已在多种植物遗传图谱构建、品种鉴定、遗传多样性分析等研究中得到应用[13]。王艳梅等[13]以12 个不同分布区的山桐子为材料,利用ISSR 分子标记对山桐子的遗传差异进行分析;代莉等[14]建立了适用于山桐子ISSR-PCR 的反应体系;董娜等[15]以毛叶山桐子为材料,利用ISSR 分子标记筛选出能够鉴别毛叶山桐子性别的特异标记UBC841。目前关于UBC841 的准确性鲜见报道,该标记为雌性特异标记,仅在8 份(其中6 份雌株、2 份雄株)毛叶山桐子中表现出特异性,而没有在更大群体中进行验证[15]。因此,本研究选用来自其他群体的山桐子对该标记进行通用性验证,以验证其准确性。相关序列扩增多态性(Sequence related amplified polymorphism,SRAP)是一种基于PCR(Polymerase chain reaction)的新型分子标记技术,该标记不需预知物种基因序列信息,已在多种植物中得到应用[16];雷瀚等[17]筛选出2 对SRAP分子标记引物,可以准确对滇杨(Populus yunnanensisDode)早期性别进行鉴定;严武平等[18]和魏丽丽等[16]分别优化了适用于鹧鸪茶[Mallotus oblongifolius(Miq.)Muell. Arg.]和草莓(Fragaria ananassaDuch.)的SRAP-PCR 反应体系。在山桐子中,Wang等[19]利用SRAP 分子标记筛选得到1 个与山桐子性别关联的雌性特异标记,该标记为雌性特异标记,其可靠性在原报道所用52 份(包括30 份雌株、22 份雄株)样本中均可得到验证,将该雌性特异标记转化为稳定的SCAR 标记,STZ 标记在上述样本中均表现出特异性,表现出良好的准确率。目前STZ 标记仅在所涉及的材料中进行了应用验证,且所涉及的山桐子样品均来自同一地区,并没有在更大的群体中和更广泛地域中进行检测,其可靠性和稳定性有待进一步检测。
本研究利用已知性别的山桐子种质资源作为材料,旨在探讨UBC841 和STZ 2 个分子标记在山桐子性别鉴定中的通用性,以期为山桐子的早期性别分子鉴定提供参考。
1 材料与方法
1.1 试材及取样
试验于2020—2022 年进行,试料取自湖北省利川市、襄阳市等地,采集已知性别的山桐子资源120份(其中雌株60 份,雄株60 份),选择树龄相近、无病虫害、生长结果正常的成龄植株,随机采集树体不同部位枝条上的幼嫩叶片,经清水洗净后晾干,并用液氮速冻后于-80 ℃保存备用。
1.2 基因组DNA 的获取及检测
采用杭州新景生物试剂开发有限公司生产的植物基因组DNA 快速提取试剂盒提取上述120 份山桐子样品的DNA,具体提取步骤按照试剂盒说明进行,所得DNA 用紫外分光光度法和1%琼脂糖凝胶电泳法检测其质量及完整性。将总DNA 稀释至30 ng/μL,保存于-20 ℃备用。其中离心机为Eppendorf Centrifuge 5810 R 型,微量紫外分光光度计为Nano drop 1000 型,所用凝胶成像系统生产商为Bio-Rad Laboratories Inc.,型号为Gel Doc XR+。
1.3 标记来源
UBC841 标记来源于董娜等[15];STZ 标记来源于Wang 等[19],所用引物均为武汉天一辉远生物科技有限公司合成,引物信息具体见表1。

表1 山桐子性别标记引物信息
1.4 UBC841、STZ 性别分子标记反应体系的建立
为分析标记UBC841 的有效性,本研究参照董娜等[15]采用的PCR 条件,以24 份山桐子样品(12 份雌株,12 份雄株)的DNA 为模板,对引物UBC841 进行PCR 扩增反应,结果所得产物中有多态性条带,均未发现性别特异条带。因此,为了更好地验证其通用性,进行了体系优化试验。选择2 个雌株和1 个雄株样品作为模板进行体系优化试验,反应体系如下:使用25 μL 反应体系,2×PCR Mix(预混TaqDNA Polymerase、Mg2+、dNTPs,指示染料和反应Buffer)(武汉吉泰克基因技术有限公司)12.5 μL,10 μmol/L正、反向引物各0.5 μL,DNA 模板1.0 μL,ddH2O 10.5 μL;PCR 扩增程序:94 ℃预变性5 min,94 ℃变性30 s,49.5~56.0 ℃(分别是49.5、51.8、53.5、54.8、55.6、56.0 ℃)退火40 s,72 ℃延伸30 s,32 个循环,最后72 ℃延伸8 min。PCR 采用2.5%的琼脂糖凝胶电泳检测,以扩增条带多态性和清晰程度为选择最佳退火温度的依据。
采用120 份(雌株60 株,雄株60 株)山桐子进行STZ 标记的通用性验证。引物STZ 的PCR 扩增程序如下:94 ℃预变性5 min;94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸30 s,32 个循环;最后72 ℃延伸5 min。PCR 产物采用1%的琼脂糖凝胶电泳检测。
1.5 ISSR 引物PCR 扩增
采用“1.4”中反应体系,利用26 对ISSR 引物(表2)进行扩增,退火温度根据引物而不同,扩增后的PCR 产物采用2.5%的琼脂糖凝胶电泳检测,所用引物均为武汉天一辉远生物科技有限公司合成。

表2 26 对ISSR 引物信息
1.6 SRAP 引物PCR 扩增
选取2 份山桐子模板对随机合成的870 对SRAP 引物进行PCR 扩增,PCR 扩增反应体系同“1.4”,退火温度根据引物而不同,扩增后的PCR 产物采用2.5%的琼脂糖凝胶电泳检测,所用引物均为武汉天一辉远生物科技有限公司合成。
2 结果与分析
2.1 UBC841 标记在已知性别山桐子样品中的体系优化及验证结果
选取山桐子2 份雌性样品和1 份雄性样品对引物UBC841 的扩增体系进行优化,最终得出引物UBC841 在山桐子中的扩增最适退火温度为53.5 ℃。由图1 可以看出,UBC841 标记在所有温度下均能扩增出多态性条带,但均未表现出性别差异;UBC841 标记在53.5 ℃退火温度时,扩增产物的多态性较高,扩增条带比较清晰,非特异性扩增较少,因此确定引物UBC841 的最适退火温度为53.5 ℃;为验证引物的有效性,继续扩大样本检测,采用优化后的最适退火温度在24 份(12 份雌株,12 份雄株)山桐子样品中进行检验,结果如图2 所示。UBC841 引物标记在24 份山桐子样品的扩增产物中,均在250~300 bp 有多态性片段出现,但都没有表现出性别特异性。因为该标记在所用材料中未表现出良好的性别特异性,所以没有继续扩大样本检测。
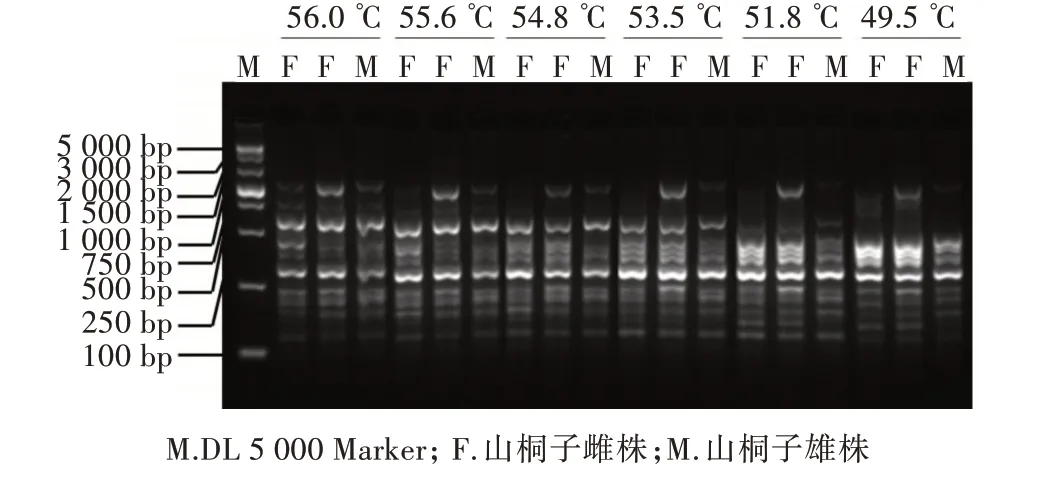
图1 引物UBC841 退火温度梯度

图2 引物UBC841 在24 份山桐子样品中的验证结果
2.2 STZ标记在已知性别山桐子样品中的验证结果
利用“1.4”中反应体系对120 份(雌株60 份,雄株60 份)山桐子样品进行检测,结果如图3 所示。在60 份雌株样品中共有26 份样品扩增出明亮的特异条带,占比为43.3%,有9 份样品扩增条带较弱,占比为15%;而在60 份雄性样品中也扩增出特异片段,且与标记条带大小一致,有27 份样品扩增出明亮的条带,占比为45%,有7 份样品扩增出较暗的条带,占比为11.7%;在雌雄株中均能扩增出特异片段,雌雄株扩增出特异片段的比例相近,并没有在雌株中表现出性别差异,因此没有性别特异性,而在Wang等[19]报道中STZ 是雌性特异标记,仅出现在雌性样品中。
2.3 ISSR 引物扩增多态性
选取6 份山桐子样品对26 对ISSR 引物进行扩增,部分引物扩增结果如图4 所示。26 对引物共有20 对引物能够扩增出条带,引物有效率为76.9%,共扩增出176 条条带,其中引物UBC829 扩增条带数最多,为13 条;其次是引物UBC812 和UBC864,均扩增出12 条条带;但是该20 对引物在6 份山桐子样品中均未表现出性别特异性,因此没有继续扩大样本进行检测。

图4 部分ISSR 引物在6 份山桐子样品中的扩增图谱
2.4 SRAP 引物扩增多态性
经过SRAP-PCR 扩增筛选,846 对引物中有792对引物可扩增出清晰的条带,引物的有效扩增率达91.03%;有231 对引物能够扩增出多态性条带,部分引物扩增电泳结果如图5 所示。初步统计结果显示,265 对引物共扩增得到1 338 条条带,其中引物组合me04/em04 条带数最多,为15 条,选取6 份模板(雌株3 份,雄株3 份)对该265 对引物进行扩大样本筛选,在雌雄株中均未表现出特异性。

图5 部分SRAP 引物在2 份山桐子样品中的扩增图谱
3 讨论
山桐子早期性别鉴定对育种和栽培实践有重要意义。山桐子作为雌雄异株植物,其雌株的经济价值远高于雄株,但由于山桐子的童期较长,且结实较晚,幼年期的山桐子雌、雄株在形态上很难将其区分,通常需要经过3~5 年,在开花期通过雌雄花才能准确区分,这给生产带来极大不便,因此,研究山桐子早期性别分化,在生产上合理配置雌雄个体,对提高山桐子产量具有重要意义[8,15]。
已报道的有关植物性别鉴定的方法有很多,包括形态学[20]、生理生化[21]、同工酶[22]等,这些方法大都是对已成熟个体性别差异的研究。植物个体性别分化会受到多种因素的影响,因此上述方法用于早期性别鉴定时,结果可靠性往往较差[23]。DNA 分子标记受发育阶段及外界环境的影响小,鉴定结果准确、重复性高,因此被广泛应用于雌雄异株植物的早期性别鉴定中[8,23]。目前被报道的分子标记中,应用到山桐子中的主要有SSR、ISSR、SRAP 和SCAR等[5,15,19];李娜等[5]基于转录组序列开发的SSR 分子标记可将4 个不同地区的山桐子进行区分;王艳梅等[13]、代莉等[14]和董娜等[15]分别利用ISSR 分子标记对山桐子的遗传差异进行分析,优化了适用于山桐子的体系,筛选出了能够鉴别山桐子性别的特异标记;Wang 等[19]利用SRAP 分子标记开发了可以鉴别山桐子雌雄株的特异标记,并将此标记转化为稳定的SCAR 分子标记,该标记为雌性特异标记。ISSR分子标记为通用性分子标记,无需预先知道物种基因组的序列[15];目前ISSR 已广泛应用于美洲黑杨(Populus deltoidsMarshall)的新无性系材料鉴定、红橘(Citrus reticulataBlanco)种质资源的遗传多样性分析、番茄(Lycopersicon esculentumMiller)种质资源遗传多样性分析等方面[24-26]。董娜等[15]在ISSR 分子标记开发过程中,所选用材料是毛叶山桐子,采用优化后的体系对100 条引物进行检测,最终在100 对引物中发现引物UBC841 能够在雌株中扩增出特异性条带并且可以稳定存在,该条带大小为250~300 bp;本研究在对UBC841 标记引物进行重复验证时,先对其反应体系进行优化,后为验证引物有效性在24 份山桐子样品中进行扩大样本验证,结果显示,该引物在250~300 bp 有多态性片段出现,但是在雌雄株中并没有表现出性别特异性,因此没有继续扩大样本进行检测。此外,对该扩增片段进行回收测序,共获得10 条不同的序列,因此该引物不宜用于山桐子雌雄株的早期鉴定。
SRAP 分子标记根据基因外显子和启动子中碱基特征,设计独特的双引物来扩增开放阅读框架(ORFs)的特定区域,与ISSR 分子标记相同,SRAP标记不需要事先获取被检测物种的基因组序列,具有简单、高效的特点[16,18,27]。目前SRAP 分子标记技术已经在滇杨(Populus yunnanensisDode)[17]、猕猴桃属(ActinidiaLindl.)[28]、苹果(Malus domesticaMill.)[29]、草莓[16]等植物中均有应用。山桐子STZ 标记就是利用SRAP扩增到的210 bp雌株特异片段转化而来[19]。但是本研究在验证该标记的通用性时,雌株中有35份样品有该特异条带,雄株中有34 份样品有该条带,并未表现性别特异性。推测可能是使用的山桐子样本太少,获得的差异片段并不与性别连锁[19]。
本研究除检验UBC841 和STZ 分子标记的通用性外,还分析了大量的ISSR 和SRAP 分子标记引物,但未筛选出山桐子性别特异标记。随着中国木本油料行业的快速发展,急需开发可靠的分子标记进行山桐子早期性别鉴定。下一步,除了尝试其他新的分子标记技术外,更需加强山桐子性别分化分子机制的研究,探明其性别分化、形成的机理,开发简单、高效、可靠的性别鉴定方法,节约育种成本,加快育种进度,更好地支撑产业高质量发展。
