不同β-葡萄糖苷酶活性乳酸菌发酵豆乳特性分析
2023-11-07刘瑞山王志远柴丽娟陆震鸣史劲松张晓娟许正宏
罗 悦,刘瑞山,王志远,柴丽娟,陆震鸣,史劲松,张晓娟,*,许正宏
(1.江南大学生物工程学院,江苏 无锡 214122;2.江南大学 粮食发酵与食品生物制造国家工程研究中心,江苏 无锡 214122;3.福建绿泉食品有限公司,福建 漳州 363200;4.江南大学生命科学与健康工程学院,江苏 无锡 214122)
大豆中含有丰富的蛋白质、异黄酮、维生素和矿物质等营养素,其中包括人体必需的氨基酸、脂肪酸以及低聚糖益生元,是人类主要的植物蛋白来源之一[1]。豆乳是大豆经加工制成的饮料,因其具有独特的风味、丰富的营养物质而深受消费者青睐。豆乳中富含大豆异黄酮,已发现的大豆异黄酮有12 种,其中3 种为游离型苷元形式(2%~3%),生物活性及生物利用度较高,如大豆苷元、染料木素、黄豆素等,剩余为结合型糖苷形式(97%~98%),生物利用度极低,大豆异黄酮的形态结构是决定其生理活性和生物利用度的关键因素[2-4]。此外,豆乳中常伴有豆腥味,主要是由于大豆在粉碎时脂肪氧化酶被激活,多不饱和脂肪酸被氧化生成氢过氧化物,再降解成多种低分子的醇、醛和呋喃类等挥发性物质,这些物质通常带有不同程度的异味,从而导致豆腥味的形成[5]。豆腥味往往是导致豆乳不良风味的主要因素[6]。
乳酸菌是可以代谢糖类产生乳酸的一类益生菌。乳酸菌发酵食品历史悠久,但主要以乳制品为主。近年来,越来越多的关注集中于以植物原料为基质的乳酸菌发酵。乳酸菌发酵既能改善植物基饮料的风味,提高营养价值,也能延长货架期,增强保健作用[7]。由于兼具植物原料高纤维素特点和乳酸菌的益生特性,迎合消费者的健康需求,乳酸菌发酵成为植物型原料加工领域的新热点。菌种是影响发酵食品的重要因素,而对于豆乳原料,不同乳酸菌的生长性能、代谢特性和酶活性对发酵豆乳的质构、风味特性和营养特性影响巨大。目前,Yang Yang等[8]发现乳酸菌发酵可有效降低豆乳中主要豆腥味物质正己醛、庚醛、1-辛烯-3-醇和2-戊基呋喃等的含量。
在豆乳中,大豆异黄酮是重要的生物活性物质,已有研究发现其生物转化可以在多种酶催化下进行,其中β-葡萄糖苷酶普遍被乳酸菌表达,是这类黄酮糖苷转化的主要催化酶[9-11]。研究表明产β-葡萄糖苷酶乳杆菌、双歧杆菌等能够水解豆乳中的大豆异黄酮糖苷,转化为高活性苷元[12]。β-葡萄糖苷酶可通过去糖基化过程参与黄酮糖类化合物的水解,破坏其与碳水化合物之间的键,将糖苷类黄酮转化为较高活性的苷元形式,这种转化利于提高基质的黄酮类物质含量和功能特性[13]。然而,不同乳酸菌的酶活性存在差异,而不同菌株表达的β-葡萄糖苷酶对大豆苷、黄豆苷、染料木苷的底物偏好性仍然缺乏相关研究。
因此,本研究以豆乳为发酵基质,对比不同β-糖苷酶活性的乳酸菌发酵对豆乳总酚、总黄酮、大豆异黄酮含量和抗氧化活性的影响,并结合活菌数、有机酸、风味物质组成、感官等指标筛选出最适宜豆乳发酵的乳酸菌,旨在开发针对豆乳原料发酵的适宜菌株,为工业生产兼具营养功能和风味特性的益生菌发酵豆乳饮品提供理论依据。同时,本研究菌株酶活性评价、豆乳发酵性能分析和特征成分解析为类似植物性原料的生物加工工艺开发提供可借鉴的流程。
1 材料与方法
1.1 材料与试剂
黄豆购自无锡当地超市;植物乳杆菌(Lactobacillus plantrum,LPL043、LPL013、LPL042、LPL044、L P L 051、L P L 241、L P L 121)、瑞士乳杆菌(L.helveticus,LHE027)、戊糖乳杆菌(L.pentosus,LPE029)、嗜热链球菌(Streptococcus thermophilus,STH041)由实验室前期自不同食品中分离筛选得到,以上所有菌株均通过16S rRNA序列测序并在NCBI比对后鉴定得出分类学信息。
草酸、酒石酸、奎宁酸、丙酮酸、苹果酸、莽草酸、乳酸、乙酸、柠檬酸、琥珀酸标准品 北京索莱宝科技有限公司;大豆苷、大豆苷元、黄豆苷、黄豆素、染料木苷、染料木素标准品 上海阿拉丁生化科技股份有限公司;总抗氧化能力检测试剂盒 生工生物工程(上海)股份有限公司;甲醇、乙腈(均为色谱级)国药集团化学试剂有限公司。
1.2 仪器与设备
UV-8000紫外-可见分光光度计 上海精密仪器仪表有限公司;数字pH计 瑞士Mettler-Toledo公司;2695高效液相色谱仪 美国Waters公司;GC 7890B-MSD 5977B气相色谱-质谱联用仪 美国Agilent公司。
1.3 方法
1.3.1 菌种活化
将甘油管中的菌株接种到MRS肉汤培养基中,于37 ℃恒温培养18~20 h,将活化3 次后的菌悬液5000×g、4 ℃离心10 min收集菌体,用无菌生理盐水洗涤3 次后制备菌悬液,用于接种发酵。
1.3.2 豆乳发酵
豆乳制备:洗豆(浸泡,干豆∶水=1∶3)、打豆浆(湿豆∶水=1∶8)、混合(豆浆∶蔗糖=100∶5)、高压均质(20 MPa,3 min)、灭菌(65 ℃,30 min),得到全豆乳(蛋白质2.8 g/100 mL、脂肪1.8 g/100 mL、碳水化合物0.6 g/100 mL)。
接种发酵:将制备好的菌悬液按2%接种量接种于豆乳中,于37 ℃培养24 h,得到发酵豆乳。以相同条件下未接种发酵的豆乳为对照。
1.3.3β-葡萄糖苷酶活性测定
根据Cheng Jingrong[14]和覃超[15]等的方法对反应体系稍作修改。将0.1 mL酶溶液、0.9 mL 5 mmol/L对硝基苯基-α-D-吡喃葡萄糖苷(p-nitrophenyl-α-Dglucopyranoside,p-NPG)溶液和1 mL 50 mmol/L pH 4.8柠檬酸钠缓冲液混合后,37 ℃孵育10 min,再加入1 mL 1 mmol/L Na2CO3溶液终止反应,测定410 nm波长处的吸光度,并以加热失去活性的酶液(100 ℃、30 min)作为空白对照。以对硝基苯酚(p-nitrophenol,p-NP)浓度(mmol/L)为横坐标、吸光度为纵坐标作标准曲线。酶活性定义为每毫升粗酶液在37 ℃、pH 4.8条件下每分钟分解p-NPG产生1 μmolp-NP的活力。
1.3.4 发酵性能的测定
使用紫外-可见分光光度计测定活化后菌株的生物量(OD600nm);采用平板稀释涂布法测定发酵终点处的活菌数;使用pH计测定发酵终点处的pH值;参考Markkinen等[16]的方法测定发酵终点处的总酸含量;参考尹雪林等[17]的方法测定发酵终点处的还原糖含量;根据解寒等[18]的方法进行测定发酵终点处的有机酸含量。
1.3.5 总酚和总黄酮的测定
参考Kwaw等[19]方法测定豆乳发酵结束后的总酚含量。将样品10000 r/min离心10 min,取0.2 mL上清液加入到1 mL 10%福林-酚试剂中,再加入1 mL 7.5% Na2CO3溶液。避光反应30 min后测定765 nm波长处吸光度。以没食子酸当量(mg/mL)表示总酚含量。
参考Wang Zining等[20]方法测定豆乳发酵结束后的总黄酮含量。将样品10000 r/min离心10 min,取0.15 mL 5% NaNO2溶液与0.5 mL样品上清液混合反应6 min,然后加入0.15 mL 10%硝酸铝溶液并反应6 min,再向混合物中添加2 mL 4% NaOH溶液,振荡混匀3 min后测定508 nm波长处吸光度,以芦丁当量(mg/mL)表示总黄酮含量。
1.3.6 大豆异黄酮含量测定
取豆乳10 mL于50 mL容量瓶中,用80%甲醇溶液定容,超声萃取40 min,10000 r/min离心10 min,收集上清液。重复萃取3 次后合并上清液,于35 ℃真空旋干,用80%甲醇溶液定容至2 mL,过0.45 μm滤膜后备用。高效液相色谱条件参照周帆[21]的条件设定。
1.3.7 抗氧化性的测定
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除活性测定:将样品5000 r/min离心10 min后,取0.5 mL样品添加到1 mL DPPH自由基溶液中,充分混合后避光反应30 min后在517 nm波长处测定样品吸光度,结果表示为DPPH自由基清除率[19]。按下式计算:
式中:A样品、A空白分别为样品、空白对照组反应后的吸光度。
2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除活性测定:将样品5000 r/min离心10 min后,取0.4 mL样品和1.6 mL ABTS阳离子自由基溶液充分混合,避光反应6 min后在734 nm波长处测定吸光度,结果表示为ABTS阳离子自由基清除率[15]。计算公式同上式。
1.3.8 挥发性物质检测
使用顶空固相微萃取-气相色谱-质谱联用技术分析挥发性化合物。根据张佳等[22]方法对气相色谱-质谱条件稍作改进。使用C-WR-95/PDMS/10萃取头在50 ℃平衡5 min,然后350 r/min萃取40 min,最后在250 ℃进样口解吸附5 min完成进样。
色谱条件:DB-WAX毛细管柱,柱长30 m,内径0.25 mm,液膜厚度0.5 μm;He流量1.0 mL/min;升温程序:起始温度50 ℃,保持3 min;以6 ℃/min升温至100 ℃;再以10 ℃/min升温至250 ℃,保持7 min;不分流进样。质谱条件:离子源为电子电离源,离子源温度200 ℃,接口温度250 ℃,电子能量70 eV,扫描范围m/z33~350 u。
样品预处理:准确称取3 g豆乳于进样瓶中,加入2 g NaCl,并向其中加入10 μL质量浓度为10 mg/L的2-辛醇作为内标,摇匀后放入自动进样器中等待进样。
1.3.9 感官评价
在感官分析实验室根据GB/T 16291.1—2012《感官分析 选拔、培训与管理评价员一般导则 第1部分∶优选评价员》[23]的方法进行感官人员筛选和训练,选出8 名合格的人员组成感官评价小组。参考Zhang Wentao等[24]方法,在感官评价之前,评价员根据原豆乳和发酵豆乳提供描述词汇表,如表1所示,然后对该小组进行相同样本的训练。评价时对样品按表1各指标进行1~10 分打分,每个样本重复3 次。

表1 发酵豆乳感官描述词汇Table 1 Sensory description vocabulary of fermented soymilk
1.4 数据处理
所有实验均进行3 次生物学重复,采用Graphpad Prism 8进行显著性分析和图表绘制,P<0.05,差异显著。
2 结果与分析
2.1 不同乳酸菌在MRS培养基中的性能评价
乳酸菌可以利用糖类物质发酵产生乳酸等多种有机酸和挥发性风味物质,改善植物基质食品的风味,同时乳酸菌所产生的酶系有助于植物基质中生物活性物质的转化,从而促进营养物质的吸收,提高产品的益生功能[18,25-26]。课题组前期从不同食品来源中分离筛选得到多种乳杆菌,优选了10 株性能较好的乳杆菌进行后续研究,在MRS培养基中的发酵性能见图1。10 株乳酸菌在MRS培养基中生长20 h后OD600nm均可达到7.00以上,生长状况较好,其中LPL051的生长性能最佳,其OD600nm可高达9.94,而STH041生长量相对较低,其OD600nm为7.33;并且在所有测试菌株中植物乳杆菌普遍拥有相对较高的生长量。随着菌体的生长繁殖,还原糖被利用有机酸被积累,pH值下降。10 株测试菌株在MRS培养基中生长20 h后还原糖消耗量均在9.0 g/L以上,总酸均在1.0 g/100 mL以上,pH值均下降至4.0以下,其中LHE027对还原糖消耗量较低为9.43 g/L,产酸也较低为1.20 g/100 mL,其余菌株均无显著差异。
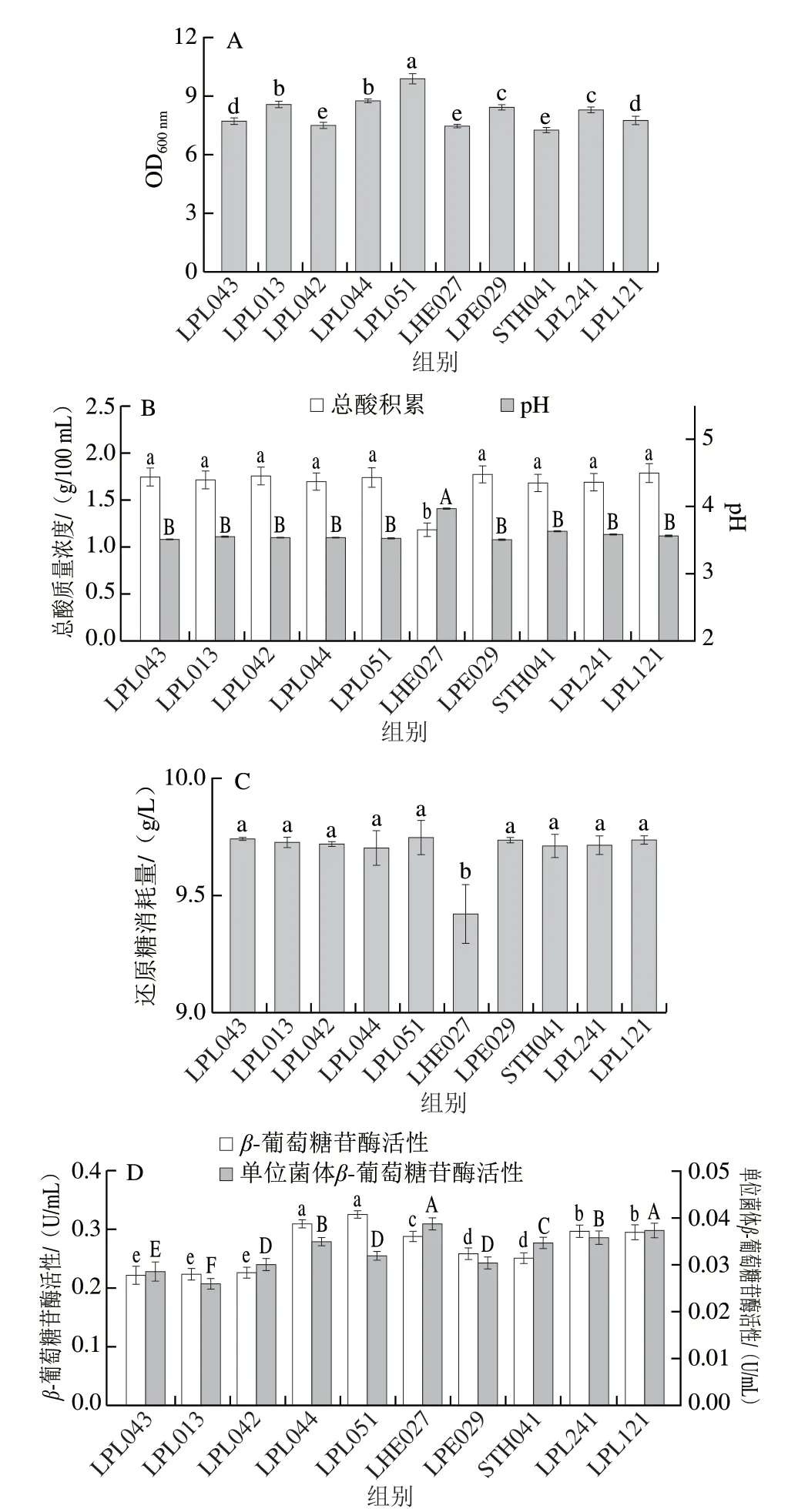
图1 不同乳酸菌在MRS培养基中的性能评价Fig.1 Growth and fermentation performance of different LAB strains cultured in MRS broth
乳酸菌含有的β-葡萄糖苷酶可以水解大豆异黄酮的糖苷结构向生物活性更高的苷元结构转化,从而提高大豆异黄酮的生物利用度[27]。因此本研究也同时评价了10 株测试菌株在MRS培养基中培养20 h后的β-葡萄糖苷酶活性,如图1D所示,所有测试菌株均表现出β-葡萄糖苷酶活性且表现出菌株的差异性,测试菌株的酶活在0.20~0.35 U/mL之间,其中以LPL051酶活性最高为0.33 U/mL,而单位菌体酶活性以LHE027最高为0.039 U/mL;测试菌株的β-葡萄糖苷酶活性与菌株生长量在一定程度上表现出正相关。
2.2 不同乳酸菌在豆乳中的发酵性能评价
2.2.1 发酵豆乳中的活菌数
乳酸菌在发酵食品中的活菌数受植物基质成分影响很大。因此,对发酵豆乳中的乳酸活菌数进行了评估,以确定豆乳在开发具有功能特性的益生菌饮料中的适用性。如图2A所示,豆乳发酵24 h后乳酸菌活菌数均增加至7.3~8.5(lg(CFU/mL)),且不同菌株间表现出明显差异,其中LPL121发酵豆乳活菌数最高为8.48(lg(CFU/mL)),LPE029活菌数最低为7.32(lg(CFU/mL))。这说明测试的乳酸菌可利用豆乳基质中营养物质进行增殖,并在发酵结束后保持较高的活菌数。

图2 不同乳酸菌在豆乳中的发酵性能评价Fig.2 Fermentation performance of different LAB strains in soymilk
2.2.2 不同乳酸菌发酵对豆乳的总酸、pH值和还原糖的影响
总酸、pH值和还原糖是表征菌株生长和发酵程度的重要指标。由图2B可知,发酵豆乳的pH值显著下降,这是由于发酵过程中产生有机酸,例如乳酸、乙酸,导致pH值下降。不同乳酸菌发酵豆乳的总酸含量与pH值呈相反趋势,即发酵后总酸含量显著增加(P<0.05),由0.12 g/100 mL增加至0.40~0.52 g/100 mL,其中含量最高的为LPL121发酵豆乳,达到0.52 g/100 mL。由图2C可知,不同乳酸菌发酵豆乳的还原糖含量均显著下降,由0.56 g/L下降至0.40~0.25 g/L。其下降是因为乳酸菌利用豆乳中的糖类进行生长和发酵。这表明乳酸菌利用豆乳中的糖分生长并产生有机酸,且菌株对豆乳基质具有良好的适应性。
2.2.3 不同乳酸菌发酵对豆乳的有机酸含量的影响
有机酸可以促进消化、软化血管,也会影响产品的稳定性、感官品质和营养品质等[28-29]。原料特性和乳酸菌的代谢特性共同决定了发酵豆乳中的有机酸组成。因此进一步测定乳酸菌发酵豆乳前后有机酸的组成。如图2D所示,原豆乳中主要有机酸是柠檬酸(0.46 g/L)和琥珀酸(0.12 g/L)。相比于发酵前,发酵后产生了大量乳酸(3.47~4.58 g/L),此外,草酸、琥珀酸含量均显著增加(P<0.05)。各菌株都有一定量的乙酸(0.39~0.59 g/L)积累,表明这些菌株除了通过糖酵解途径生成丙酮酸,进而转化为乳酸以外,也存在依赖于HMP途径的异型乳酸发酵途径。而柠檬酸含量降低了33.91%~49.79%。乳酸菌可以用其不完全的三羧酸循环利用柠檬酸产生能量和生长。这一现象在其他植物型原料的发酵中也有一致结果[18]。除LHE027发酵豆乳外,丙酮酸含量也均有所增加,而豆乳发酵前后奎宁酸、苹果酸和莽草酸的变化趋势在各菌株间并不一致,体现出菌株水平的代谢性能差异。相比于原豆乳,发酵使总有机酸质量浓度增加了3.94 g/L以上,其中LPL121积累的有机酸最多。
2.3 不同乳酸菌发酵对豆乳总酚、总黄酮及体外抗氧化性的影响
多酚和黄酮是一类对人体健康能产生积极影响的植物化学物质,研究表明其具有抗炎、抗氧化和降血糖等作用[30-31],因此总酚和总黄酮含量也是植物基食品的一个重要特征。不同乳酸菌发酵豆乳的总酚、总黄酮变化如图3A所示,相比于发酵前,发酵使豆乳总酚含量显著增加77.47(10.38%)~287.84 mg/L(38.55%),其中以LPL044最高,为1034.33 mg/L;除LPE029发酵豆乳外,其余样品中总黄酮含量均显著增加(2.80%~52.57%),这与周帆[21]研究结果一致。乳酸菌发酵后总酚含量的增加可能是由于乳酸菌产生的酶可以破坏酚类与其他取代基之间的键合作用,从而从植物细胞壁中释放可溶性共轭或不溶性结合酚类化合物,而总黄酮增加可能是由于复杂的多酚在发酵过程中被乳酸菌产生的酶分解为简单的黄酮醇化合物[15]。


图3 不同乳酸菌发酵对豆乳植物化学成分和抗氧化能力的影响Fig.3 Effect of fermentation by different LAB strains on the phytochemical composition and antioxidant activity of soymilk
如图3B所示,除STH041外,经乳酸菌发酵后的豆乳DPPH自由基清除率,均显著升高(增加了3.32%~27.50%);除LPL043发酵未对ABTS阳离子自由基清除活性产生影响外,其余经乳酸菌发酵后的豆乳ABTS阳离子自由基清除率均显著上升(增加了7.04%~23.54%)。乳酸菌发酵对抗氧化力的改善与唐宇[4]结果一致,研究表明大豆中总酚、黄酮是发挥抗氧化活性的主要成分[32]。因此本研究中总多酚和总黄酮含量的增加,利于豆乳抗氧化能力的增强。
2.4 发酵豆乳的大豆异黄酮含量变化
大豆异黄酮类物质中主要包括大豆苷、黄豆苷、染料木苷、大豆苷元、黄豆素和染料木素等活性成分[32]。通过益生菌发酵可将大豆中糖苷形式的大豆异黄酮转化为苷元形式的大豆异黄酮,可极大增加其消化吸收率[2]。如图3C所示,原豆乳中主要含大豆苷、黄豆苷和染料木苷,质量浓度分别为 69.86、2.61、105.02 mg/L,相应苷元形式的大豆异黄酮含量较少,分别为3.82、0.15、5.21 mg/L,这与李洁等[27]研究结果一致。豆乳经乳酸菌发酵后3 种糖苷型大豆异黄酮含量均有不同程度下降,苷元型大豆异黄酮含量均显著升高。其中LPL043发酵豆乳中的大豆苷和染料木苷下降最为明显,分别下降了25.61%和22.48%,而黄豆苷则以LPL013发酵豆乳中下降最多,为76.70%;大豆苷元质量浓度增加至5.65~17.61 mg/L,黄豆素质量浓度增加至0.21~0.32 m g/L,染料木素质量浓度增加至9.76~28.70 mg/L。
各菌株发酵豆乳在上述黄酮苷和苷元的含量上存在一定差异,体现了不同来源的菌株对底物存在一定的偏好性。其中LPL042对黄豆苷具有更高的转化选择性;而前期β-葡萄糖苷酶活性最高的LPL044和LPL051对大豆苷和染料木苷转化具有高的转化选择性;LPL241则对各底物都具有相对较好的转化效率,普适性较强。
2.5 发酵豆乳的挥发性风味成分分析
乳酸菌发酵豆乳过程中糖类、氨基酸、脂肪酸、维生素、醛、酮等物质经代谢转化可产生大量挥发性气味物质,从而赋予发酵豆乳新的风味[33]。如图4A所示,在原豆乳和乳酸菌发酵豆乳中共检出66 种挥发性化合物,醇类22 种、酸类7 种、酯类4 种、酮类9 种、醛类15 种、呋喃类4 种、酚类4 种、硫化物1 种。

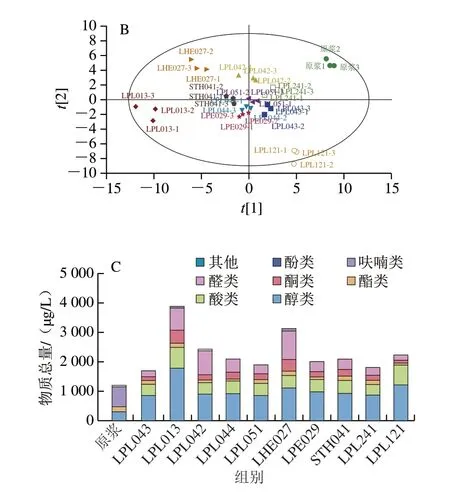
图4 不同乳酸菌发酵对豆乳挥发性成分的影响Fig.4 Effect of fermentation by different LAB strains on volatile components of soymilk
将原豆乳与不同菌种乳酸菌发酵豆乳样品中的所有挥发性物质进行主成分分析(principal component analysis,PCA),如图4B所示,原豆乳和发酵豆乳的挥发性物质组成具有明显差异,STH041、LPL051、LPL241、LPL043、LPL044和LPE029发酵豆乳挥发性物质组成相近,与LPL013、LPL121、LPL042、LHE027间均存在显著差异。如图4C所示,原豆乳中的挥发性物质主要为醇类、酯类和醛类,豆乳经乳酸菌发酵后挥发性物质总含量均显著增加,醇类、酸类和酮类含量增加,醛类和酯类因菌株的代谢差异呈现不同的变化趋势,LPL013、LPL042、LHE027发酵豆乳中的醛类物质略有增加,其余菌株发酵的豆乳中均显著降低。
在新产生或含量增加的醇类物质中,正己醇具有淡嫩叶香气,1-辛烯-3-醇具有蘑菇、薰衣草、玫瑰和干草香气,正庚醇具有油脂气息,异戊醇具有苹果白兰地香气、苯甲醇略带香气、苯乙醇具有清甜的玫瑰香,这些醇类赋予乳酸菌发酵豆乳鲜香醇厚的特征香气。在乳酸菌进行糖、氨基酸、甲基酮等的物质代谢时,可由相应的醛通过脱氢酶还原形成某些醇[34]。乳酸菌发酵使酸类物质总量增加,增加的主要为乙酸和正己酸。乙酸由乳酸菌异型乳酸发酵途径产生[18],正己酸可由乳酸菌经乙酸多步碳链延伸反应合成[35],但其阈值很高,分别为22000 μg/L和2517 μg/L,对发酵豆乳整体香气贡献不大。酮类是氧化反应的最终产物,而乳酸菌的加入促进了氧化反应发生。在新产生或含量增大的酮类物质中,2-庚酮有类似梨的水果香味,3-羟基-2-丁酮呈奶油和脂肪香气,2-壬酮呈水果、花、油脂和药草似香气,它们均仅出现在发酵豆乳中,是发酵特征香气物质。豆乳中的醛类在乳酸菌发酵后可能被还原成醇或氧化为酸[36]。正己醛和壬醛与豆腥味特征具有正相关关系,而它们均在发酵后均显著降低;苯甲醛、2,4-癸二烯醛、反式-2-己烯醛、反式-2-辛烯醛则对豆浆的特有风味有香气贡献。3-羟基-2-丁酮具有奶油香气,增加了发酵豆乳醇香的特征。
对比各菌株,LPL013和LPL121的风味化合物结构与其他乳酸菌差异较大(如乙醇、正庚醇、甲酸辛酯、2-壬酮、2-戊酮、苯甲醛),PCA结果也体现出这两株菌发酵的样品与大多数样品的差异较大。上述结果体现了风味化合物组成也同样具有一定的菌株特异性。
2.6 发酵豆乳的感官评价
本研究从外观、香气、滋味、口感以及整体愉悦度5 个方面评价豆乳经不同乳酸菌发酵前后的感官特性。如图5所示,在外观上,豆乳经乳酸菌发酵后整体发生显著变化,发酵豆乳颜色除LPL044和LPL051外,均比原豆乳略黄一些,光泽感较发酵前好;发酵后乳清均有不同程度的析出,其中LPL044和LPL051发酵豆乳较其他样品而言乳清析出最少,同时也表现出较好的均匀性;豆乳发酵后黏稠性显著增加,其中LPL044、LPL051和LPE029发酵豆乳表现出较高的黏稠性。在香气和滋味上,发酵豆乳较原豆乳整体上增加了酸味、发酵味和奶香,降低了甜味和豆腥味,个别样品则因菌株的发酵特性表现出馊味、苦味和黄油味。其中LPL044和LPL051发酵豆乳的豆香味保留度最高,这与豆乳特征香气物质2,4-癸二烯醛、反式-2-己烯醛、反式-2-辛烯醛等的含量显著增加相关;LPL013和LPL121发酵豆乳表现出最强的酸味和最低的甜味,与上述的糖耗和产酸结果较一致;LPL042、LPL044、LPL051、STH041和LPL241发酵豆乳均有淡淡的奶香,这是因为乳酸菌发酵后产生了奶香味物质3-羟基-2-丁酮;除LHE027、LPL013和LPL042外,其余发酵豆乳样品几乎没有豆腥味,这与发酵豆乳中豆腥味物质正己醛、壬醛和2-戊基呋喃的含量显著降低相关。在口感方面,发酵显著增加了豆乳的醇厚感,带来了少量的刺激感和涩的口感,其中LPL044和LPL051醇厚感较强,细腻度最好柔和度较好,刺激感较弱且无涩味。研究表明,β-葡萄糖苷酶有利于香气前体物质的释放,促进其进一步转化为香气活性物质,赋予食品更高的感官香气质量[37]。LPL044和LPL051表现出最高的β-葡萄糖苷酶活性,发酵的豆乳具有更高的香气质量,滋味协调,口感醇厚细腻,和其他样品区分明显,表现出最高的整体愉悦度(表2)。总体来说,乳酸菌发酵在一定程度上改善了豆乳的外观、香气、滋味和口感,保留了豆香味的同时有效降低了豆腥味,并产生了独特的发酵风味,使产品更受人们喜爱,且高β-葡萄糖苷酶活性的乳酸菌更有利于提高发酵豆乳的品质。
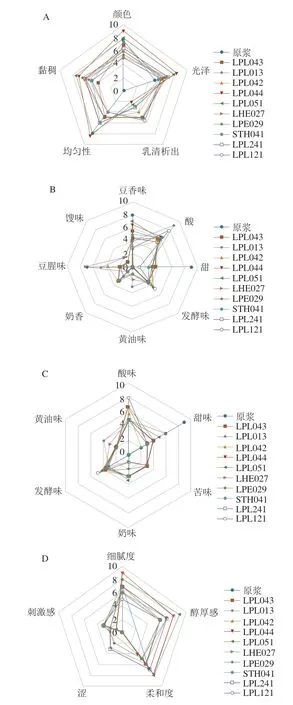
图5 不同乳酸菌发酵豆乳的感官评分Fig.5 Sensory evaluation of soymilk fermented by different LAB strains
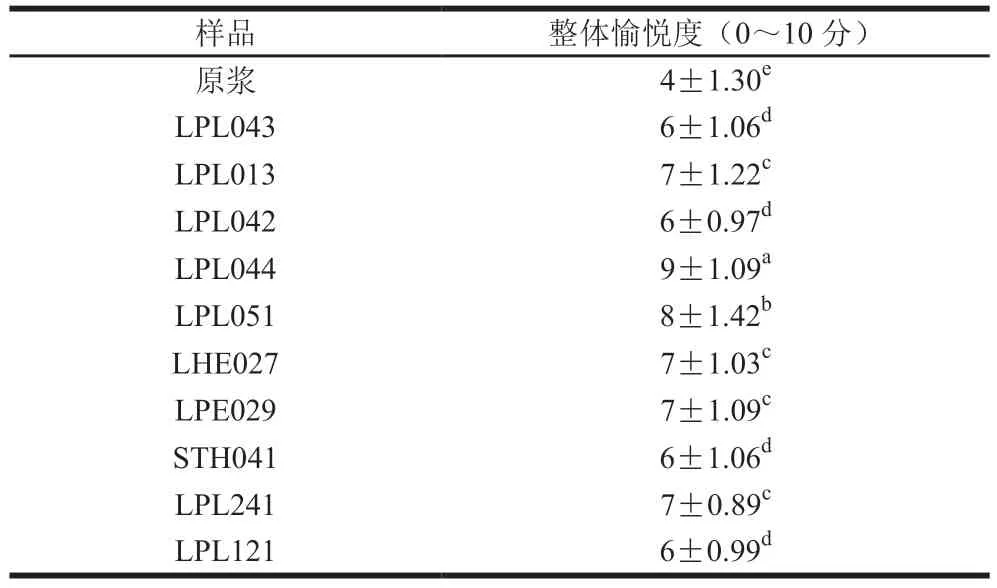
表2 不同乳酸菌发酵豆乳的感官整体愉悦度Table 2 verall sensor pleasure of soymilk fermented by different LAB strains
3 结论
所有测试菌株发酵豆乳后活菌数均增加至7.3(lg(CFU/mL)),其中以植物乳杆菌活菌数普遍较高,表明豆乳是适宜乳酸菌生长的基质。乳酸菌发酵不仅显著积累了乳酸、乙酸等有机酸,还较原豆乳产生含量和种类更多的挥发性物质。保留了豆香味物质、增加了具有奶油香气特征的3-羟基-2-丁酮,同时大多数菌株发酵后降低了豆腥味物质正己醛、壬醛和2-戊基呋喃的含量。感官评价结果表明,乳酸菌发酵显著改变了豆乳的外观、香气、滋味和口感,LPL044的总体感官品质最好,LPL051次之。β-葡萄糖苷酶活性较高的乳酸菌发酵后总酚和总黄酮含量相应增加,大豆异黄酮糖苷相应减少而对应的苷元增加,抗氧化活性也因此提高。不同黄酮糖苷转化程度的差异,也体现了黄酮糖苷水解能力方面的菌株特异性,并且不同来源菌株也存在一定的底物偏好性。LPL044和LPL051具有较高的β-葡萄糖苷酶活性,发酵豆乳具有较高的总酚总黄酮含量、较高的异黄酮转化能力以及较高的抗氧化活性,具有更大的研究和开发价值。同时,研究发现的酶活性、代谢物积累、挥发性成分结构等方面的菌株差异,也为相关原料的生物加工菌株开发提供可借鉴思路。
