紫苏多糖硒酸改性及理化结构特性分析
2023-11-07赵亚娜郭江涛周田田李孟昊李会珍
赵亚娜,郭江涛,周田田,李孟昊,李会珍
(1.中北大学化学与化工学院,山西 太原 030051;2.中北大学晋中产业技术创新研究院,山西 晋中 030600;3.齐鲁工业大学(山东省科学院)菏泽分院,山东 菏泽 274000)
紫苏(Perilla frutescensL.)是唇形科一年生草本植物,为亚洲特有植物资源,在我国已有2000多年栽培历史,是卫生部首批颁布的60 种药食同源类作物之一。作为传统中草药,紫苏具有散寒解暑、润肺止咳、健胃镇静和治疗感冒头痛等功效,苏梗、苏叶、苏籽均可入药[1-2]。现代医学研究表明,紫苏还具有抗氧化、抗病毒、抗炎、抑菌和免疫调节等功效[3-5]。紫苏多糖(Perilla frutescenspolysaccharides,PFPS)是一类复杂的可溶性生物活性大分子,众多研究表明PFPS具有潜在的生物功效。如Li Huizhen等[6]通过DEAE-cellulose-52和Sephadex G-100分离纯化获得了4 种紫苏叶多糖单一组分,都显示了不同程度的体外抗氧化活性。PFPS还具有较强的细胞溶酶体酶活性和巨噬细胞吞噬能力,体外能诱导一氧化氮和肿瘤坏死因子产生,体内能刺激小鼠免疫因子产生,可作为一种免疫增强剂被开发利用[7]。紫苏饼粕多糖是具有β-糖苷键的中等分子质量多糖,主要由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖组成,具有良好的抗氧化活性[8]。
硒是人体必需的微量元素,人体许多疾病的发生与硒缺乏有关,如克山病、心脑血管疾病、癌症和糖尿病等。由于硒无法在人体内合成而必须从食物中摄取,因此人体中硒的缺乏非常普遍[9]。研究表明,有机硒具有比无机硒更高的安全性、更低的毒性和更好的生物利用度。天然多糖的硒酸化修饰是将无机硒转化为有机硒,并同时实现硒与多糖功能强化的一种修饰方法[10]。Surhio等[11]采用HNO3-Na2SeO3法对粒毛盘菌(Lachnumsp.)胞外多糖硒化改性,其中硒以—Se(O)OH基团结合到多糖C6的O6位置,修饰后胞外多糖的降脂能力和肝脏保护作用优于未修饰多糖。也有研究分别在产胞外多糖阴沟肠杆菌、灰树花和平菇培养基中添加适宜浓度的Na2SeO3,硒含量分别达12.962、8.37 μg/g和3.21 μg/g,且显示了有效的抗氧化和免疫调节活性[12-14]。
本研究以紫苏叶为原料,分别经水提醇沉法、Sevag法和膜透析法制备分离粗PFPS。采用HNO3-Na2SeO3法对PFPS进行硒酸改性修饰,获得硒化-紫苏多糖(Se-PFPS)分别采用傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)、高效凝胶渗透色谱法(high performance gel permeation chromatography,HPGPC)、扫描电子显微镜(scanning electron microscopy,SEM)、X射线衍射分析(X-ray diffraction,XRD)和热重分析仪(thermal gravimetric analyzer,TGA)对PFPS和Se-PFPS的结构特征进行表征鉴定,旨在为开发新型富硒食品及扩大紫苏在食品工业中的应用提供科学的理论依据。
1 材料与方法
1.1 材料与试剂
紫苏来源于山西太原中北大学试验田。紫苏叶于9月采收,采收后室温阴干约1 周备用。
亚硒酸钠 成都艾科达化学试剂有限公司;葡萄糖吴江市鑫茂精细化工有限公司;氯化钡 天津市苏庄化学试剂厂;苯酚 天津盛通泰化工有限公司;氯仿、正丁醇 天津市光复科技发展有限公司;浓硫酸、浓硝酸北京华亚兄弟商贸有限公司;抗坏血酸 天津市永大化学试剂有限公司;无水乙醇 天津市科密欧化学试剂有限公司;其他试剂均为分析纯。
1.2 仪器与设备
DS-T250高速多功能粉碎机 上海顶帅工贸有限公司;SB-100D数控超声波清洗器 宁波市新芝生物科技股份有限公司;THZ-82气浴恒温振荡器 江苏金坛市医疗器械厂;L535-1低速(冷冻)离心机 湖南湘仪实验室仪器开发有限公司;KQ-100DE旋转蒸发器 昆山市超声仪器有限公司;Tensor-11 FTIR仪 德国布鲁克公司;紫外-可见分光光度计 上海美谱达仪器有限公司;MIRA LMS SEM 捷克泰思肯公司;SC7620溅射镀膜仪英国Quorum公司;Nano ZS90纳米粒度仪 英国马尔文公司;1200型高效液相色谱仪 安捷伦科技(中国)有限公司;Empyrean XRD仪 荷兰帕纳科公司;STA2500 TGA 耐驰科学仪器商贸(上海)有限公司。
1.3 方法
1.3.1 PFPS提取
参考Wang Chao等[15]方法采用水提醇沉法提取PFPS。阴干的紫苏叶经粉碎过筛后(80 目)称取100 g,按液料比20∶1(mL/g)加入蒸馏水并在80 ℃水浴锅中搅拌提取3 h。4000 r/min离心15 min获得上清液后,沉淀物继续浸提3 h,合并2 次上清液并蒸发浓缩。浓缩液中加入4 倍体积95%乙醇溶液,过夜沉淀后离心获得沉淀物即为PFPS。PFPS经进一步溶解后采用Sevag法除蛋白。向多糖溶液中加入1/5体积的Sevag试剂(正丁醇∶氯仿=1∶4(V∶V)),多次振荡混匀后除去中层蛋白层并回收上清液。上清液经自来水和蒸馏水分别透析48 h(mw:3500 Da)后,冷冻干燥即得到PFPS固体粉末。以葡萄糖为标准建立标准曲线(y=0.0588x+0.0846,R2=0.9945),采用苯酚-硫酸法测定多糖纯度[16]。多糖得率计算如式(1)所示:
式中:W为多糖得率/%;m1为冻干后PFPS质量/g;m0为紫苏叶质量/g。
1.3.2 硒化-紫苏多糖(Se-PFPS)制备
采用HNO3-Na2SeO3法[17]对PFPS进行硒酸化修饰。精确称取质量比为1∶1(g/g)的PFPS和亚硒酸钠于50 mL体积分数0.5%硝酸溶液,加入0.7 g氯化钡,在反应温度60 ℃水浴反应8 h。反应结束后加入适量的饱和硫酸钠溶液去除氯化钡,4000 r/min离心15 min获得上清液后,加入碳酸钠溶液调pH值至中性,之后加入4 倍体积95%乙醇过夜沉淀,离心得到沉淀物即为Se-PFPS。沉淀物经复溶后用透析袋(mw:3500 Da)透析,每8 h换一次水,直至滴加抗坏血酸后不变红色,冷冻干燥后得到Se-PFPS固体粉末,采用苯酚-硫酸法测定多糖纯度[16]。
1.3.3 硒含量测定
参考HJ 680—2013《土壤和沉积物 汞、砷、硒、铋、锑的测定》[18],分别移取0.5、1.0、2.0、3.0、4.0、5.0 mL硒标准液(100.0 μg/L)于50 mL容量瓶中,分别加入10 mL盐酸,室温放置30 min,蒸馏水定容混匀后,测定荧光强度并绘制硒标准曲线(y=164.319x-22.498,R2=0.9998)。准确称取0.1 g样品于消解管中,之后缓慢加入6 mL盐酸和2 mL硝酸,充分混匀。将消解罐装入消解罐支架后放入微波消解仪炉腔内,按表1升温程序进行微波消解。将消解后的样品稀释至合适浓度置于原子荧光光度计中进行测定,并按式(2)计算Se-PFPS中的硒含量:

表1 微波消解升温程序Table 1 Microwave digestion heating program
式中:W为样品中硒含量/(μg/g);ρ为由标准曲线测定样品中硒元素质量浓度/(μg/L);ρ0为空白溶液硒元素质量浓度/(μg/L);V0为微波消解后试液定容体积/mL;V1为分取试液的体积/mL;V2为分取后测定试液的定容体积/mL;m为称取Se-PFPS质量/g。
1.3.4 紫外光谱分析
称取一定量PFPS和Se-PFPS,用蒸馏水溶解并稀释至1 mg/mL后,以蒸馏水为空白对照,200~900 nm范围内作全波长扫描。
1.3.5 FTIR分析
分别称取10 mg PFPS和Se-PFPS粉末于真空干燥箱中干燥到恒质量。用等量递增法逐步加入100 mg无水KBr,利用玛瑙研钵研磨均匀,对其压片并置于红外光谱仪。对无水KBr单独压片,作空白基线调零,在波长范围4000~500 cm-1之间进行扫描。
1.3.6 SEM观察
将2 种多糖样品均匀撒在导电胶上,并使用溅射镀膜仪喷金45 s,在加速电压10~15 kV条件下通过扫描电镜观察样品表面形态特征。
1.3.7 粒径分析
用蒸馏水分别配制0.5 mg/mL的PFPS和Se-PFPS溶液,通过纳米粒度仪在室温测定2 种多糖的粒度分布和聚合物分散性指数(polymer dispersity index,PDI)。
1.3.8 HPGPC分析
参考Ren Yuanyuan等[19]方法,采用HPGPC法测定多糖分子质量分布。分别精确称取PFPS和Se-PFPS 2.00 mg,用1.0 mL超纯水溶解后,过0.22 μm水膜,用高效液相色谱仪对2 种多糖的分子质量分布进行测定。色谱条件:TSK-GEL G4000PWxl色谱柱;示差检测器;流动相:超纯水;流速:0.6 mL/min;柱温:30 ℃;检测器温度:35 ℃;进样量:20 μL。
1.3.9 XRD分析
采用XRD仪测定2 种多糖样品的晶体结构。XRD条件:CuKα辐射,35 kV管压力,100 mA管电流,10°~70°,0.02°梯度。
1.3.10 TGA
采用TGA测定2 种多糖样品热稳定性。以20.0 mL/min的速度将气体转换为氮气,并以10 ℃/min速率将样品从30 ℃加热至800 ℃。
1.4 数据处理
采用Origin 8.0软件进行数据处理。
2 结果与分析
2.1 硒含量分析
由表2可知,经水提醇沉、Sevag法脱蛋白和透析处理后,PFPS得率为3.57%,纯度为(53.22±1.69)%。在此基础上,对紫苏粗多糖进行硒酸改性修饰。在PFPS与亚硒酸钠质量比0.5∶0.5(g/g)、硝酸质量分数0.5%、反应温度60 ℃、反应时间8 h条件下,所得Se-PFPS中硒含量可达(1004.33±48.60)μg/g,硒取代度为0.1%,多糖纯度为(60.92±1.21)%。根据前期研究,紫苏粗多糖主要由3 种单一组分组成,其质量占比分别为18.04%、29.39%和23.33%。在单糖组成方面,紫苏粗多糖由鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖组成,其质量比为3.196∶43.901∶21.956∶4.244∶4.706∶21.997[8]。大量研究显示,采用HNO3-Na2SeO3法对多糖进行稀酸改性,其中硒主要以—Se(O)OH基团结合到多糖C6的O6位置(图1),从而实现硒与多糖的功能强化[11,20]。因此,Na2SeO3与PFPS中单糖发生了硒酸酯化反应。
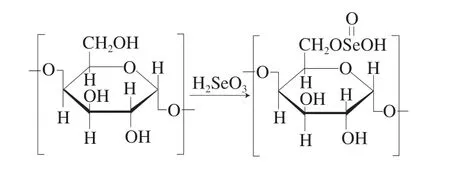
图1 天然多糖硒酸化修饰机制Fig.1 Selenization modification mechanism of natural polysaccharide

表2 PFPS和Se-PFPS化学组成分析Table 2 Chemical composition of PFPS and Se-PFPS
2.2 紫外及红外光谱分析
如图2a所示,2 种多糖在280 nm波长处均存在特殊吸收峰,表明仍有部分蛋白未脱除,分析其可能为结合蛋白[21]。图2b显示,2 种多糖在3379.38 cm-1和3386.77 cm-1处的强吸收峰归属于—OH伸缩振动,2931.97 cm-1和2931.58 cm-1处的吸收峰归属于CH3、CH2、CH等C—H伸缩振动[22]。1606.51 cm-1和1601.31 cm-1处的吸收峰归属于N—H(—CONH—)振动,表明PFPS中存在结合蛋白[23];1415.17 cm-1和1418.02 cm-1处的吸收峰与C—H弯曲振动有关[24],1028.50 cm-1和1025.92 cm-1处的强峰归属于C—O—C糖苷键,837.38 cm-1和837.37 cm-1为吡喃葡萄糖的特征吸收峰[25]。亚硒酸钠在743 cm-1处存在特征吸收峰,而PFPS与Se-PFPS在此范围内无特征吸收峰,表明PFPS与亚硒酸钠发生了化学反应而不是物理吸附。此外,在895.42 cm-1处为Se-PFPS比PFPS多出的特征吸收峰,因此可判断PFPS发生了硒化反应,且硒以亚硒酸酯的形式存在[26-27]。
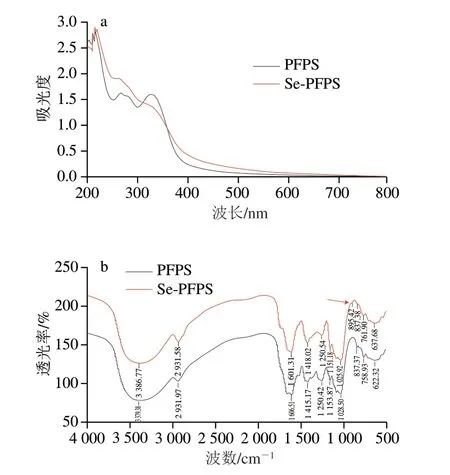
图2 PFPS和Se-PFPS的紫外光谱图(a)和FTIR图(b)Fig.2 UV (a) and FTIR (b) spectra of PFPS and Se-PFPS
2.3 形态学观察
如图3所示,PFPS表面光滑,呈片状结构,许多不规则的交联球在PFPS表面形成网络结构,以产生强大的分子间作用力。Se-PFPS多呈现不规则的断裂碎片,相对分散,表面粗糙,有许多不规则孔洞。形态学观察表明硒酸改性对PFPS结构影响很大,不仅削弱了多糖分子之间交联程度,还改变了它们的形态[28]。

图3 PFPS和Se-PFPS的SEM图Fig.3 SEM photographs of PFPS and Se-PFPS
2.4 粒径及分子质量分析
PDI越小,表明水溶液中多糖颗粒分布越窄,均一性越好。当PDI值小于1时,表明该物质分子质量均一性良好;当PDI值大于1时,表明该物质分子质量均一性差[29]。从图4a和表3可得,硒化修饰后PFPS的PDI从0.71±0.06降至0.60±0.02,可以认为2 种多糖是一种单分散的同质多糖。另外,与PFPS相比,Se-PFPS平均粒径显著减小,表明硒的结合导致糖链结合或缠绕,减小了颗粒尺寸[30]。图4b显示了PFPS与Se-PFPS的主要单糖组分分子质量。结果表明,Se-PFPS各组分出峰时间都早于PFPS,表明Se-PFPS分子质量大于PFPS,这一结果与Lee等[31]研究结果一致,在不同条件下硒化修饰的榆果果胶多糖(6.080×1012~6.557×1012Da)具有比未修饰果胶多糖(4.903×1012Da)更大的分子质量,其可能是由于C6上的—OH被—HSeO3所代替。

图4 PFPS和Se-PFPS的粒径分布图(a)和高效液相色谱图(b)Fig.4 Particle size distribution (a) and HPLC chromatograms (b) of PFPS and Se-PFPS

表3 PFPS和Se-PFPS的粒径、PDI和主要组分出峰时间Table 3 Particle sizes,PDIs and peak times of PFPS and Se-PFPS
2.5 XRD分析
如图5所示,PFPS在衍射角19.92°观察到明显分散峰,而Se-PFPS分别在22.68°和28.69°处存在少量分散吸收峰,表明PFPS比Se-PFPS更容易形成单晶形态,这可能是由于Se-PFPS形成了具有不同紧密性含硒的新聚合物[32]。此外,2 种多糖弱的衍射吸收峰表明它们不能形成大量单晶,多以多晶和非晶形式存在。
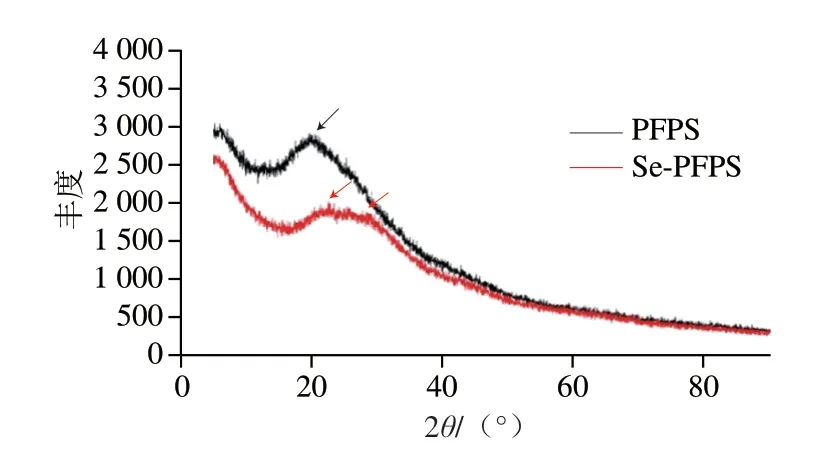
图5 PFPS和Se-PFPS的XRD分析Fig.5 XRD analysis of PFPS and Se-PFPS
2.6 热稳定性分析
图6显示PFPS与Se-PFPS的失重曲线和失重率曲线。PFPS与Se-PFPS分别有3 个分解阶段,第1个阶段为30~150 ℃,归属于水分蒸发;第2个阶段为150~300 ℃,归属于多糖侧链降解;第3个阶段为300~800 ℃,归属于多糖主链降解,且500~800 ℃,2 种多糖质量基本稳定[33]。但相比之下,PFPS质量高于Se-PFPS,表明PFPS更稳定。

图6 PFPS和Se-PFPS的热稳定性分析Fig.6 TGA analysis of PFPS and Se-PFPS
3 结论
本实验从紫苏叶中提取PFPS,并采用HNO3-Na2SeO3法获得硒化-紫苏杂多糖。通过FTIR、HPGPC、SEM,XRD和TGA等分析对PFPS和Se-PFPS进行理化性质和结构比较。结果表明硒以硒酯的形式取代了PFPS中C6位羟基,实现了无机硒向有机硒的转变。同时,硒酸改性减小了多糖颗粒尺寸,增加了多糖分子质量,改变了多糖形态特征和晶体状态。
