OSA淀粉调节玉米醇溶蛋白颗粒的界面性质及其Pickering乳液稳定性分析
2023-11-07雷丹丹王立敏钱晓晴吴子健
雷丹丹,王立敏,张 文,赵 培,钱晓晴,曲 奥,吴子健
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
Pickering乳液是由大分子固体胶体颗粒(如蛋白质及多糖等)稳定的乳液体系。这些大分子颗粒能够不可逆地吸附于乳液的油水界面上,有效降低两种不相溶相间的界面能,防止Pickering乳液液滴发生絮凝、Ostwald熟化和相分离[1]。玉米醇溶蛋白(Zein)是目前应用广泛的一种天然稳定Pickering乳液的颗粒,具有两亲性,可自组装形成球形纳米颗粒,但Zein中50%以上的氨基酸残基为疏水性残基[2],其在水溶液中的分散性差,易产生聚集、沉淀等不稳定现象,因此,需要采取有效措施对Zein进行修饰,以改善其稳定Pickering乳液的性能。目前有研究报道一些亲水性分子(如蛋白质、多糖和多酚等)可通过氢键、静电相互作用和疏水相互作用等非共价作用与Zein形成复合纳米颗粒,进而改善Zein的表面疏水性和润湿性,所形成的复合颗粒由于亲疏水性得到改善,能很好地吸附于油水界面上,稳定Pickering乳液。Jiang Yang等[3]的研究表明低酰基结冷胶可通过静电相互作用与Zein形成复合颗粒,提高了Zein的表面润湿性,由于低酰基结冷胶-Zein形成了连续的交联网络,提高了Pickering乳液的乳化效果及稳定性。Tao Shengnan等[4]以淀粉纳米晶体修饰Zein可有效提高该蛋白在Pickering乳液中的稳定性。Zhao Zijun等[5]利用亲水性的没食子酸修饰Zein,制备的Zein-OSA淀粉复合颗粒所形成的保护层可以降低Pickering乳液的脂质氧化速率。因此,通过合适的亲水性分子修饰Zein以改善其疏水特性,是提高Zein稳定Pickering效率的重要途径之一。
辛烯基琥珀酸淀粉酯(octenyl succinic anhydridemodified starch,OSA淀粉)是淀粉经过辛烯基琥珀酸酐酯化作用得到的,OSA淀粉链上同时引入了亲水的羧基和疏水的烯基长链,因此OSA淀粉同时具有亲水性和疏水特性[6]。OSA淀粉在水溶液中可降低界面张力,起到一定的乳化作用,已被广泛用作微胶囊的壁材以及Pickering乳液稳定剂。Yan Chi等[7]以OSA淀粉通过静电相互作用与壳聚糖复合颗粒,可用于高内相乳液的稳定剂,其可吸附在油滴界面处,有效防止了油滴聚集。然而目前OSA淀粉和醇溶蛋白形成复合颗粒的研究数据缺乏,OSA淀粉的加入对醇溶蛋白理化性质的影响也尚属空白。
本研究以OSA淀粉与Zein形成复合颗粒,探究Zein-OSA淀粉复合颗粒的粒径和多分散性指数(polydispersity index,PDI);利用傅里叶变换红外光谱、荧光光谱、解离测试和三相接触角的测量对复合颗粒进行表征,揭示Zein与OSA淀粉的相互作用机制;并将Zein-OSA淀粉复合颗粒用于稳定Pickering乳液,探究Zein-OSA淀粉对Pickering乳液贮存稳定性、pH值稳定性以及流变学性质等性能的影响。旨在提高Zein固体颗粒的界面性能,实现对Pickering乳液稳定性的调控,以期为Zein固体颗粒在Pickering乳液中的应用提供数据支撑。
1 材料与方法
1.1 材料与试剂
Zein、中链甘油三酯(medium chain triglycerides,MCT)上海源叶生物科技有限公司;OSA淀粉 嘉吉亚太食品系统(北京)有限公司;氯化钠、盐酸、氢氧化钠、溴化钾(均为分析纯)生工生物工程(上海)股份有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、尿素(Urea)北京索莱宝科技有限公司;8-苯氨基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)美国Sigma-Aldrich公司;实验用水由实验室超纯水机制备。
1.2 仪器与设备
N-1100D-WD旋转蒸发仪 日本EYELA公司;LGJ-20F真空冷冻干燥机 北京松源华兴科技发展有限公司;NanoSight NS300纳米颗粒跟踪分析仪 马尔文帕纳科公司;Phenom XL扫描电子显微镜 美国飞纳公司;LUMOS傅里叶变换显微红外光谱仪 德国布鲁克公司;UV-1800紫外-可见分光光度计 苏州岛津仪器有限公司;FL970型荧光分光光度计 上海天美科学仪器有限公司;Infinite M200 Pro多功能酶标仪 瑞士Tecan公司;DSA100液滴形状分析仪 德国KRUSS公司;AH100B高压均质机 加拿大ATS工程公司。
1.3 方法
1.3.1 Zein-OSA淀粉复合颗粒的制备
参考Li Songnan等[8]的反溶剂沉淀法。具体步骤如下:1.0 g Zein分散于100.0 mL的体积分数70%乙醇溶液中,磁力搅拌12 h至其完全溶解形成Zein分散液;OSA淀粉溶解于100 mL的去离子水中,沸水浴中充分糊化1 h;再将Zein分散液和OSA淀粉溶液按照质量比2∶1、1∶1、1∶2、1∶3、1∶4,于40 ℃充分混合,所得混合溶液于室温下磁力搅拌2 h后,旋转蒸发去除溶液中的乙醇,最后将pH值调为4,冷冻干燥得到不同质量比的Zein-OSA淀粉复合颗粒。
1.3.2 Zein-OSA淀粉复合颗粒Pickering乳液的制备
参考孟令莉等[9]的方法。将Zein-OSA淀粉复合颗粒均匀分散在去离子水中;将MCT作为油相并按照1∶9的油水比添加到Zein-OSA淀粉水相中,高速剪切处理后(10000 r/min,2 min),采用高压均质机在700 bar条件下重复5 次,得到均匀分散的Pickering乳液。
1.3.3 粒径和多分散性指数的测定
在25 ℃条件下,利用NanoSight NS300纳米颗粒跟踪分析仪,分别测定Zein-OSA淀粉复合颗粒及其Pickering乳液的粒径和PDI。
1.3.4 扫描电子显微镜
对Zein、OSA淀粉以及Zein-OSA淀粉复合颗粒进行喷金处理,在5 kV的加速电压下利用扫描电子显微镜获得样品的微观结构。
1.3.5 傅里叶变换红外光谱分析
参考Santos等[10]的实验方法并适当修改:将复合颗粒样品与溴化钾按照1∶100(m/m)混合并研磨成均匀粉末,再压成透明的薄片,在波数4000~400 cm-1范围内进行傅里叶变换红外光谱扫描;通过Peakfit软件对酰胺I带(1700~1600 cm-1)采用傅里叶去卷积和高斯拟合计算二级结构组成。
1.3.6 内源性荧光测定
使用荧光分光光度计测定Zein及其复合颗粒的荧光光谱。将Zein及其复合颗粒溶解在磷酸盐缓冲液(pH 7.0,10 mmol/L)中,使得蛋白质量浓度为0.02 mg/mL,设备测定条件为激发波长295 nm、发射波长300~400 nm、狭缝宽5 nm。
1.3.7 表面疏水性测定
参考董世荣等[11]的方法并适当修改。采用ANS荧光探针法,用PBS溶液(pH 7.4,10.0 mmol/L)将待测样品(Zein蛋白以及Zein-OSA淀粉)稀释至0.01~0.05 mg/mL,取4.00 mL待测样品溶液与20.0 μL ANS(8.0 mmol/L)溶液混合均匀,25 ℃反应2 min后测定其荧光强度,设定条件:激发波长390 nm,发射波长400~700 nm,表面疏水性以荧光强度和样品浓度的线性回归斜率表示。
1.3.8 三相接触角测量
参考Wang Dandi等[12]的操作步骤,25 ℃条件下,使用液滴形状分析仪测量Zein及Zein-OSA淀粉复合颗粒的接触角。将干燥的Zein及其复合颗粒样品压缩成厚度为1.0 mm,直径为10.0 mm的圆柱形薄片。精确地将5.0 μL纯水缓慢滴在薄片表面,利用相机拍摄纪录液滴的形状,利用LaPlace-Young方程下式得到Zein及其复合颗粒的三相接触角:
式中:θ为接触角;σsv、σsl、σlv分别为固-气界面张力/(mN/m)、固-液界面张力/(mN/m)以及气-液界面张力/(mN/m)。
1.3.9 解离测试
参考Ji Na等[13]的方法进行。Urea、NaCl溶液和SDS溶液分别是复合颗粒中氢键、静电相互作用和疏水相互作用的解离剂。配制Urea溶液(0、1.0、2.0、3.0、4.0 mol/L)、NaCl溶液(0、50.0、100.0、250.0、500.0 mmol/L)和SDS溶液(0、0.2、0.4、0.6、0.8、1.0 g/100 mL)。用上述3 种解离剂分别配制0.1 g/100 mL的Zein-OSA淀粉复合颗粒溶液,室温保存过夜。利用紫外-可见分光光度计测定600 nm波长处悬浮液的浊度。
1.3.10 Pickering乳液的贮存稳定性
将新鲜制备的Zein-OSA淀粉Pickering乳液在25 ℃的环境中贮存30 d,通过测定Pickering乳液的平均粒径的变化表示乳液的贮存稳定性。
1.3.11 Pickering乳液的pH值稳定性
将Zein-OSA淀粉Pickering乳液的pH值分别调节为3.0、4.0、5.0、6.0、7.0、8.0和9.0,于室温下静置6 h,使用去离子水将不同pH值的Zein-OSA淀粉Pickering乳液稀释1000 倍后按照1.3.3节方法测定乳液的平均粒径。
1.3.12 Pickering乳液的流变学性质
使用旋转流变仪分析不同质量比复合颗粒稳定的Pickering乳液的流变学性质。转子选用PP50(平行板直径为50 mm)。频率扫描:将应变设定为1%,温度为25 ℃,频率变化设定为0.1~10 Hz,测定乳液的储能模量(G’)和损耗模量(G”);剪切扫描:将应变设定为1%,温度为25 ℃,在剪切速率为1~100 s-1范围内记录乳液的表观黏度。
1.4 数据处理与分析
2 结果与分析
2.1 Zein-OSA淀粉复合颗粒的粒径、外观和微观结构
如图1a所示,随着Zein与OSA淀粉质量比的不断降低,复合颗粒的平均粒径和PDI均呈现先降低后升高的趋势,其中,当Zein与OSA淀粉质量比为2∶1时,复合颗粒粒径为756.7 nm,PDI为0.821,此时颗粒不稳定并呈现出聚集状态,并伴有沉淀现象(图1b)。当Zein与OSA淀粉质量比从2∶1降低到1∶3,复合颗粒的粒径从756.7 nm减小到163.3 nm,PDI从0.328降低到0.177,表明Zein-OSA淀粉复合颗粒随着Zein与OSA淀粉质量比的降低,粒径分布更加均匀,这可能是由于二者之间的空间位阻和静电斥力抑制了液滴的聚集[14]。当质量比为1∶4时,复合颗粒的平均粒径增加到195.0 nm,PDI也升高到0.214,可能是由于过多的OSA淀粉覆盖在Zein颗粒表面,干扰了复合颗粒的形成。质量比为1∶1~1∶4复合颗粒的PDI值均小于0.350,表明复合颗粒的分散性均匀;同时,由图1b可观测到此比例下的乳液体系均呈现相对均一、稳定的状态。

图1 Zein、OSA淀粉以及不同质量比Zein-OSA淀粉复合颗粒的粒径和PDI(a)、外观(b)和扫描电镜图(c)Fig.1 Particles size and PDI (a),visual appearance (b),and scanning electron micrographs (c) of zein,OSA starch,zein-OSA starch composite particles
如图1c所示,Zein呈现无规则的片状结构,不能形成网络结构;OSA淀粉呈现多边形和球形结构,表面凹陷,边缘较为粗糙;而Zein-OSA淀粉复合颗粒呈现光滑和平整的圆球状,且随着Zein与OSA淀粉质量比的提高,复合颗粒的颗粒分布变得更加均匀,颗粒大小也逐渐变小,说明OSA淀粉的加入会对Zein固体颗粒的形成产生影响,这可能与Zein和OSA淀粉之间的相互作用有关[15]。在Zein与OSA淀粉比例为1∶3和1∶4条件下形成的Zein-OSA淀粉复合颗粒具有较好分散性。
2.2 傅里叶变换红外光谱分析
傅里叶变换红外光谱可通过特征峰位置和强度的变化判断分子间的相互作用方式[16]。图2显示,Zein的特征峰主要出现在3323.28、2959.79、1655.96 cm-1和1537.31 cm-1,分别对应为O—H的拉伸振动、甲基的C—H的伸缩振动、酰胺I带(1600~1700 cm-1)内C=O的伸缩振动以及酰胺II带(1500~1600 cm-1)内的C—N弯曲振动与N—H弯曲振动。OSA淀粉特征峰主要出现在3413.69、2928.45、1645.29 cm-1和1020.85 cm-1,分别对应O—H的伸缩振动、亚甲基的C—H伸缩振动峰、C=O的伸缩振动以及淀粉非结晶区的特征振动[17]。与Zein相比,复合颗粒O—H伸缩振动峰由3323.28 cm-1转移到3406.25 cm-1,其吸收带的最大吸收峰波长向长波移动,表明Zein和OSA淀粉在形成复合颗粒的过程中发生氢键相互作用,因此出现了红移现象。此外,随着Zein与OSA淀粉质量比的降低,复合颗粒的特征峰在酰胺I带出现了红移现象,C=O伸缩振动峰从1655.96 cm-1移动到1658.85 cm-1;而在酰胺II带出现蓝移现象,N—H弯曲振动峰从1537.31 cm-1移动到1534.98 cm-1,说明Zein与OSA淀粉之间存在静电相互作用。值得注意的是,Zein与OSA淀粉混合后,在2928.45~2929.74 cm-1之间出现OSA淀粉亚甲基C—H伸缩振动的特征峰,在1026.02~1054.49 cm-1之间出现淀粉非结晶区的特征峰;此外,在1534.98~1536.57 cm-1之间出现属于Zein的特征峰,说明Zein与OSA淀粉发生了结合。

图2 Zein及其复合颗粒的傅里叶变换红外光谱图(a)和二级结构组成(b)Fig.2 Fourier transform infrared spectra (a) and secondary structure compositions (b) of zein and its composite particles
傅里叶变换红外 光谱中的酰胺 I 带(1600~1700 cm-1)含有丰富的蛋白质二级结构信息,常用来反映蛋白质二级结构的变化[9],如α-螺旋(1650~1600 cm-1)、β-折叠(1610~1640 cm-1)、β-转角(1660~1700 c m-1)和无规卷曲(1640~1650 cm-1)。Zein和Zein-OSA淀粉复合颗粒的二级结构组成如图2b所示。与Zein相比,复合颗粒的α-螺 旋(38 .21 %~20 .61 % )和β-转 角(36.17%~28.54%)减少;β-折叠(16.39%~36.31%)和无规卷曲(9.23%~14.54%)增加。这些二级结构的变化可能是由于Zein与OSA淀粉的相互作用导致了Zein蛋白的构象松弛[18],表明OSA淀粉一定程度可以修饰Zein的结构。
2.3 内源性荧光光谱分析
蛋白质与其他分子之间的相互作用会引起蛋白质构象或局部环境的改变,并且蛋白质分子中的内源性荧光发色基团对这些局部环境变化较为敏感,因此可通过内源性荧光表征由于分子间相互作用引起的蛋白质构象变化[19]。如图3a所示,Zein与复合颗粒在309 nm波长处出现最大吸收波长,且随着Zein与OSA淀粉质量比不断降低,复合颗粒的荧光强度逐渐降低。该结果在图3b更易观察,结果显示不同质量比的Zein与复合颗粒的荧光强度差异显著(P<0.05),且不同质量比下荧光强度由高到低依次为Zein>2∶1>1∶1>1∶2>1∶3>1∶4。这可能是由于OSA淀粉与Zein蛋白的疏水区域结合,导致了Zein中发色氨基酸残基周围环境极性升高,从而出现荧光猝灭现象[20]。内源性荧光光谱结果表明Zein与OSA淀粉之间发生了相互作用,这与傅里叶变换红外光谱的结果一致。

图3 Zein、OSA淀粉以及Zein-OSA淀粉复合颗粒的内源性荧光光谱(a)和其在309 nm波长处的荧光强度(b)Fig.3 Intrinsic fluorescence spectra (a) and fluorescence intensity at 309 nm (b) of zein,OSA starch,and zein-OSA starch composite particles
2.4 表面疏水性测定结果
Zein具有最高的表面疏水性,这是由于Zein的分子组成中超过50%的氨基酸残基为疏水性残基[21](包括约20%的亮氨酸残基、约10%的脯氨酸残基、约10%的丙氨酸残基等)。OSA淀粉由于存在亲油的辛烯基长链而具有一定的疏水性,表现出最低的表面疏水性(图4)。与Zein相比,Zein-OSA淀粉复合颗粒的表面疏水性显著降低(P<0.05),表明OSA淀粉的引入降低了Zein的疏水性。当Zein与OSA淀粉质量比从2∶1降低至1∶4,复合颗粒的表面疏水性呈明显下降趋势(P<0.05),这是由于越来越多的OSA淀粉的介入提高了复合颗粒的亲水性,另外也可能是OSA淀粉的遮蔽作用降低了荧光针与Zein表面的疏水区域结合[22]。上述表面疏水性结果表明OSA淀粉对Zein的表面亲疏水性具有一定调节作用。

图4 Zein、OSA淀粉以及Zein-OSA淀粉复合颗粒的表面疏水性Fig.4 Surface hydrophobicity of zein,OSA starch and zein-OSA composite particles
2.5 润湿性分析
润湿性是衡量固体颗粒能否稳定Pickering乳液的重要因素,一般用颗粒在油水界面的三相接触角(θ)表示[23]。一般来说,θ>90°表明固体胶体颗粒的疏水性较强,易形成油包水型(W/O)乳液;θ<90°代表固体胶体颗粒的亲水性较强,易形成水包油型(O/W)乳液;当θ=90°时说明颗粒呈现均衡的亲水亲油特性,利于其在油水界面吸附,所以一般认为θ越接近90°时,形成的Pickering乳液越稳定[24]。如图5所示,Zein的接触角为115.1°(图5a),这是由Zein含50%以上的疏水性氨基酸导致。OSA淀粉的接触角为45.6°(图5b),说明OSA淀粉亲水性较强。当Zein与OSA淀粉质量比为2∶1时,复合颗粒的接触角为55.7°(图5c),说明OSA淀粉可以提高Zein的亲水性。随着OSA淀粉浓度的不断升高,复合颗粒的接触角不断接近90°。在Zein与OSA淀粉质量比为1∶3时,Zein-OSA淀粉的接触角为87.4°(图5f),此时最接近90°,有利于形成稳定的界面屏障以形成具有优良特性的Pickering乳液。润湿性分析结果表明OSA淀粉可以通过调节Zein的接触角改善其Pickering乳液的稳定性。

图5 Zein、OSA淀粉以及Zein-OSA淀粉复合颗粒的接触角Fig.5 Contact angles of zein,OSA starch,and zein-OSA starch composite particles
2.6 分子间相互作用力分析
分子之间的非共价相互作用力(疏水相互作用力、氢键和静电相互作用力)的定性和定量测定可通过向分子体系内加入解离剂,测定解离后溶液体系的浊度表征[25]。SDS、Urea和NaCl分别为表征疏水相互作用力、氢键和静电相互作用力的解离剂,复合胶体颗粒形成和稳定过程中涉及的分子间相互作用力可以通过在不同解离液中的浊度变化表征。Zein-OSA淀粉复合颗粒在不同浓度的解离液中的浊度变化如图6所示,不同解离液中复合颗粒的浊度大小均呈降低的趋势,但不同解离液的变化略有差异,表明Zein和OSA淀粉之间相互作用力的强弱。在解离剂SDS中(图6a),复合颗粒浊度下降的趋势最为显著(P<0.05),随着SDS质量浓度的不断升高,复合颗粒的浊度从0.435降低到0.054;在解离剂Urea中(图6b),随着Urea浓度增大,复合颗粒的浊度从0.458降低到0.259;在解离剂NaCl中(图6c),复合颗粒浊度的下降趋势较为平缓,复合颗粒的浊度从0.455降低到0.374。上述结果表明,Zein-OSA淀粉复合颗粒浊度降低的趋势为:SDS>Urea>NaCl,表明Zein-OSA淀粉复合颗粒中参与的相互作用力强弱顺序为:疏水相互作用>氢键作用>静电相互作用。该结果表明疏水相互作用和氢键作用在Zein-OSA淀粉复合颗粒的形成和稳定过程中为主要的驱动力,静电相互作用也起到一定作用,但作用效果不显著。本研究结果与Li Songnan等[8]的研究结果一致,即氢键、疏水相互作用和静电相互作用是Zein和藜麦淀粉形成复合颗粒的重要分子间相互作用力。

图6 解离剂对Zein-OSA淀粉复合颗粒悬浮液浊度的影响Fig.6 Influence of different dissociating solvents on the turbidity of zein-OSA starch complex nanoparticle dispersions
2.7 Pickering乳液的粒径分布
粒径分布可以反映Pickering乳液的均匀程度,粒径分布范围越集中,表明Pickering乳液的均匀度越高[26]。如图7所示,当Zein与OSA淀粉质量比为2∶1时,乳液的粒径分布为多峰,粒径范围为191.05~522.43 nm,推测是由于颗粒浓度不足以覆盖油水界面,导致液滴的聚集[27]。随着Zein与OSA淀粉质量比从2∶1降低到1∶2,乳液的粒径分布从多峰转变成单峰。Ding Mengzhen等[28]研究表明乳液液滴的尺寸可能随着固体颗粒浓度的增加而减小。Zein与OSA淀粉质量比为1∶3时,Pickering乳液具有最小的粒径(104.91~245.90 nm),且乳液的粒径分布最窄,表明该质量比下形成的Pickering乳液液滴最均匀,原因可能是由于复合颗粒在油水界面处充分吸附,形成了界面层,有效防止了乳液液滴的聚集[29]。值得注意的是,当Zein与OSA淀粉质量比降低到1∶4,Pickering乳液的平均粒径有所增大,且粒径分布呈现双峰,可能是由于OSA淀粉过多,干扰了复合颗粒的形成,使得复合颗粒对液滴的包裹性减弱,最后导致了乳液的聚集。综合前面傅里叶变换红外光谱和荧光光谱的实验结果,可以推断出:OSA淀粉可以通过修饰Zein的结构,促进Zein颗粒在油水界面上有效吸附,以提高Pickering乳液的稳定性。
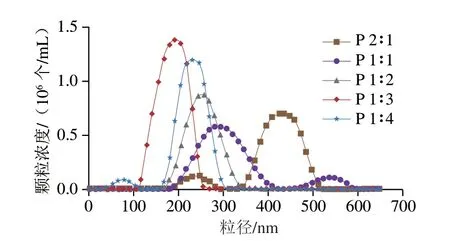
图7 Pickering乳液的粒径分布Fig.7 Particle size distribution of Pickering emulsions
2.8 Pickering乳液的贮存稳定性
Pickering乳液通常会随着贮藏时间的延长发生絮凝、聚结等失稳现象,导致乳液液滴粒径的增大,降低Pickering乳液的品质和性能[9]。Zein-OSA淀粉Pickering乳液在25 ℃贮存30 d后,乳液的平均粒径有不同程度的改变(图8a),其中,质量比为2∶1的Pickering乳液的平均粒径由421.33 nm升高到702.67 nm,差异显著(P<0.05);同时,从乳液的外观上看,该乳液在贮存30 d后出现相分离现象(图8c)。质量比为1∶1的Pickering乳液的平均粒径由292.67 nm增长到373.74 nm,差异较显著(P<0.05)。Zein与OSA淀粉质量比为1∶2、1∶3和1∶4的Pickering乳液经贮存30 d后粒径的变化不明显,其平均粒径分别增长到277.05、199.72、234.53 nm,从宏观上看,它们均没有出现絮凝和聚集现象,具有相对均一的状态,说明质量比为1∶2~1∶4的Zein-OSA淀粉Pickering乳液具有良好的贮存稳定性。该结果表明可通过调节Zein与OSA淀粉的质量可抑制Pickering乳液的聚结。

图8 Pickering乳液平均粒径(a)以及Pickering乳液在贮存0(b)、30 d(c)的外观Fig.8 Mean particles size of Pickering emulsion (a),and appearance of Pickering emulsion at days 0 (b),and 30 (c) of storage
2.9 Pickering乳液的pH值稳定性
流体食品在加工过程中通常会涉及到不同的pH值处理,因此有必要探究Zein-OSA淀粉Pickering乳液在不同pH值下的稳定性。如图9所示,不同质量比下的所有Zein-OSA淀粉Pickering乳液在pH值为4.0下均表现出最小平均粒径。在pH值为5.0和6.0时,平均粒径明显增大,这是由于该pH范围接近Zein的等电点(等电点pI为5.6),因此容易发生沉聚。当pH<pI,Zein分子表面带正电荷,此时,带负电荷的OSA淀粉会利用静电相互作用吸附在Zein表面,对Zein起到界面修饰的作用;同时,OSA淀粉所带的负电荷和其侧链可以提供静电斥力和空间位阻,抑制Pickering乳液中液滴的聚集和絮凝。随着Zein与OSA淀粉质量比的降低,Pickering乳液平均粒径随pH变动的幅度越来越小。当Zein与OSA淀粉质量比低于1∶1时,Pickering乳液的平均粒径均小于300 nm,且变化不明显,因此,Zein-OSA淀粉Pickering乳液具有良好的pH值稳定性。

图9 Pickering乳液在不同pH值的平均粒径Fig.9 Mean particle sizes of Pickering emulsions at different pH values
2.10 Pickering乳液的流变学性质
对不同复合颗粒稳定的Pickering乳液进行动态黏弹性分析,结果如图10a所示。随着剪切频率的增加,G’均大于G”,G’和G”分别代表Pickering乳液的弹性和黏性,即表明Zein-OSA淀粉Pickering乳液具有弹性的凝胶状结构。在Zein与OSA淀粉质量比为1∶3时,Pickering乳液具有最高的G’和G”,表明1∶3的乳液具有更强的三维网络结构和更高的稳定性,可能是由于固体颗粒层形成的物理屏障可以防止乳液液滴的聚集,在弹性和黏性越高的乳液体系中,液滴的沉降速度越慢,Pickering乳液的稳定性更强[30]。图10b显示,Pickering乳液的表观黏度均随着剪切频率的增大而减小,呈现出典型的剪切稀化现象,表明Zein-OSA淀粉复合颗粒稳定的Pickering乳液为非牛顿流体,这与葛思彤等[16]的研究结果一致。乳液的表观黏度随着OSA淀粉使用量的升高不断增大,在Zein与OSA淀粉质量比为1∶3时具有最高的表观黏度,可能是因为质量比为1∶3的复合颗粒具有最稳定的网络结构,对Pickering乳液的液滴具有稳定作用,从而增强了在乳液体系中的抗剪切作用力,提高了乳液的黏度。
3 结论
为改善Zein的疏水特性,本实验利用OSA淀粉修饰Zein,并通过反溶剂沉淀法制备Zein-OSA淀粉复合颗粒。结果表明OSA淀粉可通过静电相互作用、氢键作用和疏水相互作用与Zein形成复合颗粒。OSA淀粉的引入增加了Zein的亲水性,当Zein与OSA淀粉质量比从2∶1降低到1∶3时,复合颗粒的平均粒径逐渐减小,接触角变大,证明OSA淀粉可对Zein的表面性质进行调控。此外,OSA淀粉可以通过修饰Zein的结构,促进Zein颗粒在油水界面上有效吸附,以提高Pickering乳液的稳定性。Zein与OSA淀粉质量比为1∶3的复合颗粒形成的Pickering乳液具有良好的贮存稳定性、pH值稳定性和流变学性质,表明OSA淀粉可以有效对Zein进行修饰,形成界面屏障以制备均一、稳定的Pickering乳液。本研究为Zein-OSA淀粉复合颗粒的开发提供了理论依据;同时,Zein-OSA淀粉稳定的Pickering乳液对于开展对药物、活性功能因子等营养素的负载,拓宽可食性Pickering乳液在传递系统中的实际应用具有积极意义。
