上海地区9种新型冠状病毒核酸检测试剂盲样检测结果一致性分析
2023-11-07蒋玲丽胡晓波
杨 雪 朱 俊 蒋玲丽 王 青 胡晓波
(上海市临床检验中心,上海 100126)
新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)为β属冠状病毒,有包膜,形状为圆形或椭圆形,是单股正链RNA病毒。实验室检测包括抗原检测和核酸检测。核酸检测具有较高的灵敏度和特异性,是诊断SARS-CoV-2感染的“金标准”。SARS-CoV-2核酸检测主要针对病毒的OFR1ab基因(编码RNA聚合酶,可参与病毒核酸复制)、N基因(编码核壳蛋白,与病毒基因组宿主RNA相互识别)和E基因(编码囊膜蛋白,与病毒包膜和病毒颗粒形成有关)。
SARS-CoV-2核酸检测结果的假阳性和假阴性一直备受关注[1-2]。造成结果假阳性/假阴性的原因可能是样本采集、运输过程中的不恰当处理,也可能是实验室内部不规范的操作。循环阈值(cycle threshold,Ct)是判断检测结果的重要标准。本研究对上海市临床检验中心组织的全市SARS-CoV-2核酸检测实验室4次盲样检测结果进行分析,重点分析不同品牌SARSCoV-2核酸检测试剂检测结果Ct值的一致性和不同品牌检测试剂的检测性能,旨在及时掌握上海市SARS-CoV-2核酸检测质量,以确保类似场景下临床实验室能够快速反应,且检测结果一致、可靠。
1 材料和方法
1.1 盲样样品
盲样样品为经处理的SARS-CoV-2 RNA(含胍盐)样本,600 μL/支,每套5支,包括阴性样品2支和阳性样品3支。阳性样品浓度分别为1.00×103拷贝/mL(浓度1)、1.75×103拷贝/mL(浓度2)和3.5×103拷贝/mL(浓度3);2支阴性样品为样本保存液稀释的体外培养人体细胞。
1.2 样品发放和检测
每周将盲样通过冷链随机发放至上海市所属SARS-CoV-2核酸检测实验室:第1次发放至230个实验室,第2次发放至233个实验室,第3次发放至234个实验室,第4次发放至230个实验室,合计927套。实验室在规定时间内按要求储存、复融、混匀、离心、检测,并上传检测结果。
1.3 检测试剂
盲样共涉及9种SARS-CoV-2核酸检测试剂,分别编号为A、B、C、D、E、F、G、H、I。
1.4 统计学方法
采用SPSS 26.0软件进行统计分析。分析盲样检测结果与预期结果的一致性,计算阳性样品ORF1ab基因和N基因Ct值的x、中位数(M)、95%可信区间(confidence interval,CI)、极差(R)和变异系数(coefficient of variation,CV),根据拉依达准则(3σ准则)剔除离群值。由于D和G试剂结果判读时各有10和5个Ct值不计数,因此在结果比较时分别加10个和5个Ct值进行校准。采用Kruskal-Wallis秩和检验对9种试剂的检测结果进行组间比较。以P<0.05为差异有统计学意义。
2 结果
2.1 参评实验室基本情况
参与4次盲样检查的实验室共249个,其中公立医疗机构实验室108个,社会办医疗机构实验室6个,医学检验实验室132个,其他类型实验室3个。
2.2 9种试剂基本情况
9种试剂均采用逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)对靶基因进行检测。有2种试剂(C和G)检测靶基因为ORF1ab、N和E基因,其余7种试剂检测靶基因均为ORF1ab和N基因。9种试剂检出限为200~500拷贝/mL。见表1。
2.3 参评实验室检测结果总体情况
249个实验室均检出3个阳性盲样的全部靶基因,检出率均为100%,2个阴性盲样检测符合率均为100%。3个阳性盲样ORF1ab基因检测Ct值的CV分别为4.32%(浓度1)、4.42%(浓度2)、4.43%(浓度3);N基因检测Ct值的CV分别为4.32%(浓度1)、4.46%(浓度2)、4.54%(浓度3);ORF1ab基因和N基因Ct值的极差(R)值分别为8.15和7.73(浓度1)、8.07和7.71(浓度2)、7.98和7.52(浓度3)。各实验 室检测结果Ct值见图1。
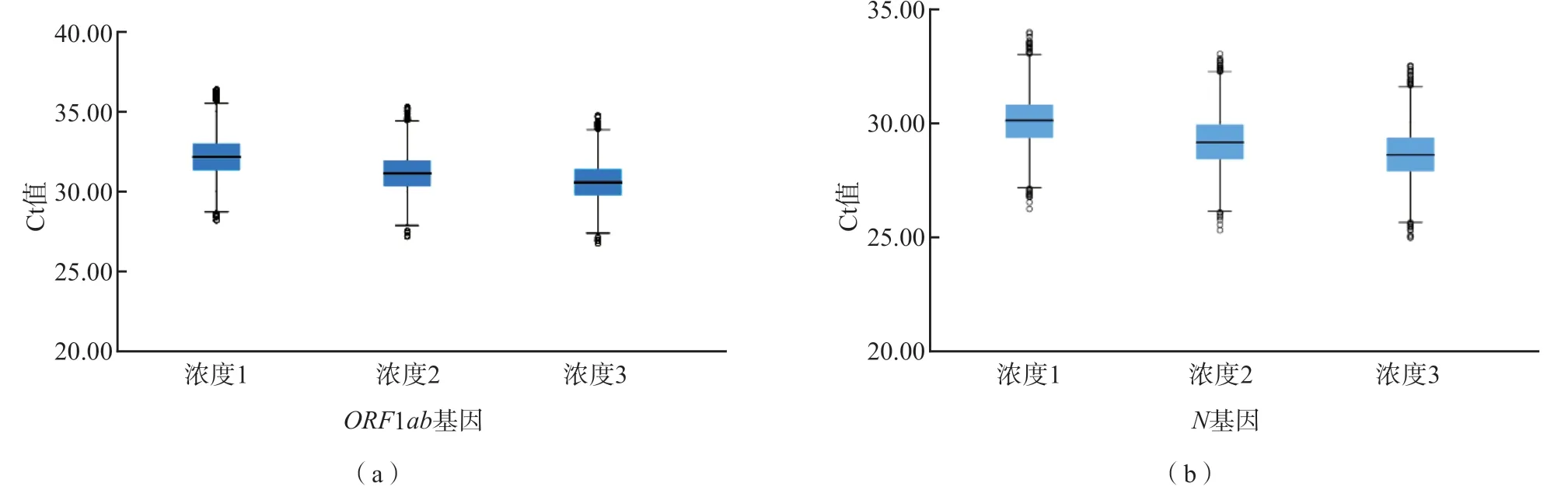
图1 3个浓度阳性盲样ORF1ab基因和N基因Ct值分布
2.4 9种试剂Ct值波动情况
3个浓度阳性盲样9种试剂间ORF1ab基因和N基因Ct值的差异范围分别为2.58~2.66和2.88~3.06。9种试剂3个浓度阳性盲样ORF1ab基因和N基因Ct值比较,差异均有统计学意义(P<0.001)。不同试剂组两两比较结果显示,D试剂ORF1ab基因和N基因检测结果与其他8种试剂差异有统计学意义。经Bonferroni校正后,D试剂与A、B、C、H、I、F、G试剂比较,ORF1ab基因浓度1、浓度2和浓度3差异均有统计学意义(P<0.05),D试剂与A、B、C、E、F、G、H、I试剂比较,N基因浓度1、浓度2和浓度3差异均有统计学意义(P<0.05)。A试剂和H试剂ORF1ab基因检测结果差异无统计学意义(P>0.05),A试剂和H试剂与其他8种试剂比较,ORF1ab基因检测结果差异均有统计学意义。经Bonferroni校正后,A试剂与B、C、D、E、F、G、I试剂比较,H试剂与B、C、D、E、G、I试剂比较,ORF1ab基因浓度1、浓度2和浓度3差异均有统计学意义(P<0.05)。D试剂的ORF1ab基因和N基因检测结果Ct值较高,A试剂和H试剂ORF1ab基因检测结果Ct值较低。
9种试剂组内ORF1ab基因和N基因Ct值极差(R)的差异范围分别为4.37~7.94和4.11~7.21。A、B、C、E、F和I这6种试剂组内实验室间ORF1ab基因和N基因Ct值的CV均<5%。D试剂组内ORF1ab基因检测结果极差(R)和CV均较大。见表2、表3。
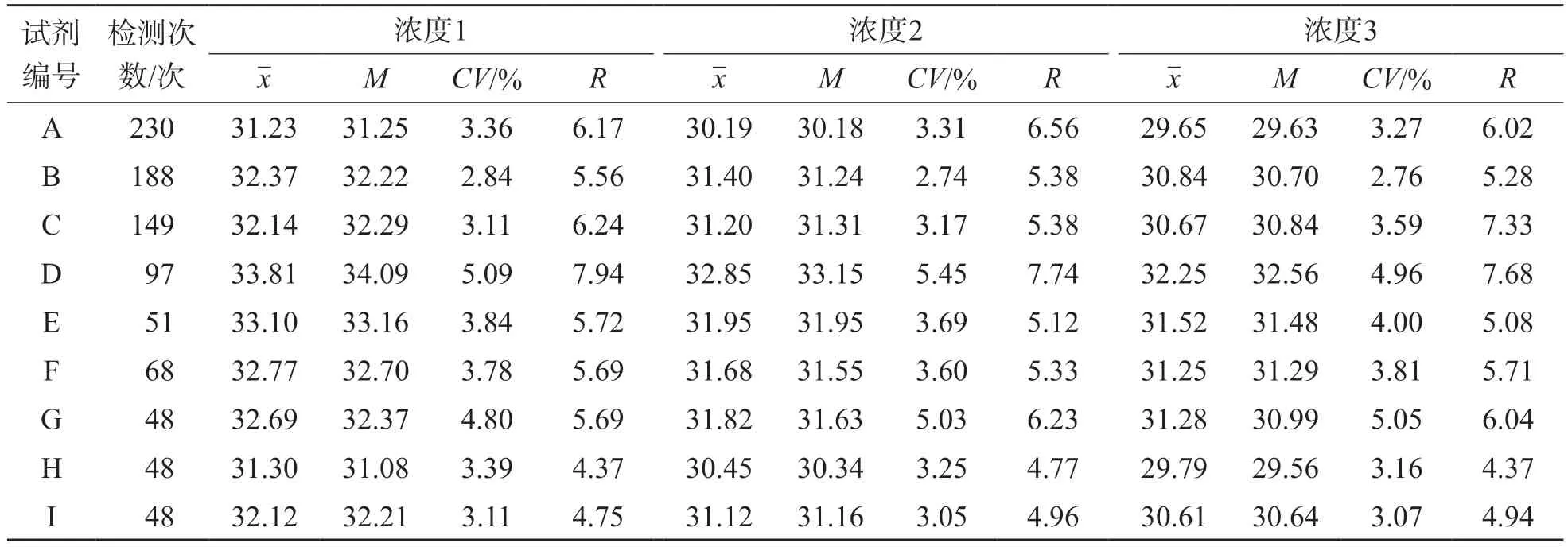
表2 9种试剂3个浓度阳性盲样ORF1ab基因Ct值波动情况
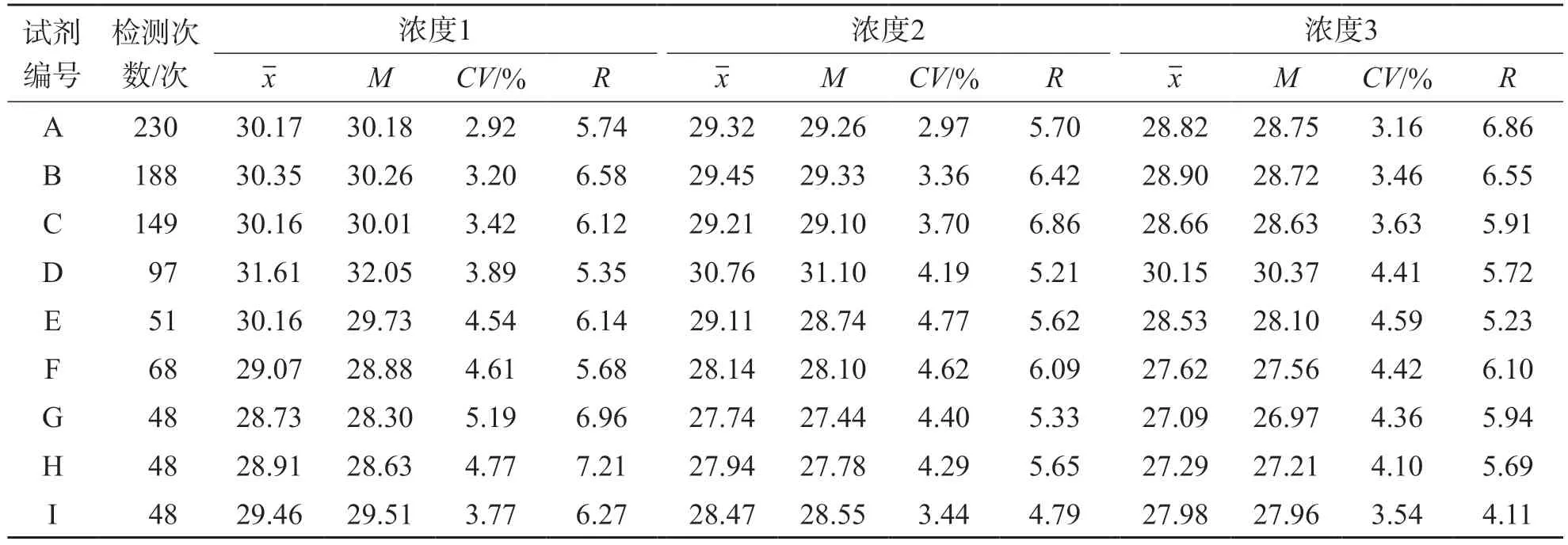
表3 9种试剂3个浓度阳性盲样N基因Ct值波动情况
3 讨论
2022年3月末,上海地区新型冠状病毒肺炎疫情暴发,上海地区SARS-CoV-2核酸检测量与日俱增,屡创新高。为确保实验室检测结果正确、可靠,上海市临床检验中心通过盲样方式开展室间质量评价,同时将检查频次从每月1次增加为每周1次。4次SARS-CoV-2盲样检查结果显示,上海地区SARS-CoV-2核酸检测实验室主要使用9种检测试剂,均采用RT-PCR方法,最低检出限均能达到500 拷贝/mL,符合《医疗机构新型冠状病毒核酸检测工作手册(试行第二版)》[3]工作要求。2种阴性样品和3种阳性样品的盲样检测结果的正确率均为100%,说明实验室SARS-CoV-2核酸检测能力可满足防疫要求。
基于SARS-CoV-2核酸检测结果的不同用途(筛查、疗效监测、出院或出舱判断),实验室除按试剂盒说明书要求报告阳性和阴性结果外,必要时还需同时上报阳性结果Ct值。Ct值的高低对应不同的病毒载量。有研究结果显示,Ct值每增加3,病毒载量降低1个数量级,Ct值分别为12和33时,对应的病毒载量分别为2.2×106pfu/mL和15 pfu/mL[4]。本研究中使用了3个浓度阳性盲样,每个浓度盲样ORF1ab基因和N基因实验室检测结果Ct值的CV均<5%,但R值可达8。不同实验室检测结果Ct值差异大提示应先对SARS-CoV-2核酸检测结果进行标准化和一致化的管理,再将结果用于临床病毒载量的判断。各浓度盲样N基因的Ct值均低于ORF1ab基因,与临床实际检测结果相符,原因可能为SARSCoV-2核酸在转录时会形成不同长度的mRNA片段,这些片段中均含有N基因,只有少数mRNA片段含ORF1ab基因。
本研究结果显示,9种试剂同一浓度盲样检测结果Ct值存在一定差异。9种试剂检测3个浓度阳性盲样时,ORF1ab基因和N基因Ct值的差异范围分别为2.58~2.66和2.88~3.06。原因可能是不同试剂引物和探针设计原理和对靶基因的检测能力存在一定差异[5]。有研究结果显示,核酸检测试剂盒的批间差异较大,这个问题应引起重视[6-8]。本研究9种试剂说明书中对不精密度的要求是5%,以此为标准,A、B、C、E、F和I这6种试剂组内实验室间ORF1ab基因和N基因Ct值的CV均满足要求,但不同检测试剂组内ORF1ab基因和N基因Ct值仍存在较大差异,R值差异范围分别为4.37~7.94和4.11~7.21。原因可能是核酸提取方式、检测系统的分析性能差异、扩增仪器差异、定量阈值限设置不同[9]。有研究结果显示,SARS-Cov-2核酸检测假阳性结果主要出现在浓度较低的样本中[10]。因此,建议实验室在更换试剂批号时,对试剂批间差进行验证,尤其应关注弱阳性样本的检测结果。
SARS-CoV-2核酸检测结果出现假阳性/假阴性时,除应关注检验过程中的因素外,还应关注检验前阶段样本质量问题。样本采集方法、采集部位、采样管、样本量、运输时间、感染后样本采集时机等检验前环节都会影响样本病毒载量,进而影响Ct值[4]。当病毒载量较高(Ct值较小)时,阳性结果易被检出。假阴性结果易出现在样本病毒载量较低时,此时需使用弱阳性样品来监测实验室检测能力。不同SARSCoV-2核酸检测试剂的效能不同,尤其对弱阳性样本而言,检测结果差异更加明显[11]。弱阳性样本浓度一般为试剂检出限的1.5~3.0倍,本研究中仅浓度1(标准值为1.00×103拷贝/mL)盲样对检出限为500、350和300 拷贝/mL的试剂而言满足要求,这也是9种试剂阳性检出率较高的原因。为加强实验室对弱阳性样本的检验能力,后期盲样设计中应准备更低浓度的样品。本研究使用的盲样未能监控到检验前环节,结果仅能说明实验室内的检测能力。
Ct值与SARS-CoV-2病毒载量密切相关,病毒载量越大,Ct值越低。Ct值为20可提示高传染性,Ct值为33~35可提示低传染性[4]。然而,Ct值易受到样本采集方法、样本类型、运输介质类型、样本采集到检测前时间、样本采集时感染情况、不同检测方法内和检测方法间的差异等因素的影响。本研究结果显示,不同检测试剂Ct值差异较大,因此对检测结果阳性且Ct值较高(接近临界值),或检测结果阴性但刚超出试剂说明书判读标准时,实验室应进行复核,同时使用阴性和弱阳性质控品进行结果监测;有条件的情况下,建议再次采集样本以核实检测结果。需要注意的是,此方式仅对避免假阳性结果有帮助,对判断感染病程帮助不大(如无症状感染、症状出现前的感染)[12]。
综上所述,上海地区SARS-CoV-2核酸检测实验室检测能力均能达到要求,但不同品牌检测试剂Ct值实验室间差异较大,依据Ct值判读结果可能会产生假阴性或假阳性结果,应引起实验室和相关机构重视。
