扩展性无创产前筛查技术在染色体拷贝数变异检测中的临床应用效果评价
2023-11-07张庆华梁济慈贾春暘蔺朋武朱韶华郝胜菊
冯 暄 张庆华 王 兴 何 静 梁济慈 贾春暘 蔺朋武 朱韶华 郝胜菊
(甘肃省医学遗传中心 甘肃省出生缺陷与罕见病临床研究中心 甘肃省妇幼保健院,甘肃 兰州 730050)
目前,利用无创产前基因检测(non-invasive prenatal testing,NIPT)技术检测胎儿染色体非整倍体异常已成为临床产前筛查的重要方法。1997年,LO等[1]首次报道在孕妇血液中含有胎儿游离DNA(cell-free fatal DNA,cffDNA)片段,使得基于cffDNA筛查胎儿染色体非整倍体成为可能。随着测序技术的进一步发展,检测染色体微缺失/微重复的扩展性无创产前筛查技术(expanded non-invasive prenatal testing,NIPT-plus)被引入新生儿筛查实验室[2]。染色体的微缺失/微重复又称为拷贝数变异(copy number variation,CNV),其临床发生率为1.6%~1.7%,高于唐氏综合征,且与孕妇年龄无关,可导致染色体微缺失/微重复综合征(<5 Mb),可能造成患儿身体不同程度残疾、生长发育迟缓或智力受损等,患儿可长期存活,且大多有生育能力[3]。在全部出生缺陷中,约有19%的先天性缺陷是由染色体异常导致的,其中CNV是重要的致病因素[4]。由于染色体微陈列分析(chromosomal microarray analysis,CMA)检测成本较高,大部分患者仅选择传统的羊水核型分析,造成大量携带CNV的胎儿漏检。因此,评估NIPT-plus筛查染色体微缺失/微重复的临床效能具有重要的意义。本研究拟对NIPT-plus筛查高风险的孕妇采用介入性产前诊断[低深度全基因组测序(copy number variation sequencing,CNVseq)和染色体核型分析]确诊,以明确NIPT-plus的检测效能,探讨NIPT-plus在筛查胎儿染色体微缺失/微重复中的价值。
1 材料和方法
1.1 研究对象
选取2017—2018年在甘肃省妇幼保健院医学遗传中心进行NIPT-plus检测的孕妇10 187例,年龄(31.71±5.0)岁,孕周(18.0±3.6)周。纳入标准:1)血清学产前筛查示21-三体综合征、18-三体综合征高风险或临界风险;2)高龄妊娠(预产年龄≥35岁);3)B超软指标异常;4)错过唐氏综合征筛查(简称唐筛)检测时间;5)因其他原因要求行NIPT。排除标准:1)双胎或多胎妊娠;2)1年内接受过异体输血;3)1年内接受过免疫治疗、移植手术、干细胞治疗;4)孕期患有实体肿瘤;5)采血当日体重>100 kg。本研究通过甘肃省妇幼保健院伦理委员会批准(2018院伦审研第30号),所有研究对象均知情同意,NIPT结果提示高风险的孕妇进行遗传咨询并告知相关风险后签署侵入性产前诊断知情同意书。
1.2 方法
1.2.1 试剂与仪器
血浆游离DNA提取试剂盒(磁珠法)、高通量测序文库构建DNA纯化试剂盒和无创胎儿染色体非整倍体(T13/T18/T21)检测试剂盒均购自杭州贝瑞和康公司。文库定量检测试剂盒(美国KAPA公司),T100 PCR仪(美国伯乐公司),Stepone plus荧光定量PCR仪(美国Life Technologies公司),NextSeq CN500高通量测序仪(美国Illumina公司)。
1.2.2 NIPT-plus检测
采集所有研究对象外周血10 mL,乙二胺四乙酸抗凝,采用两步离心法去除残余白细胞和细胞碎片。采用血浆游离DNA提取试剂盒提取cffDNA,cffDNA浓度应>3%。通过DNA末端修复、通用测序引物和样本识别标签连接、文库构建产物纯化的方法进行文库构建,构建后的文库浓度>0.2 ng/mg。将混合的文库在NextSeq CN500高通量测序平台上进行测序,测序数据与人类参考基因组hg19序列进行比对,根据RUPA快速分析流程(杭州贝瑞和康公司),检测胎儿染色体CNV。
1.2.3 羊水采集和染色体核型分析
在B超引导下行羊膜腔穿刺术,羊水样本送细胞遗传实验室,按标准操作方法和步骤进行细胞培养,采用原位收获法收获染色体,G显带,在显微镜下进行染色体核型分析。
1.2.4 羊水CNV-seq检测
按照样本DNA提取试剂盒的标准操作流程提取羊水样本DNA,对获得的DNA进行纯化。按照染色体拷贝数变异检测试剂盒的标准操作流程,打断DNA,末端修复,加入polyA和特定接头,纯化。采用NextSeq CN500 高通量测序仪对纯化、质检后的DNA文库进行测序。采用科诺安数据分析系统对测序数据进行序列比对和分析,获得目标染色体的Z值和全部>100 kb 的染色体拷贝数变异。
1.2.5 外周血CNV-seq检测
采集所有NIPT-plus高风险孕妇的静脉血,进行CNV-seq检测(检测方法同羊水CNVseq),以验证是否为母体CNV异常导致NIPTplus结果假阳性。
1.2.6 生物信息学分析
测序所得的读长与人类参考基因组hgl9序列进行比对。通过检索Decipher数据库、在线人类孟德尔遗传数据库(Online Mendelian Inheritance in Man,OMIM)、PubMed数据库和UCSC基因组浏览器、Clinvar数据库,对检测到的CNV的致病性进行评估。参照美国医学遗传学和基因组学学会(American College of Medical Genetics and Genomics,ACMG)指南,将检出的CNV分为5个级别:明确致病性、可能致病性、临床意义未明、良性、可能良性。
1.2.7 随访
采用电话随访方式对所有受检孕妇随访至分娩后3个月,随访内容包括产前诊断情况、孕期产检监测结果、妊娠结局和新生儿出生缺陷情况。
1.3 统计学方法
采用SPSS 20.0软件进行统计分析。采用线性相关分析评估CNV发生与孕妇年龄的关系,以P<0.05为差异有统计学意义。
2 结果
2.1 10 187例孕妇一般资料分析
10 187例孕妇中,有76例(0.75%)因血浆cffDNA浓度不达标而重新采样。采用NIPTplus从10 187例孕妇中筛查出高风险孕妇164例(1.61%),其余10 023例孕妇为NIPT-plus低风险。10 187例孕妇一般资料和NIPT-plus高风险孕妇分布见表1。
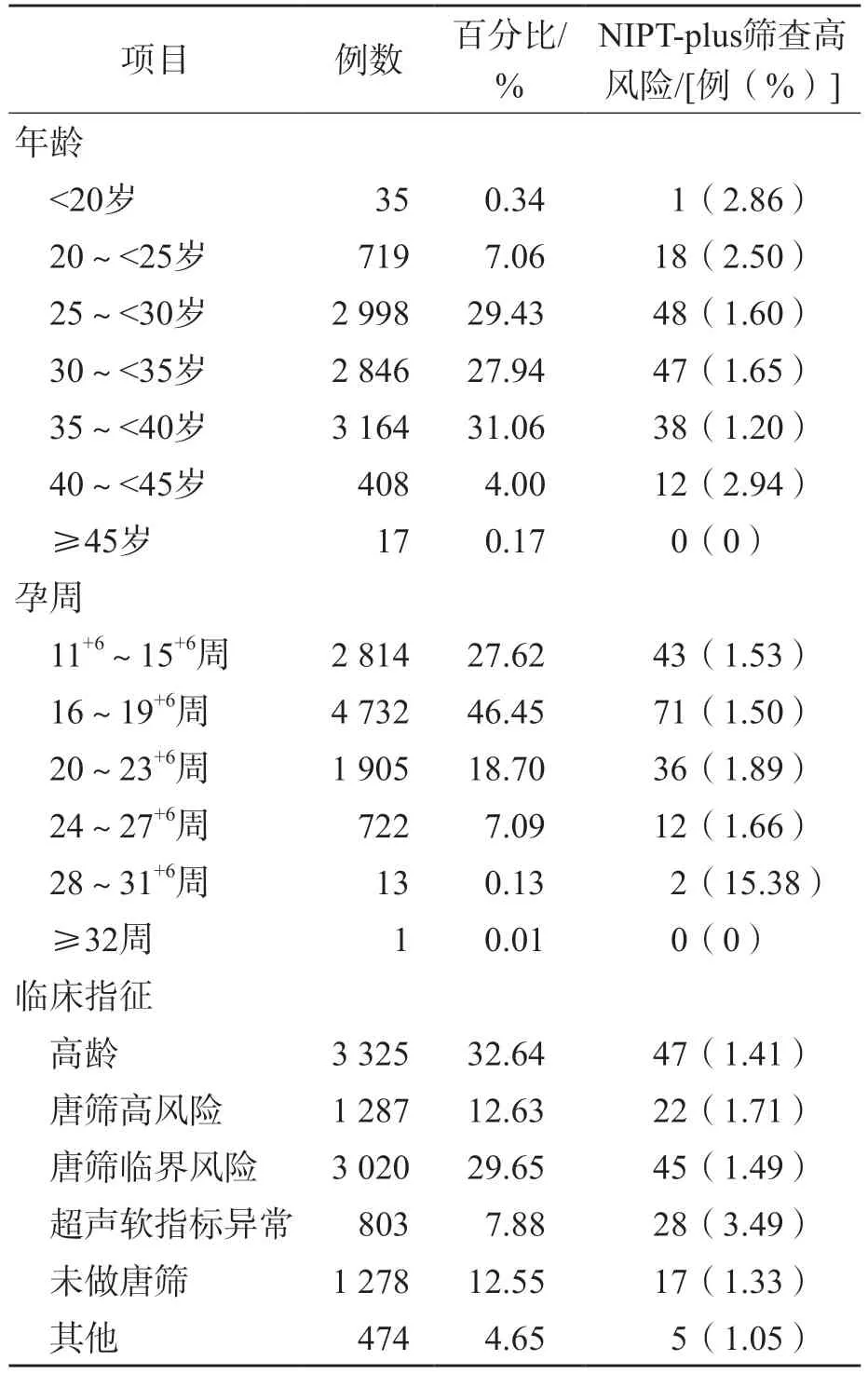
表1 10 187例孕妇一般资料和NIPT-plus高风险孕妇分布
2.2 NIPT-plus高风险孕妇筛查结果
164例NIPT-plus高风险孕妇中,21-三体综合征高风险32例、18-三体综合征高风险11例、13-三体综合征高风险9例、47,XXX高风险14例、47,XXY高风险10例、47,XYY高风险5例、45,XO高风险47例、CNV高风险33例。
2.3 NIPT-plus高风险孕妇羊水样本CNV-seq检测结果
164例NIPT-plus高风险孕妇中,有131例接受CNV-seq检测,共确诊59例,假阳性72例(0.71%,72/10 187)。NIPT-plus筛查21-三体综合征、18-三体综合征、13-三体综合征的阳性预测值分别为91.67%、71.43%、25.00%,筛查性染色体非整倍体异常和CNV的阳性预测值分别为27.87%、39.40%。见表2。

表2 164例NIPT-plus高风险孕妇CNV-seq检测结果
2.4 NIPT-plus对CNV的检出率
164例NIPT-plus高风险孕妇中,胎儿染色体CNV异常33例,CNV-seq确诊13例,假阳性15例,其中有5例(病例1、12、13、17、22)由于母体CNV异常而导致假阳性。33例胎儿染色体CNV异常孕妇诊断结果见表3。

表3 33例胎儿染色体CNV异常孕妇诊断结果
2.5 NIPT-plus检测染色体非整倍体异常和CNV的性能
NIPT-plus筛查胎儿21-三体综合征、18-三体综合征和13-三体综合征的阳性预测值分别为91.67%、71.43%和25.00%,特异性分别为99.98%、99.98%、99.94%,敏感性均为100.00%。
对于性染色体非整倍体异常,NIPT-plus筛查超雄综合征(47,XXY)的阳性预测值、敏感性和特异性均为100.00%;筛查超雌综合征(47,XXX)和克氏综合征(47,XXY)的阳性预测值均为44.44%,敏感性为100.00%,特异性为99.95%;筛查特纳综合征的阳性预测值最低(12.50%),假阳性率为0.34%,敏感性为100.00%,特异性为99.66%。对于染色体拷贝数变异,NIPT-plus筛查5~10 Mb缺失/重复的阳性预测值、敏感性和特异性均为100.00%;筛查>10 Mb的缺失/重复的阳性预测值为62.50%,敏感性为100.00%,特异性为99.97%;筛查<5 Mb的缺失/重复的阳性预测值为42.86%,敏感性为90.00%,特异性为99.88%。见表4。

表4 NIPT-plus检测CNV的性能
2.6 NIPT-plus筛查不同年龄孕妇CNV的效能
CNV的发生与孕妇年龄无线性关系(P>0.05)。孕妇年龄对NIPT-plus筛查CNV的阳性预测值、特异性、敏感性均无影响。见表5。

表5 NIPT-plus筛查不同年龄孕妇CNV的效能
2.7 随访结果
2.7.1 NIPT-plus高风险和低风险孕妇随访结果
10 023例NIPT-plus低风险孕妇中,成功完成随访8 810例,随访有效率为87.9%,其中8 685例孕妇顺利分娩,新生儿各项体检指标均正常;另125例因后期超声检查发现胎儿畸形或因死胎而引产。164例NIPT-plus高风险孕妇中,有131例行产前诊断,最终确诊阳性59例,其中11例分娩(5例确诊为胎儿性染色体非整倍体异常、6例确诊为胎儿CNV异常)后,新生儿未发现无明显异常;4例确诊为胎儿性染色体非整倍体异常的孕妇发生孕中期流产;其余44例阳性孕妇均选择终止妊娠。
2.7.2 拒绝或未行介入性产前诊断孕妇的随访结果
164例NIPT-plus高风险孕妇中,有33例拒绝或未行介入性产前诊断。随访结果显示,13例提示21-三体综合征、18-三体综合征、13-三体综合征高风险孕妇中,有4例自然流产,5例直接引产,4例拒绝随访;15例提示性染色体非整倍体异常高风险的孕妇中,有9例继续妊娠,分娩后新生儿未行染色体核型分析,家属自述未见明显异常,2例直接引产,4例拒绝随访;5例提示CNV异常高风险的孕妇中,有1例NIPT-plus结果与孕妇本人染色体结果一致,继续妊娠,分娩后新生儿无明显异常,1例直接引产,3例拒绝随访。
3 讨论
近年来,随着遗传学检测技术水平的不断提高和人类基因组数据库信息的不断更新和完善,染色体CNV的临床意义得以被证实。NIPT凭借其高阳性预测值、高敏感性和高特异性等优势,已成为筛查21-三体综合征、18-三体综合征、13-三体综合征的常规技术。除了染色体数目异常之外,致病性拷贝数变异(pathogenic copy number variant,pCNV)也是出生缺陷重要的遗传学因素。有研究结果显示,胎儿携带pCNV的比例可高达1.6%~1.7%,远高于21-三体综合征(0.5%~0.6%)[5-6]。因此,开展无创pCNV筛查对预防出生缺陷有重要意义。
除21-三体综合征、18-三体综合征、13-三体综合征外,NIPT-plus还可筛查出其他常染色体异常、性染色体异常和pCNV的高风险孕妇[2,7-8]。有研究结果显示,对于片段>6 Mb的pCNV,NIPT-plus的筛查效率可达83.0%~90.9%[9-10],且随着cffDNA浓度的富集、测序深度的增加和生物信息学分析流程的进一步优化,对如DiGeorge综合征等3 Mb左右小片段的pCNV的筛查阳性预测值可达92.9%[2]。美国医学遗传学会、国际产前诊断协会均指出,在做好知情同意,明确待检测pCNV的检出率、特异性、阳性预测值、阴性预测值等指标的前提下,可以针对临床意义明确、表型严重的pCNV进行筛查[11-12]。虽然美国妇产科医师学会关于筛查胎儿染色体异常的临床声明因临床验证数据不充分而暂不推荐开展pCNV筛查,但同时指出,如果NIPT-plus发现pCNV,应进行后续验证[13]。因此,在临床前期实验数据充分、各项关键指标明确的前提下,对发病率高、致病性严重的pCNV可采用NIPT-plus筛查。
目前,NIPT-plus已有多个技术平台,各个技术平台的测序原理不一致,产生的数据量也不一致,筛查结果会出现一定的差异。另外,相同的技术平台,如参考的人类基因组序列版本不一致也会得出不一致的结果。本研究采用NextCN500高通量测序平台,测序深度为0.2×~0.3×,每份样本的数据量为18 Mb左右,唯一比对序列≥10 Mb。将该平台检出的CNV按发生的大小可分为<5 Mb、5~10 Mb、>10 Mb共3个类别,其阳性预测值分别为42.86%、100.00%、62.50%,总阳性预测值为68.50%,对<5 Mb的CNV检测性能最低。有学者报道了一种使用350万Reads识别71.8%的CNV的方法,发现当CNV<5 Mb时,检测性能会下降至41.2%[14]。LO等[9]使用400~600万Reads分析3~42 Mb的CNV,准确率为64.5%。SRINIVASAN等[15]的研究结果显示,测序深度越深、cffDNA浓度越高,可检测到的畸变片段越小。由此可见,测序深度的降低在一定程度上限制了对小片段CNV的检出。
本研究结果显示,NIPT-plus共筛查出CNV高风险孕妇33例,其中有5例拒绝羊水穿刺,有28例行羊水穿刺和外周血检测,采用CNVseq确诊。该28例孕妇中,有15例经CNV-seq验证为假阳性,其中5例(33.3%)CNV来源于母体,是由母体CNV导致的假阳性。由此可见,母体CNV异常是NIPT-plus检测假阳性的一个重要原因。本研究通过CNV-seq检测共确诊13例,经父母来源验证,结果显示2、3、5、7、8、9号样本的变异均来自父母一方,该6例孕妇经遗传咨询后选择继续妊娠,常规产检。本研究13例阳性样本中,有7例(53.8%)CNV变异证实为新发变异,依据ACMG指南进行致病性分析,确定均为致病性变异,其中1例诊断为DiGeorge综合征,另6例均为>5 Mb的变异,可导致临床表型异常,如严重的畸形或神经系统发育异常。因此,这7例孕妇均选择终止妊娠。由于NIPT-plus检测的是来源于胎盘的游离DNA,受疾病发生率、假阳性率、cffDNA浓度、测序深度、微缺失/微重复片段大小等多种因素的影响[14-16],NIPT-plus可筛查出>3 Mb的CNV,但仍有很多pCNV不能被有效检出[2],需要在检测前充分告知。同时,NIPT-plus也可筛查出大量临床意义未明的CNV[17]或对胎儿影响不严重的pCNV,这类CNV均不建议纳入筛查报告[18]。CNV所致的疾病大多属于新发突变导致的零散发病,建议结合CNV大小、致病性、疾病严重程度、是否外显不全等情况进行综合分析,否则可能会导致孕妇不必要的孕期焦虑,同时增加诊断负担,为产前遗传咨询带来困扰。
综上所述,NIPT-plus可用于染色体非整倍体、染色体微缺失/微重复、性染色体异常等的筛查,弥补了染色体核型分析的不足。未来应进一步提高NIPT-plus在检测染色体微缺失/微重复中的特异性、准确性和敏感性。
