Fe3O4磁性荧光传感器检测真菌毒素的研究进展
2023-11-07郝丽坤
贺 文,郝丽坤,刘 玮,李 宁
(滨州医学院公共卫生与管理学院,山东 烟台 264003)
真菌毒素作为真菌在生长繁殖过程中产生的有毒代谢物,能够损伤肝脏、肾脏等组织器官,还可影响神经系统和造血系统,具有致癌性、致畸性。其分子质量小、结构稳定,且高温下不易被破坏,因此粮食、饲料以及农产品在储存和加工过程中易受到真菌毒素污染,毒素通过食物链进入人体并在人体富集,对人体健康危害巨大[1-2]。食品中真菌毒素污染已成为全球性问题,据联合国粮食与农业组织统计,全球粮食有25%受到真菌毒素污染[3]。常见的真菌毒素包括黄曲霉毒素(aflatoxins,AF)、赭曲霉毒素(ochratoxins,OT)、脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)、伏马菌素(fumonisins,FB)、玉米赤霉烯酮(zearalenone,ZEN)等。
目前国内外对真菌毒素常规的检测方法主要有高效液相色谱法(high performance liquid chromatography,HPLC)、液相色谱-质谱法(liquid chromatogram tandem mass spectrometry,LC-MS)、薄层色谱法(thin layer chromatography,TLC)、免疫分析法(酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)、胶体金免疫层析法(colloidal gold immune chromategraphic assay,GICA)等)等。前两种方法虽然在真菌毒素检测方面具有灵敏度高、分析准确、能够同时检测多组分等优点,但其通常需要大型精密仪器,且样品前处理复杂、建立分析方法耗时、需要专业人员操作,不能满足大批量样品的快速检测需求[4]。免疫分析法具有特异性强、灵敏度高的特点,目前已有商品试剂盒和试纸条投入使用,但在复杂基质中难以完全避免假阳性、假阴性等结果,且抗原抗体不易制备、易变性、储存条件苛刻,因此在真菌毒素的检测应用中受到限制[5-6]。生物传感器法是利用生化识别元件对分析物进行特异性识别的一种方法,具有特异性好、灵敏度高、简单快速、检测成本低等特点,能够实现微型化和集成化以及可实时在线监测,是检测复杂样品中痕量真菌毒素的良好选择[7-8]。
近年来,随着纳米技术的发展,各种类型的生物传感器被广泛应用于真菌毒素检测领域中,例如电化学传感器、荧光生物传感器、磁性生物传感器等[9-12],纳米材料的发展也有助于生物传感器的灵敏度和稳定性的改善,其中磁性纳米材料具有比表面积大、磁响应性强、生物相容性好等特点,可有效实现被测物与检测探针在样品基质中的快速分离与富集浓缩,在传感器构建与生物即时检测等领域均得到广泛应用[13]。近年来生物传感器应用于真菌毒素检测的研究越来越多,但鲜见磁性荧光双功能生物传感器应用于真菌毒素检测的综述,因此本文主要综述近年来Fe3O4磁性纳米颗粒与有机荧光材料、量子点、上转换纳米材料颗粒(upconversion nanoparticles,UCNPs)、金属纳米簇、荧光碳纳米材料相结合的磁性荧光双功能生物传感器在真菌毒素检测领域应用与研究的最新进展。
1 Fe3O4磁性纳米材料
磁性纳米材料是以尺寸在纳米至微米级别的铁、锰、钴、镍及其金属化合物为基础的材料。相比锰、钴、镍的金属化合物,铁氧化物为核心的磁性纳米材料具有良好的磁性、高兼容性、易改性和低成本的特点,最为常用[14-15]。铁氧化物作为广泛使用的磁性纳米材料,包括磁铁矿纳米颗粒(F e3O4)、赤铁矿纳米颗粒(α-Fe2O3)、磁赤铁矿纳米颗粒(γ-Fe2O3)[16-18]。其中Fe3O4纳米颗粒是由最佳配比2∶1的Fe3+和Fe2+构成,其反尖晶石结构由位于面心紧密堆积的O2-离子与占据8 个四面体和16 个八面体位点的铁离子构成。由于Fe3+离子与Fe2+离子的电子性质,在晶体中不会相互抵消电子自旋,而且晶体由两种阳离子所穿插的四面体和八面体的磁性子格组成,大小不同,从而产生磁性。Fe3O4纳米颗粒在室温条件且尺寸小于30 nm时具有超顺磁性,备受研究者关注[19-20]。
由于单一Fe3O4磁性颗粒具有耐酸碱能力差、极易被氧化、易团聚的缺点,其应用受到限制,因此需要对Fe3O4颗粒进行修饰,例如利用二氧化硅[21]和壳聚糖[22]对磁性颗粒进行改性等,在保证超顺磁性的同时提高其化学稳定性。修饰后的Fe3O4磁性纳米颗粒具有顺磁性、磁响应强、化学性质稳定、比表面积大、良好的生物相容性、低毒性等特点,在生物检测、癌症治疗、磁共振成像等领域得以广泛应用[23-26]。
2 荧光生物传感器
荧光生物传感器是指通过具有荧光效应的材料标记检测物,根据荧光信号变化进行检测的一类生物传感器,由于具有高灵敏度和特异性的特点,在真菌毒素检测中受到研究者的广泛关注[27-28]。常见的荧光材料主要包括有机荧光染料、荧光蛋白、荧光素、量子点、上转换纳米材料、金属纳米簇、荧光碳纳米材料等。传统荧光材料常采用荧光染料,其激发光谱窄、发射光谱宽且不对称、易发生光漂白、光稳定性差、检测灵敏度低,因此其在生物医学领域中的应用受到限制[29]。而新型的荧光材料(量子点、上转换纳米材料、金属纳米簇、荧光碳纳米材料等)与之相比具有更好的光稳定性以及可调控的粒径,而且有些荧光纳米材料的发光在近红外光谱范围,在进行检测时背景干扰小,可以提高检测灵敏度[30-31]。由于新型荧光材料特殊的光学特性,使其在医学和生物检测领域受到研究者的广泛重视。
3 Fe3O4磁性荧光传感器的应用
3.1 Fe3O4磁性纳米颗粒与有机荧光材料
传统的有机荧光染料使用条件相对简单、色彩纯度高、色彩丰富,是研究者最常使用的荧光材料。苝是一种稠环芳香烃分子,苝衍生物是以苝为主体结构衍生出的一类稠环化合物。苝衍生物作为光学传感器中的荧光探针,虽然具有高荧光量子产率和光稳定性,但由于其芳基分子间强烈的π-π作用,形成聚集体,其荧光容易猝灭,因此Wang Bin等[32]通过有机溶剂中苝聚合体的解离建立了荧光信号放大的适配体光学传感器,并利用其检测黄曲霉毒素B1(af latoxins B1,AFB1)(图1)。磁性纳米材料与AuNPs通过适配体及互补DNA(complementary DNA,cDNA)链连接,当AFB1与适配体特异性识别并经磁分离后,AuNPs-DNA复合物会释放到末端脱氧核苷酸转移酶(terminal deoxyribonucleotidyl transferase,TdT)溶液中,从而延长DNA链。延长的DNA链通过静电作用组装更多的苝衍生物探针(DNA-induced aggregation of a perylene probe,PAPDI),起到放大信号的作用。在乙醇中,PAPDI的π-π堆积作用减弱导致荧光恢复。通过荧光强度的变化能够定量检测AFB1,该方法检测限可低至3.1 pg/mL。
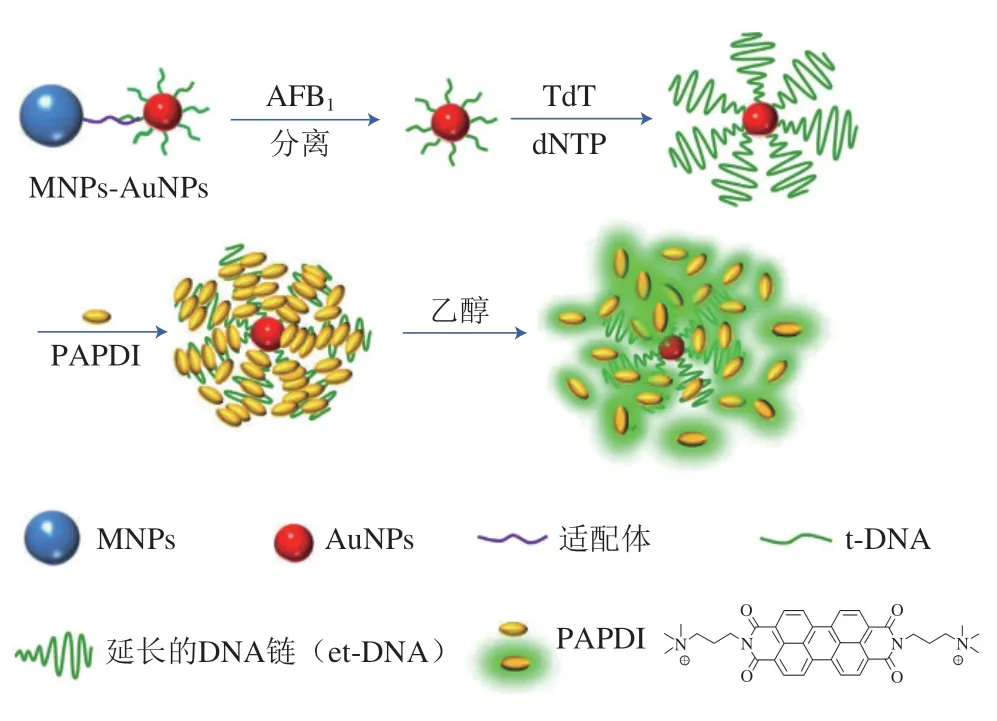
图1 基于TdT扩增策略和PAPDI聚合的AFB1适配体传感器示意图[32]Fig.1 Schematic illustration of aflatoxin B1 aptasensor based on TdT amplification strategy and PAPDI aggregation[32]
N-甲基中卟啉IX(N-methyl mesoporphyrin IX,NMM)作为一种水溶性的非对称卟啉,具有优良的光学性能,并对G-四联体结构DNA具有高度选择性。作为一种有机荧光染料,NMM在水溶液中只有轻微的荧光强度,但与G-四联体结合可以起到放大荧光信号的作用[33]。因此Zhang Fuyuan等[34]构建了一种自催化核酸外切酶III(exonuclease III,Exo-III)辅助信号放大的荧光适配体传感器,用以检测黄曲霉毒素M1(aflatoxins M1,AFM1)(图2)。将适配体及其cDNA链固定在磁珠上,AFM1存在时,先与适配体结合导致cDNA脱离出来,经磁分离后溶液中的cDNA会在Exo-III的存在下进行下一步反应。Exo-III在这个扩增过程中作为放大生物催化剂,选择性地水解3’端双链DNA,以产生具有G-四联体结构的富鸟嘌呤DNA链,NMM与G-四联体结构结合后可以放大荧光信号,其方法实际检出限为9.73 ng/kg。该方法的检测示意图见图2。

图2 基于Exo III辅助信号放大的AFM1敏感荧光检测示意图[34]Fig.2 Schematic representation of sensitive fluorescent detection of aflatoxin M1 based on Exo III assistant signal amplification[34]
Becheva等[35]利用不同的荧光材料及抗原与抗体之间的竞争性免疫反应原理,对赭曲霉毒素A(ochratoxin A,OTA)和葡萄球菌肠毒素A(Staphylococcalenterotoxin A,SEA)进行检测。将OTA与鸡卵白蛋白(ovalbumin,OVA)和荧光染料ATTO620偶联的荧光结合物OTA-OVA-ATTO620与OTA抗体功能化Fe3O4磁性纳米颗粒结合,SEA与异硫氰酸荧光素(fluorescein isothiocyanate,FITC)的荧光结合物SEA-FITC和SEA抗体功能化Fe3O4磁性纳米颗粒结合。当目标毒素存在时,基于竞争性免疫反应原理导致荧光结合物与Fe3O4磁性纳米颗粒分开,磁分离后荧光结合物会留在溶液中,测定不同荧光结合物的荧光信号从而实现对OTA和SEA的定量检测。此法可同时对OTA和SEA进行检测,OTA与SEA检出限均为0.004 ng/mL,20 min可完成检测,是一种快速有效的检测方法。该团队采用同样的方法检测AFB1,检出限低至0.9 pg/mL,检测时间不超过35 min[36]。
荧光素及其衍生物由于自身的高荧光特性,能够作为荧光标记物或荧光探针应用于生物传感器中[37],其中羧基荧光素(carboxy-fluorescein,FAM)应用最为广泛。唐淑阁[38]利用FAM建立了磁性-荧光适配体检测AFB1的方法,即AFB1适配体修饰的Fe3O4磁性纳米颗粒与FAM标记的cDNA链结合,AFB1存在时先与适配体反应,导致FAM标记的cDNA链释放到溶液中,测定溶液中FAM荧光强度变化可实现对AFB1的定量检测,检出限为2.59 ng/mL。郭婷等[39]则根据荧光共振能量转移(fluorescence resonance energy transfer,FRET)原理,利用磁性纳米材料的荧光猝灭能力,制备了检测AFM1的荧光适配体传感器。FAM标记的AFM1适配体通过静电作用被吸附到Fe3O4纳米颗粒表面,导致FAM荧光猝灭。AFM1存在时,FAM标记的适配体远离Fe3O4磁性纳米颗粒,FAM荧光信号恢复,可根据荧光信号恢复程度对AFM1进行定量检测,该方法检测限为0.02 μg/L。Ma Liang等[40]同样基于FRET原理构建了荧光生物传感器,用以检测展青霉素(patulin,PAT)(图3)。FAM标记的PAT适配体通过π-π叠加作用被吸附到磁化还原氧化石墨烯(rGO-Fe3O4)表面,FAM荧光被猝灭。FAM标记的PAT适配体在与加入的PAT结合后远离rGO-Fe3O4,FAM荧光信号恢复,PAT与适配体复合物在脱氧核糖核苷酸酶I(DNase I)的作用下参与循环裂解反应,进一步放大FAM荧光信号。DNase I的加入只裂解PAT与适配体的复合物,裂解出来的PAT会继续参与反应,让更多的FAM得以释放,荧光信号增强,该方法的检出限为0.28 μg/L,灵敏度比不使用DNase I策略高13 倍。
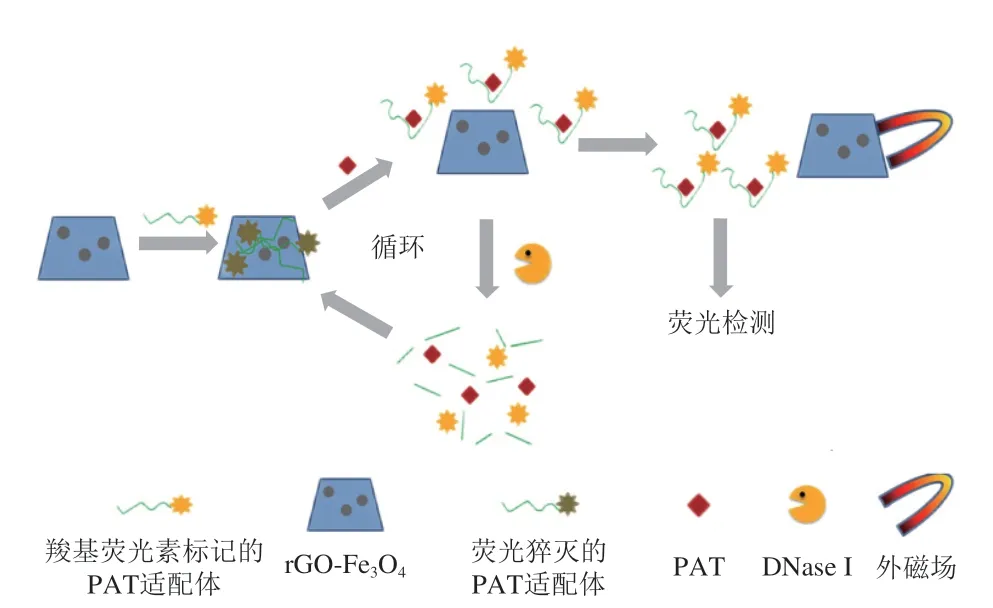
图3 基于核酸适配体的荧光PAT检测示意图[40]Fig.3 Schematic illustration of aptamer-based fluorescent patulin detection[40]
荧光蛋白作为一种新型有机荧光材料,克服了传统有机染料背景干扰高、易猝灭的缺点,几乎能够覆盖所有可见光范围,作为荧光探针和荧光标记物广泛应用于生物医药领域[41-42]。孙亚宁等[43]以DON为目标物,将Fe3O4磁性纳米颗粒与绿色荧光蛋白以及DON单克隆抗体进行偶联,制成磁荧光抗体探针,用于制备磁荧光免疫层析试纸。该方法制作的DON磁荧光免疫层析试纸检测限为1.089 ng/mL,相较于胶体金免疫层析试纸的检测限(11.94 ng/mL),灵敏度提高了11.6 倍。
3.2 Fe3O4磁性纳米颗粒与量子点
量子点又称半导体纳米晶,是由II~IV族(CdSe、CdTe、ZnSe、ZnS等)或者III~IV族元素(InP、InAs等)组成的三维尺寸在纳米级的粒子,依靠半导体间隙的量子限制效应发光。当前研究较多的是镉元素量子点CdX(X=S、Se、Te)、碳量子点(carbon quantum dots,CQDs)与石墨烯量子点(graphene quantum dots,GQDs)。量子点具有量子产率较高、吸收光谱宽等特性,其优异的发光性能使其能够作为荧光探针应用于生物传感器中[44]。
李响[45]将OTA适配体修饰的Fe3O4磁性纳米颗粒与cDNA链修饰的CdTe量子点结合并对OTA进行检测。OTA的存在致使Fe3O4磁性纳米颗粒与CdTe量子点分离,磁分离后检测上清液中量子点的荧光强度可以实现对OTA的定量检测,检出限为5×10-11g/mL。此外,还可利用磁性量子点检测AFB1、T-2毒素等真菌毒素[46-47]。
同一激发光源下能够对多个量子点进行激发,可以同时检测多种目标物。李响[48]利用此性质,将不同发射波长的CdTe发光量子点分别标记于AFB1、OTA的抗体上作为荧光指示探针,Fe3O4磁性纳米粒子与AFB1、OTA抗原结合形成捕获探针,抗体抗原相互结合使量子点与磁性颗粒连接在一起。当AFB1和OTA存在时基于竞争性免疫反应原理,量子点与Fe3O4磁性纳米粒子分离,磁分离后检测上清液中不同发射波长量子点的荧光信号强度可实现对AFB1和OTA的定量检测。AFB1与OTA的检出限分别为1.0×10-10g/mL和5×10-11g/mL。相比之下,Qian Jing等[49]所研制的同时测定OTA和AFB1的磁控荧光适配体传感器,利用金壳包覆的Fe3O4磁性纳米材料可与硫代适配体通过Au-S键结合,且适配体对目标真菌毒素的选择性更强,具有更高的灵敏度。OTA和AFB1适配体通过Au-S共价键连接到Fe3O4@Au磁珠上,与OTA、AFB1适配体互补的cDNA分别修饰SiO2包覆的绿色CdTe量子点与红色CdTe量子点,经适配体与cDNA杂交后,量子点与Fe3O4@Au磁珠结合。加入目标物OTA和AFB1并经磁分离后,溶液中剩下量子点,通过检测不同颜色量子点的荧光信号可实现对OTA和AFB1的定量检测。该方法对OTA与AFB1检测限分别低至0.67 pg/mL和1.70 pg/mL。该方法操作简单、检测时间短、选择性好、灵敏度高,为高通量筛选双真菌毒素提供了新的途径。
相较于利用镉元素制备的量子点,CQDs和GQDs具备无毒害作用、对环境影响小、生物相容性好、发光性能优异,且更易进行功能化修饰等优点[50-51]。曾云龙等[52]以自组装方式制备Au@Fe3O4/核酸适配体/氨基-CQDs磁性纳米复合物(Au@Fe3O4NPs/Apt/N-CQDs)用于检测AFB1,检测限为0.3 pg/mL。Wang Chengke等[53]建立了一种双磁分离辅助荧光法检测OTA的方法,将OTA适配体功能化的Fe3O4磁性纳米材料(Fe3O4-Aptamer)与cDNA链偶联的氮掺杂石墨烯量子点(NGQDs-cDNA)结合,第一次磁分离去除未结合的NGQDs-cDNA。OTA加入后与适配体反应,NGQDs-cDNA释放到溶液中,通过第二次磁分离去除未结合的复合物和已反应的Fe3O4-Aptamer以减少背景干扰,通过测定溶液中NGQDs荧光强度实现对OTA的定量检测,检出限为0.66 nmol/mL。
3.3 Fe3O4磁性纳米颗粒与上转换纳米材料
上转换纳米材料是由无机纳米基质和掺杂的镧系稀土元素组成粒径小于100 nm的材料,与其他荧光材料不同的是,其遵循Anti-Stokes发光规律,能够在红外线激发下发出可见光。上转换纳米材料由于具有良好的光稳定性、Anti-Stokes位移大、荧光背景低、发射波长窄等特点,有利于其在生物检测、医学成像、肿瘤治疗等领域的应用[54-55]。
规律间隔成簇短回文重复序列(clustered regularly interspaced short palindromic repeat,CRISPR)蛋白在基因编辑领域中具有重要的影响,其中CRISPR-Cas12a蛋白不仅具有靶向切割双链DNA和单链DNA(single-stranded DNA,ssDNA)的顺式切割能力,还具有反式切割任何ssDNA的切割活性。Mao Zefeng等[56]利用CRISPR-Cas12a蛋白对DNA链独特的切割能力建立了CRISPR-Cas12a荧光生物传感系统,并用于检测OTA(图4)。OTA存在时,优先与适配体反应,导致其cDNA链脱离,通过CRISPR-Cas12a识别后,对UCNPs-ssDNA-Fe3O4荧光探针中的ssDNA进行切割,导致荧光探针断裂,经磁分离后,测定上清液中UCNPs荧光强度变化从而实现对OTA的定量检测,线性检测范围和检出限分别为5~100 ng/mL和0.83 ng/mL。UCNPs-ssDNA-Fe3O4荧光探针与传统CRISPR-Cas12a荧光探针相比具有更宽的线性检测范围和更低的检出限,以及更稳定的样品回收率。
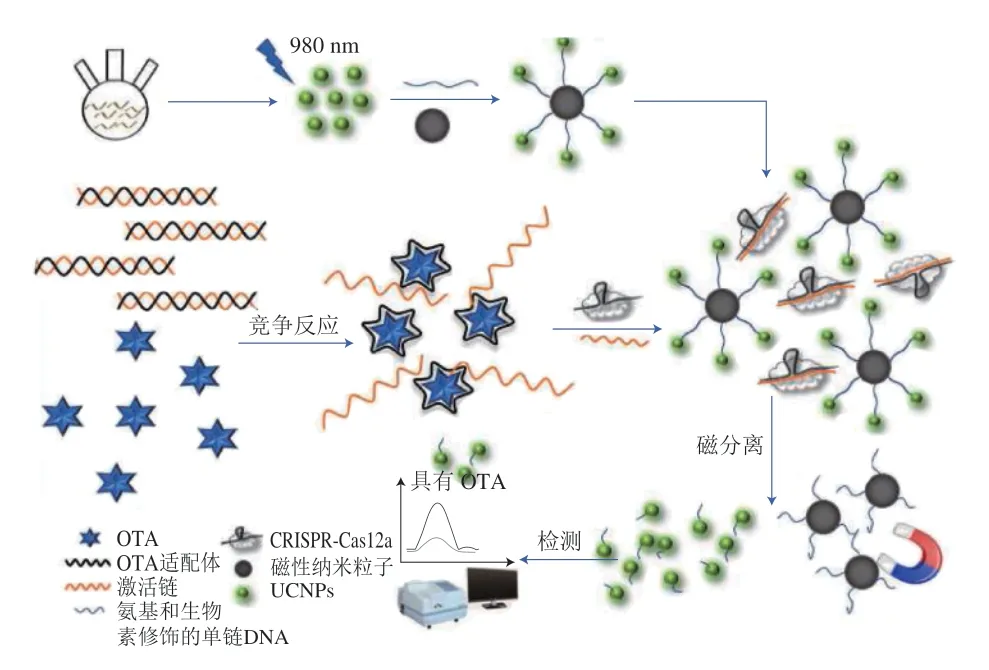
图4 上转换介导的CRISPR-Cas12a生物传感器检测OTA示意图[56]Fig.4 Schematic diagram of up-conversion-mediated CRISPR-Cas12a biosensor for detection of ochratoxin A[56]
UCNPs一般由基质材料、激活剂(发光中心)以及敏化剂构成,通过调节UCNPs所掺杂镧系元素离子浓度可制备多色可调的UCNPs。Li Jingzhi等[57]同样基于竞争性免疫反应原理建立了一种磁性荧光传感器同时检测伏马菌素(fumonisin B1,FB1)和ZEN。结合FB1和ZEN抗原的UCNPs分别与FB1和ZEN抗体功能化Fe3O4磁性纳米粒子结合。当FB1和ZEN存在时,基于竞争性免疫反应原理使得UCNPs脱落,在980 nm波长近红外光激发下,分别在发射波长480 nm和550 nm处对FB1和ZEN进行检测,检出限分别为0.016 ng/mL和0.012 ng/mL。还可利用多色UCNPs同时检测噬菌灵和OTA[58],也可以同时检测OTA和ZEN[59]。利用UCNPs的多色标记特性,有望进一步实现多组分同时检测,多色UCNPs在食品安全和传感领域中有巨大的应用潜力。
3.4 Fe3O4磁性纳米颗粒与金属纳米簇
金属纳米簇通常由几个到几十个金属原子组成,粒径通常小于2 nm,尺寸与费米波长相当,在该尺寸范围内金属纳米簇具有半导体的特征,自由电子的强量子限域效应导致电子能级从连续态分裂成分立能级,金属纳米簇不再具有明显的表面等离子共振吸收,从而能够在可见光到近红外区域强烈发光[60]。金属纳米簇主要包括金纳米簇(AuNPs)、银纳米簇(AgNPs)、铜纳米簇(CuNPs)等以及各种合金纳米簇。金属纳米簇具有合成方法简单、易于进行表面功能化、生物相容性良好、稳定性好、毒性低、发光能力强等特点。由于金属纳米簇极佳的荧光性能,在生物传感领域具有广阔的应用前景[61]。
DNA的磷酸骨架与金属离子之间具有静电作用,含氮碱基(腺嘌呤(A)、胸腺嘧啶(T)、鸟嘌呤(G)和胞嘧啶(C))与金属之间有较强的配位作用,可通过金属离子与配位点结合并在还原剂的作用下制备尺寸可调、荧光发射波长和强度可调、光稳定性高的金属纳米团簇,例如金、银、铜均能够以DNA作为模板合成金属纳米簇[62-63]。有研究表明引物DNA在TdT与脱氧胸苷三磷酸(2’-deoxythymidine 5’-triphosphate,dTTP)存在时,TdT可直接催化短寡核苷酸片段从5’端到3’端延伸形成多聚胸腺嘧啶序列,且当TdT浓度增加时,多聚胸腺嘧啶序列变长,CuNPs尺寸增加,荧光也会发生变化[64]。He Yue等[65]利用该方法制备荧光传感器来检测OTA。将OTA的适配体及其cDNA链固定在磁珠上,OTA存在时,先与适配体结合,此时暴露cDNA。经过磁分离后的cDNA作为引物触发TdT与dTTP介导的聚合反应,此过程会形成多聚胸腺嘧啶,其能够作为合成CuNPs的模板,通过合成的CuNPs荧光强度变化,对OTA进行定量检测。该方法灵敏度高,检测限为2.0 nmol/L。AgNPs同样能够与DNA结合作为生物传感器对真菌毒素进行检测。Zhang Man等[66]采用适配体生物传感器对T-2毒素进行检测(图5)。将T-2毒素的适配体及其cDNA链固定在磁珠上,T-2毒素存在时,会与修饰在磁珠上的适配体优先结合,导致cDNA脱落。磁分离获得的cDNA能够作为引物触发指数等温扩增反应(exponential isothermal amplification reaction,EXPAR)获得ssDNA,富含碱基的ssDNA结合并还原Ag离子形成AgNPs,可通过测定其荧光变化来检测T-2毒素,检出限低至30 fg/mL。
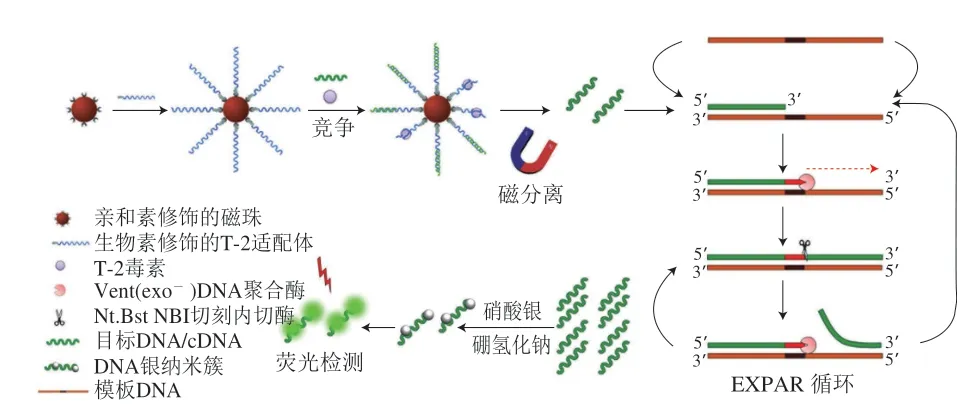
图5 基于EXPAR和AgNC扩增策略检测T-2毒素示意图[66]Fig.5 Schematic diagram of detection of T-2 toxin based on exponential isothermal amplification reaction (EXPAR) and AgNC amplification strategy[66]
3.5 Fe3O4磁性纳米颗粒与荧光碳纳米材料
荧光碳纳米材料主要包括多壁碳纳米管、氧化石墨烯纳米材料、CQDs和石墨烯量子点等。此类纳米材料由于具有低毒性、生物兼容性好的特征,在生物检测领域具有潜在的应用价值[67-70]。
石墨烯材料由于其特殊的荧光特性和荧光猝灭效应,经常被用来构建荧光生物传感器,在传感过程中担任FRET受体猝灭剂的角色[71-72]。氧化石墨烯与还原氧化石墨烯作为石墨烯的衍生物,同样具有猝灭剂的效果。Wang Chengquan等[73]提出了一种多路FRET适配体传感器,用于检测AFB1和FB1。以磁控氧化石墨烯(GO/Fe3O4)为能量受体,AFB1和FB1的适配体修饰的绿色和红色CdTe量子点作为双能量供体,通过适配体与GO/Fe3O4的π-π叠加作用发生FRET猝灭量子点荧光。目标物存在时与适配体反应,量子点与GO/Fe3O4分离,荧光信号恢复,通过测定溶液中不同发射峰量子点荧光信号的变化可对AFB1和FB1进行定量检测。与传统基于GO猝灭剂的FRET系统相比,GO/Fe3O4作为单一能量受体,不仅可以同时猝灭不同发射峰绿色和红色量子点的荧光,还可以通过有效的磁分离去除背景干扰。加入的GO/Fe3O4与绿色量子点和红色量子点标记的适配体之间存在π-π叠加作用,使量子点原本荧光猝灭。AFB1和FB1的检出限分别为6.7 pg/mL和16.2 pg/mL。Zhang Xiya等[74]利用单克隆抗体(mAb)功能化磁性还原氧化石墨烯(rGO-Fe3O4-mAb)作为能量受体,以四甲基异硫氰酸罗丹明标记的AFB1(AFB1-TRCA)作为能量供体,通过抗体抗原相互结合发生FRET猝灭TRCA荧光。AFM1存在时,基于竞争性免疫反应原理导致AFB1-TRCA脱离能量受体,FRET消失,TRCA荧光恢复,利用荧光变化检测AFM1,检出限为3.8 ng/L,低于使用相同免疫试剂的荧光免疫分析法,并可在10 min内完成检测。
3.6 镧系元素及其螯合剂
除以上荧光材料外,还可利用镧系元素及其螯合剂作为荧光标记物。时间分辨荧光分析技术便是依靠镧系元素的荧光寿命长、Stokes位移大、荧光发射峰窄和激发光谱宽等荧光性质,具有高效率、高特异性和高灵敏度的检测方法[75],常用的镧系元素有铕(Eu)和铽(Tb)。Niazi等[76]利用时间分辨荧光技术制备了检测ZEN的适配体传感器,即适配体修饰的Fe3O4磁性纳米粒子与cDNA链修饰的时间分辨荧光纳米颗粒(NaYF4: Ce/Tb)结合,目标物存在且磁分离后,检测上清液中荧光强度实现对ZEN的定量检测,检出限为0.21 pg/mL。该团队也利用时间分辨荧光分析技术制备了能够同时检测玉米中的OTA和FB1适配体传感器,OTA和FB1的检出限分别为0.015 pg/mL和0.019 pg/mL[77]。但利用镧系元素及其螯合剂作为荧光标记物,具有放射性,对人体健康有害。近年来,基于磁性荧光双功能生物传感器检测真菌毒素的相关研究基本信息见表1。
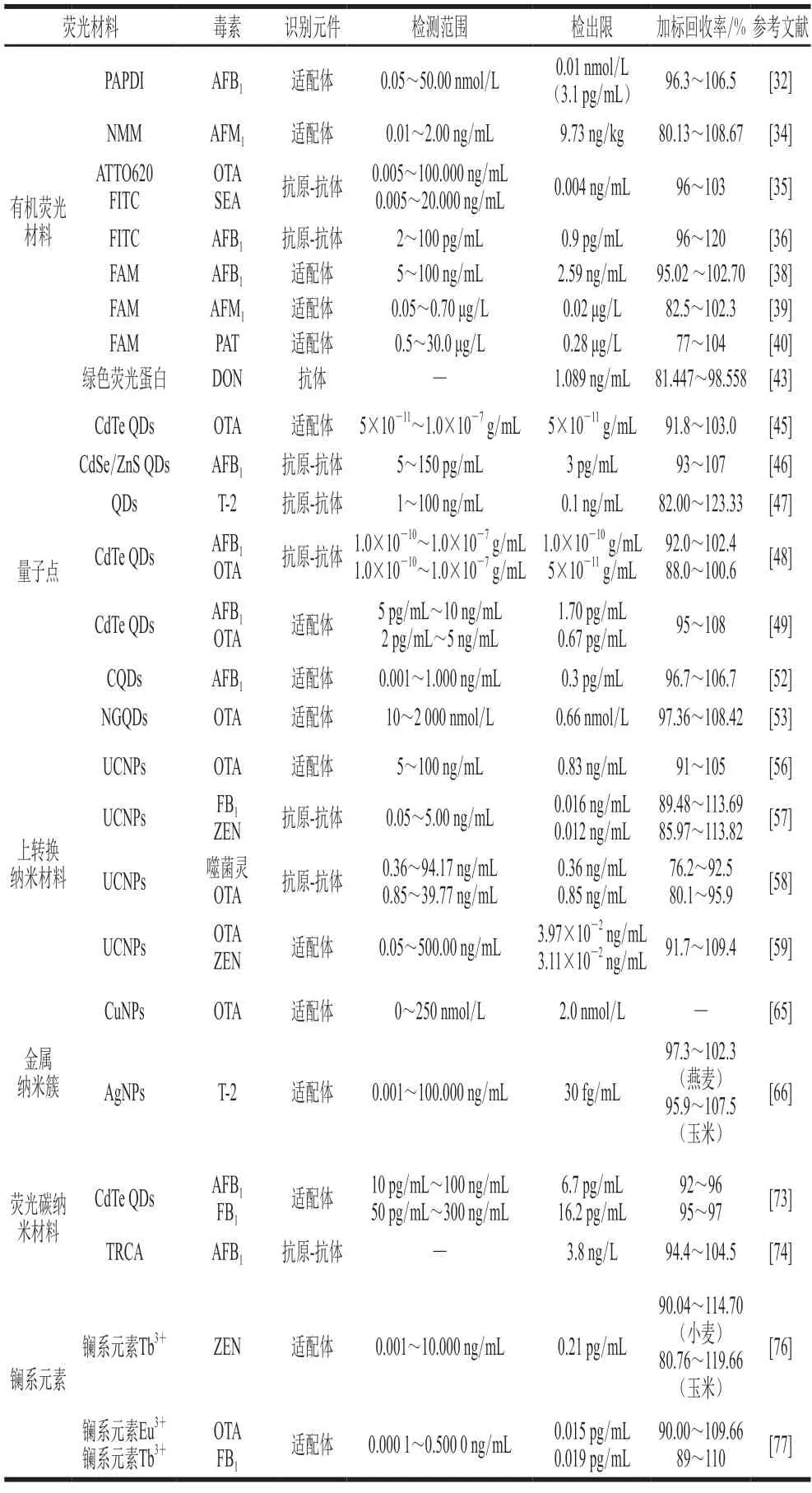
表1 磁性荧光双功能生物传感器在真菌毒素检测中的应用Table 1 Applications of magnetic and fluorescent biosensors in the analysis of mycotoxins
4 结语
综上所述,大部分磁性荧光双功能生物传感器的识别元件以抗体-抗原、适配体为主,以荧光纳米材料作为信号探针。但抗体-抗原制备成本高、不易保存、储存条件严格等缺点限制了其应用,应注重发展制备成本低,结构稳定的抗体识别元件。适配体与抗体相比,具有分子质量小、易合成、成本低、结构稳定等特点,更适合作为生物传感器的识别元件,基于适配体及其互补DNA链的酶辅助信号放大和DNA扩增技术等方法,可以为荧光生物传感器提供更高的灵敏度。将磁性纳米材料引入荧光生物传感器中,可凭借磁性纳米材料的高比表面积使竞争反应能够高效进行,并且通过外部磁场可有效地分离或富集竞争反应产物或未反应的检测探针,用于荧光信号检测,能够有效排除背景干扰,提高检测灵敏度和检测速度。
目前虽已研究出灵敏度较高的磁性荧光双功能生物传感器,但也存在一些问题:1)基于适配体的DNA扩增反应以及酶辅助信号放大的方法,往往需要专业设备,而且操作复杂,不适用于大规模现场快速检测;2)量子点和稀土元素的荧光强度虽然高,但由于量子点合成成分中含有镉等重金属元素以及稀土元素具有的放射性,对人体有害,因此在应用过程中应注意防护以及回收处理;3)大多数常用荧光团的荧光寿命较短,且不稳定;4)样品基质复杂、干扰因素多,会影响灵敏度。
未来需对纳米材料的化学稳定性进行研究,特别是提高纳米材料的荧光稳定性,面对多种污染物复杂的情况可以开发多种真菌毒素检测的平台。纳米材料以及纳米技术的发展能够为多种模式同时检测(电化学检测、荧光检测等)提供帮助,提高样品基质的抗干扰能力,同时可开发基于DNA扩增技术的简便仪器,为大规模现场筛查提供可能。磁性荧光双功能生物传感器中的磁性不仅仅可以用于磁分离,还可以作为磁信号探针使用,其穿透力强、受样品基质干扰小,可作为一种检测手段。
