多糖纳米硒的制备、功能和在食品领域应用的研究进展
2023-11-07钟泽梁洪碧红肖美添白锴凯
钟泽梁,洪碧红,肖美添,白锴凯,*
(1.华侨大学化工学院,福建 厦门 361021;2.自然资源部第三海洋研究所,福建 厦门 361005;3.自然资源部海洋生物资源开发利用工程技术创新中心,福建 厦门 361005)
硒是动物和人体必需的微量营养元素之一[1],是组成多种含硒蛋白或酶的关键性元素,对维持机体的正常生命活动至关重要,具有延缓衰老[2]、预防肿瘤[3]、调节免疫[4]等功能,特别对心血管疾病[5]、肿瘤[3]、糖尿病[6]等具有较好的辅助防治作用。硒摄入量不足会导致动物和人体重要器官机能的失调,从而影响健康。1973年,硒被世界卫生组织认定为人体必需微量元素,凸显出其营养价值。然而,硒营养剂量与最大安全摄入量之间的范围很窄[7],过量摄入硒容易引起毒性反应。传统的补硒剂始终存在这一问题,安全性较差,面临淘汰。
纳米硒(selenium nanoparticles,SeNPs)是具有纳米尺寸特征的单质硒,具有良好的生物利用度和安全性,并展现出抗氧化[8]、抗肿瘤[9]、免疫调节[10]、抗菌[11]、胃黏膜保护[12]、肝保护[13]等多种功效,逐渐引起全世界科研工作者的兴趣,发展前景广阔。然而,裸露的纳米硒很不稳定,不但形貌和尺寸难以控制,而且容易自发聚集成团甚至形成沉淀,导致生物活性和生物利用度骤减,失去功效。为此,科研人员采用表面修饰[10]、包覆[14]、固相支载[8]等技术控制纳米硒的生长、形貌、尺寸和表面特性,提高纳米硒的稳定性,并赋予纳米硒各种新的载体功能和生物学功效。
多糖对于纳米材料而言是较理想的修饰剂和稳定剂[15]。多糖包含大量羟基、氨基、硫酸基和羧基等基团,可为硒原子簇的生长提供有利的微环境,并能够吸附和包裹纳米硒,控制纳米硒的团聚和生长。同时,多糖分子的可修饰位点众多、生物活性多样、生物相容性好,使多糖纳米硒具有较强的可修饰性和多糖特有的生物活性,既可能作为多功能补硒剂,又具备开发成纳米载药体的潜力,颇具发展前景。为进一步探索多糖纳米硒体系的发展脉络和技术应用前景,本文从多糖纳米硒的制备方法、生物学功效及其应用等方面介绍多糖纳米硒的研究现状和进展,以期为多糖纳米硒的研发提供更多思路。
1 多糖纳米硒的制备、纯化、表征及产物形式
纳米硒的制备方法包括化学法(氧化还原反应[8-12])、物理法(微波辐射、γ射线辐射、激光烧蚀、超声波等[16-18])和生物法(微生物/植物的生物转化作用[19-20])等(表1)。相对于其他制备方法,化学法反应迅速、操作简便、产物品质更加可控,成为制备纳米硒的主要方法,是本文的关注重点。
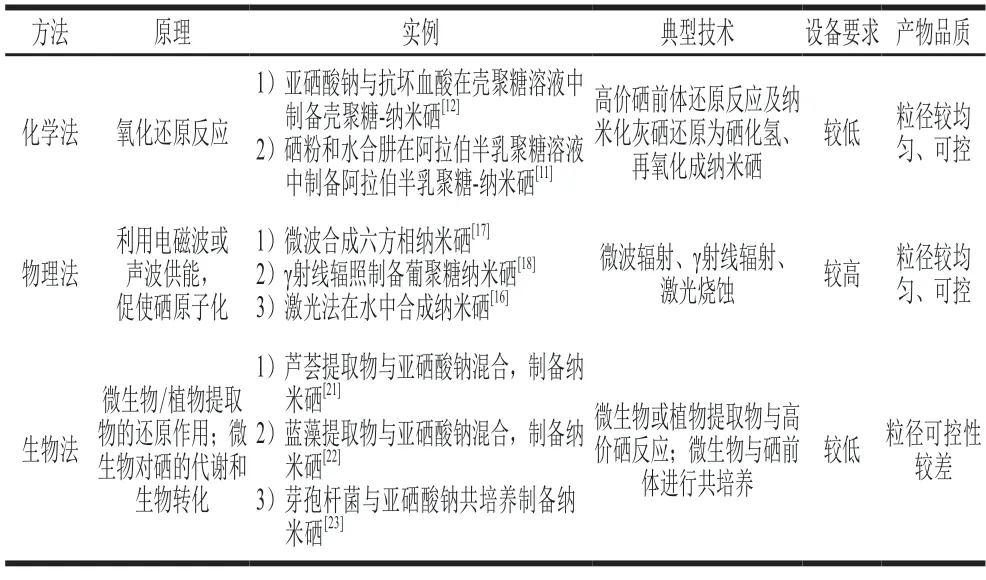
表1 纳米硒的制备方法分类Table 1 Classification of preparation methods for nano selenium
1.1 多糖纳米硒的制备
目前,多糖纳米硒的制备通常以多糖作为软模板、稳定剂或分散剂,采用化学还原法制备多糖纳米硒。其实质是利用还原剂(如抗坏血酸、谷胱甘肽等)将高价硒前体(如亚硒酸钠、二氧化硒等)还原为硒原子,硒原子聚集成团簇,并与多糖吸附结合,形成稳定分散的纳米级单质硒粒子;可通过控制反应条件制备球状、棒状、不定型等形貌的纳米硒粒子(图1)。根据加料顺序,多糖纳米硒通常有2 种制备策略:1)直接在多糖体系中混合还原剂和硒前体并充分搅拌进行反应[8-11];2)先混合还原剂和硒前体进行反应制备纳米硒,再加入多糖进行包覆[24-26]。策略1制备的纳米硒始终受到多糖的调控和负载,形貌和性能较稳定,该策略较常用。如Bai Kaikai等[27]在壳聚糖溶液中以抗坏血酸还原亚硒酸钠(Na2SeO3),制备了粒径为35 nm、呈规则球状的壳聚糖纳米硒(chitosan selenium nanoparticles,CTSSeNPs),可稳定保存30 d,稳定性较好。策略2中,新制纳米硒缺乏多糖的约束,稳定性较差,制备效果较难控制。但可以采用小分子(如氨基酸[24]、葡萄糖[25]、I3-[26]等)控制还原剂与硒前体的反应,先制备具有一定稳定性的小分子修饰纳米硒,再加入多糖吸附纳米硒,从而改善制备效果。Chen Wanwen等[26]在KI溶液中合成了纳米硒,再与壳聚糖混合,发现壳聚糖的加入不影响纳米硒的形态,能更有效地控制纳米硒的尺寸范围。表2总结了部分研究中多糖纳米硒的制备条件、粒径和形貌。
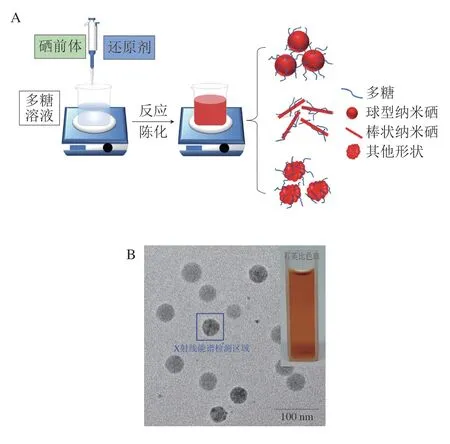
图1 多糖纳米硒(溶胶)的制备过程(A)及壳聚糖纳米硒的外观和透射电子显微镜图像(B)[8]Fig.1 Preparation procoss of polysaccharide-SeNPs (A) and appearance and transmission electron microscopic image of chitosan-SeNPs (B)[8]
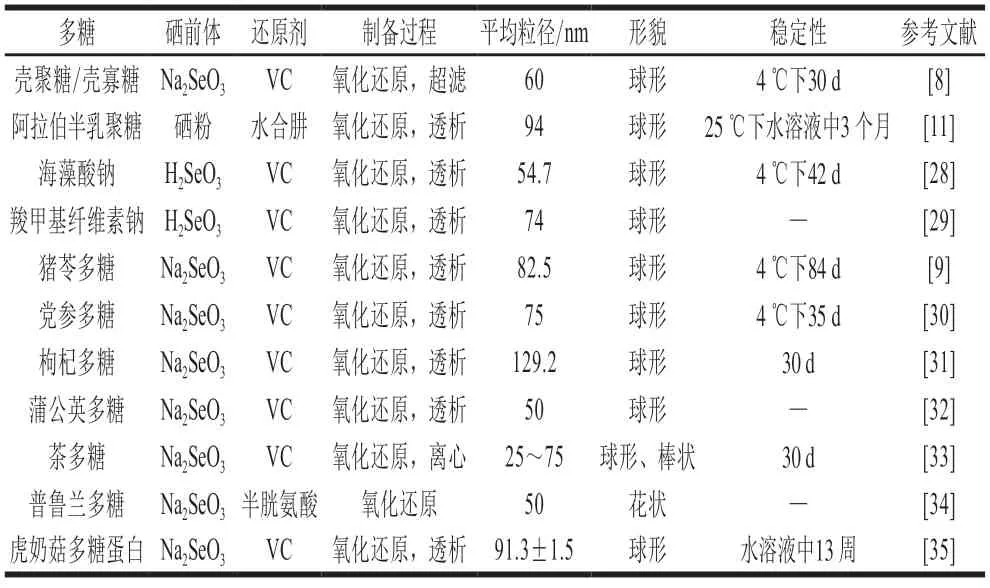
表2 多糖纳米硒(溶胶)的原料、制备方法和理化性质Table 2 Raw material,preparation-method and physicochemical properties of polysaccharide-SeNPs
1.2 多糖纳米硒的纯化
化学法所制备多糖纳米硒一般为红色或橙色透明胶体,内含纳米硒、多糖、残留反应物、副产物等。其中,反应物和副产物一般为小分子,可通过透析[9-10]、离心[33]、超滤[8,12]等方法除去。透析可去除截留分子质量以下的杂质,但一般需要较长的透析时间且需要多次更换透析液,不适用于规模化快速制备[29,32]。Gao Xiong等[9]将猪苓多糖与Na2SeO3混合后滴加VC进行反应,再将反应物在超纯水中透析72 h,去除多余的反应物和杂质,获得猪苓多糖纳米硒。超滤通常比透析更高效,在去除副产物的同时能够保留多糖纳米硒的形态和结构,纯化更简便迅速,适合大规模快速生产[8,36]。Bai Kaikai等[12]利用超滤代替透析对新制备的壳聚糖纳米硒溶胶进行纯化,不但可快速高效去除副产物,而且多次超滤未明显改变纳米硒的形状和尺寸,提示利用超滤法纯化纳米硒具有可行性。离心则可去除未与纳米硒结合的可溶性多糖,这是透析和超滤较难实现的。穆静静[33]在精制茶多糖纳米硒时采用离心法去除茶多糖,再通过聚醚砜滤膜进行微滤,进一步提升了纳米硒的纯度。需要注意的是,在溶液中多糖吸附于纳米硒表面形成纳米体系时,处于“吸附-解吸”动态平衡状态,因此,经纯化的纳米硒实际上包含多糖修饰纳米硒和游离多糖。
1.3 多糖纳米硒的表征
利用现代分析测试技术可对多糖纳米硒的表面形貌、粒度分布、元素组成、价态、内部结构、表面特性、官能团及分子间作用力等理化性质进行表征。其中,扫描电子显微镜(scanning electron microscope,SEM)[8-9]、透射电子显微镜(transmission electron microscope,TEM)[8-12]、原子力显微镜(atomic force microscope,AFM)[37]等显微成像技术可用于观测多糖纳米硒的形貌和尺寸。TEM或SEM配合能量色散X射线谱技术[14],可分析多糖纳米硒的元素组成及其含量;高分辨率透射电子显微镜结合选区电子衍射技术(selected area electron diffraction,SAED)[9]则能够分析纳米硒的原子排列和晶型结构。X射线衍射技术可作为TEM-SAED的重要补充,用于判断纳米硒是否晶体或无定型,并可根据晶体衍射峰2θ的位置对照标准晶体库数据(如JCPDS卡片数据库[38])判断具体晶型。动态光散射技术(dynamic light scattering,DLS)[32]可分析纳米颗粒的水动力粒径和粒度分布,但与前述的显微技术获得的尺寸可能有所差别,因为二者的检测原理和侧重点不同:DLS能够测量多糖纳米硒颗粒及其水合外层的整体尺寸,而TEM仅能观察干燥纳米硒核心,较难辨识多糖层。如Zhang Shaojie等[32]利用TEM检测到的蒲公英多糖纳米硒粒径小于DLS检测结果。此外,DLS结合电泳光散射技术[15]能够测量分子或颗粒在分散体系中的电荷(如Zeta电位[8])。测定Zeta电位可以掌握多糖纳米硒的表面荷电特性,有助于了解纳米硒的稳定性及其与生物大分子的作用倾向。纳米硒用不同电负性的多糖修饰后往往显示出类似多糖的Zeta电位特性[30,39-40],呈现独特的理化特征和生物活性。X射线光电子能谱技术(X-ray photoelectron spectroscopy,XPS)[8,30,32-33]通过检测元素电子结合能峰,判断元素种类及其化合价态,是鉴别多糖纳米硒的重要技术。Zhang Shaojie等[32]利用XPS发现蒲公英多糖纳米硒全光谱的典型Se 3d峰和多糖的其他元素峰,证实成功获得了多糖纳米硒。Bai Kaikai等[12]采用氩离子刻蚀-XPS技术,通过氩离子刻蚀剥离表面糖层,对照刻蚀前后Se 3d、Se 3p、Se LMM等峰的变化证明纳米硒表面被多糖覆盖并形成保护层。傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)技术[29-32]可通过检测红外光谱判断多糖纳米硒的特征官能团,有助于探究多糖和纳米硒的互作机制和方式。总之,多糖纳米硒的表征技术较丰富,不同分析技术的组合有助于剖析多糖纳米硒的理化性质和结构信息。
1.4 多糖纳米硒的产物形式
根据多糖纳米硒的稳定性、储藏方式和应用领域,利用多糖的理化性质特点,可将其制备成不同形式的产物,如多糖纳米硒胶体[33]、多糖纳米硒冻干物[30]、多糖纳米硒凝胶[36]、多糖纳米硒喷干微球[8]、多糖纳米硒喷涂微丸[41]等(图2A)。多糖纳米硒胶体(图2B)可置于冷藏环境(如4 ℃)进行保存,稳定时间可达数月,但最终仍会面临纳米硒团聚甚至沉淀[38]。可将上述胶体进行冷冻干燥得到冻干多糖纳米硒[29-30]。此外,基于多糖含有大量可电离极性基团,可通过静电相互作用与效应离子形成可逆的离子凝胶,以物理交联代替化学交联,制备多糖纳米硒凝胶,如支载纳米硒的壳聚糖/柠檬酸凝胶[36](图2C)。除此之外,Bai Kaikai等[8,12]还利用喷雾干燥技术和流化床喷涂技术,分别制备了多糖纳米硒微球/微粒(图2D、E)和负载纳米硒的多糖微丸。与胶体相比,其他产物形式中纳米硒分布于固体多糖分子层,从而实现纳米硒之间的物理隔绝,有效防止聚集,增强稳定性,有利于储存和运输,有助于提高安全性、实现纳米硒在胃肠道的可控释放[8,12]。

图2 多糖纳米硒的产物形式和纳米壳聚糖外观及SEM图Fig.2 Product forms of polysaccharide-SeNPs and visual appearance and SEM images of chitosan-SeNPs
2 多糖对纳米硒的理化性质的调控和影响
多糖具有长链或支链结构,包含大量极性基团,结构丰富多样。研究表明,多糖的结构和性质对于纳米硒的制备和保存影响很大,能够直接影响纳米硒的尺寸、形貌、表面电位等,而且多糖和纳米硒的相互作用对于形成和维持纳米硒体系至关重要。
2.1 多糖对纳米硒尺寸和形貌的调控
采用化学法制备纳米硒时,硒前体经过化学反应生成硒原子,硒原子继而聚集形成硒原子簇、硒颗粒。若此过程缺乏对硒形成和生长的约束,往往导致硒颗粒的形貌和粒径难以控制、容易聚集成团等问题。多糖含有大量羟基、氨基、硫酸基和羧基等极性基团,具有长链或支链结构,可为硒原子簇的生长提供有利的微环境,并沿聚合物链吸附和包裹纳米硒,调控纳米硒的生长和排列。壳聚糖在酸性介质中呈带正电荷聚电解质状态,所构筑的微环境具有良好的悬浮、乳化、稳定等作用,其氨基和羟基对硒前体(亚硒酸根或硒酸根等)具有较好的吸附力[38-39]。亚硒酸分散在壳聚糖微环境中,与VC发生氧化还原反应产生零价硒。此反应受到壳聚糖微环境的影响和调控,并且反应生成的单质硒被壳聚糖原位吸附包裹,从而有效防止初始形成的纳米硒粒子间的团聚,减缓纳米粒子的生长,获得规则球形的、尺寸可控的壳聚糖纳米硒[12]。
此外,多糖的分子质量、空间结构、投料比和反应条件等因素也对纳米硒的制备过程影响甚大。Zhai Xiaona等[39]用不同分子质量壳聚糖(高分子质量壳聚糖CS(h)和低分子质量壳聚糖CS(l))修饰纳米硒,结果发现初始制备的CS(l)-SeNPs尺寸明显小于CS(h)-SeNPs,且二者分别发生“自下而上”生长和“自上而下”收缩的过程;该过程受到壳聚糖分子质量的调控,其中CS(h)-SeNPs发生明显聚集,尺寸缩小,可能与CS(h)的桥接作用有关。Li Hongyan等[42]发现随着1,6-α-D-葡聚糖(1,6-α-D-glucan,CPA)比例的增加,纳米硒从单分散、均匀的球形结构变成网状结构,而Chen Wanwen等[43]发现高浓度黄精多糖能更好地覆盖在纳米硒颗粒表面,有效控制纳米硒颗粒尺寸,表明多糖浓度对纳米硒和形貌和尺寸具有显著的调控作用。杨雪[31]则发现低pH值环境中枸杞多糖易发生质子化,削弱了枸杞多糖与纳米硒之间的静电相互作用,并导致纳米硒聚集,说明反应条件可影响多糖状态、调控纳米硒的制备。某些多糖可形成特殊空间结构,有利于纳米硒的制备、负载和稳定,如Ping Zhaohua等[14]发现高支化的β-(1→3)-D-葡聚糖(AF1)在水中可自组装形成中空纳米纤维,球形的纳米硒颗粒被包裹在AF1纤维空腔中,具有良好的分散性和较好的稳定性。
简而言之,多糖可发挥软模板、分散剂、稳定剂的功能,通过静电引力、氢键、吸附作用、链桥接等作用有效调控纳米硒的合成。多糖结构、官能基团、分子质量、糖硒比例和反应条件(温度、pH值、搅拌速度)等因素对纳米硒尺寸和形貌具有显著的控制作用。但多糖理化性质和生物活性差异较大,应针对形貌和尺寸的要求选择合适的多糖用于制备纳米硒,并调控制备条件。
2.2 多糖对纳米硒稳定性的影响
裸露的纳米硒极不稳定,容易聚集沉淀,这与纳米硒粒子之间缺乏空间隔离和静电斥力有关。多糖吸附于纳米硒后,不但在其表面形成空间隔离,而且整个纳米体系被赋予类似于多糖的电荷特性,可在纳米硒之间产生静电斥力,显著提升纳米硒的稳定性。Shi Lijuan等[40]发现纳米硒经菊粉果聚糖吸附修饰后在其表面形成糖层,同时体系更加稳定,表明多糖具有显著的空间隔离效应。此外,纳米硒经酸性或碱性多糖修饰后形成糖层,同时具有空间隔离和静电排斥效应,稳定性显著提升。Yu Juan等[30]报道经过党参多糖修饰后的纳米硒表面带强净负电荷,其粒径较稳定。壳聚糖含有正电基团,经壳聚糖修饰的纳米硒的Zeta电位可达60 mV,说明纳米硒之间存在较强的静电斥力,能有效提升纳米硒溶胶的稳定性[38-39]。
一般而言,Zeta电位绝对值超过30 mV即可认为纳米体系较为稳定。但也应注意,Zeta电位与多糖极性基团的荷电状态密切相关,易受环境因素(pH值、离子强度、温度等)的影响。可通过改变环境因素提升Zeta电位,增强纳米硒体系的稳定性。尽管多糖可明显提高纳米硒的稳定性,但多糖纳米硒在储存过程中仍会面临聚集、沉淀的趋势。Bai Kaikai[38]、Zhai Xiaona[39]和杨雪[31]等均发现多糖纳米硒(壳聚糖纳米硒、枸杞多糖纳米硒(LBP-SeNPs))在储存过程中发生粒径变大、沉淀现象,而该现象往往伴随着Zeta电位变小,表明纳米硒表面多糖可能发生脱落(图3)。若需进一步提升多糖纳米硒的稳定性,可以采用避光冷藏[8-9]等方法,减少颗粒间的碰撞机会,或如1.4节所述制成各种固态化多糖纳米硒,以适于长期保存。

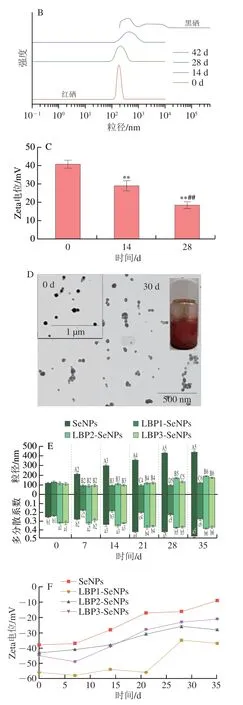
图3 多糖纳米硒的储藏稳定性Fig.3 Stability of polysaccharide-SeNPs during storage
2.3 多糖与纳米硒的相互作用力
多糖富含极性基团和链结构,在制备纳米硒、包覆纳米硒的过程中始终与纳米硒保持相互作用,调控纳米硒的生长和稳定性。研究多糖与纳米硒的相互作用力对于揭示多糖的调控作用具有重要意义。Li Hongyan等[42]观察到CPA-SeNPs红外光谱中的羟基吸收峰发生红移,同时C=O基团伸缩振动峰发生蓝移,认为形成了Se—O键;Ping Zhaohua等[14]通过FT-IR和XPS分别观察到AF1和AF1-SeNPs的C=O基团吸收峰蓝移以及O 1s峰出现了变化,也认为形成了Se—O键;Ren Lirong等[44]则通过类似的实验推测鲍鱼内脏糖蛋白ATP-纳米硒(PSP-SeNPs)存在Se—N键。然而,其他研究团队采用类似技术开展研究时发现,多糖和纳米硒之间更多的是形成非共价键,如氢键等。杨雪[31]研究枸杞多糖对纳米硒的调控效果,证实多糖与纳米硒之间并未形成共价键结构,主要是通过羟基作用相结合。Zhang Shaojie等[32]在对蒲公英多糖的研究中利用FT-IR发现了蒲公英多糖(TMP50)的羟基与纳米硒表面原子之间的氢键作用;采用XPS技术则发现了TMP50和吐温-蒲公英多糖-纳米硒(Tw-TMP-SeNPs)的O 1s峰出现偏差,进一步证明了SeNPs与TMP50之间的强相互作用和C—O…Se键的形成有关。Bai Kaikai等[8]通过观察发现纳米硒与壳聚糖、壳寡糖的相互作用过程中,倾向于多糖与纳米硒之间存在氢键等弱相互作用。可见,即使分析技术手段一致,研究人员对纳米硒与多糖作用力本质的认识也无法达成一致。这既与多糖的官能团和结构差异较大有直接联系,也与分析技术手段不足有关。等温量热滴定等新技术可考察纳米硒与高分子物质(如蛋白[45]或多肽[46])结合过程的热力学过程,判断二者之间的作用力类型,有望进一步揭示纳米硒和多糖之间作用力的本质。
3 多糖纳米硒的生物学活性
多糖纳米硒作为一个有机统一的纳米体系,其多糖组分和硒组分均具有多种生物学活性,二者共同作用发挥硒营养强化功能,使多糖纳米硒体系展现出抗氧化[8]、抗肿瘤[9]、抗炎活性[10]、抗菌活性[11]、免疫调节[47]、抗糖尿病[48]等作用(图4),并可利用多糖的可修饰性和纳米硒的载体特性对多糖纳米硒进行功能化设计[49],增强其靶向给药[50]和控释能力[26],改善其抗肿瘤和免疫调节效果。表3总结了近年来几种不同多糖纳米硒的生物活性。

图4 多糖纳米硒的生物学活性Fig.4 Bioactivities of polysaccharide-SeNPs
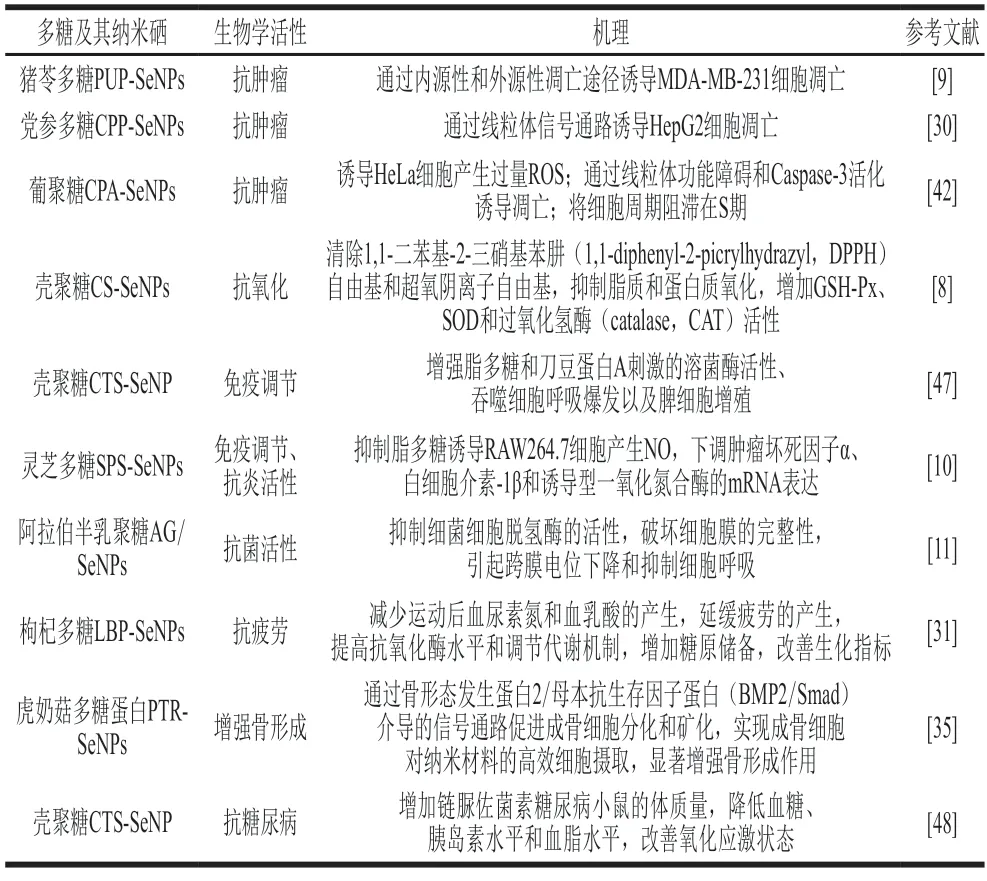
表3 部分多糖纳米硒的生物学活性及机理Table 3 Bioactivities and mechanism of action of polysaccharide-SeNPs
3.1 抗氧化
多糖和纳米硒均具有抗氧化功能,二者组成多糖纳米硒体系后共同发挥抗氧化作用。Bai Kaikai等[27]发现壳聚糖纳米硒对和DPPH自由基等均具有显著的清除作用,其清除能力分别约为VC的1/5、1/3和1/7,显著优于壳聚糖,而且纳米硒的清除能力占主要作用(图5A、B),说明多糖纳米硒本身具有一定的体外抗氧化能力。此外,硒是至少25 种人类硒蛋白和酶催化位点的关键组成部分,可诱导产生多种重要的抗氧化酶,如GSH-Px和SOD等,通过清除体内自由基保护细胞免受氧化损伤。Chen Wanwen等[43]证明了黄精多糖纳米硒对DPPH自由基、2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸阳离子自由基有较强的清除作用,而且能有效缓解H2O2诱导PC-12细胞产生的细胞毒性。Bai Kaikai等[8]通过动物实验发现,口服壳聚糖/壳寡糖纳米硒微球(SeNPs-CS/COS-M)可以有效提升小鼠血清的GSH-Px、SOD和CAT水平,抑制细胞膜脂质和蛋白的氧化,延缓乙醇诱导的氧化应激(图5C),且这些作用与改善硒沉积密切相关(图5D)。在酒精致胃黏膜损伤保护实验[12]和刀豆蛋白A致肝损伤保护实验[27]中,多糖纳米硒可显著提升血清、胃和肝的硒沉积水平和GSH-Px活力(图5E~G),减轻脏器的病变损伤,再次证实多糖纳米硒具有系统性补硒和抗氧化作用。值得注意的是,多糖纳米硒对硒水平和GSH-Px活力的提升作用显著强于其多糖载体和亚硒酸盐(图5D~G),表明纳米硒在提高硒沉积和硒抗氧化酶方面起主导作用[8]。鉴于合成硒蛋白和硒酶需要大量硒代氨基酸,可见多糖纳米硒抗氧化作用的关键在于它可被动物吸收、补充动物机体的硒库,再经过代谢形成硒代胱氨酸、硒代蛋氨酸等硒代氨基酸,进而合成重要含硒抗氧化酶(GSH-Px、CAT、谷胱甘肽转移酶、硫氧还蛋白还原酶等),从而提升机体的抗氧化酶活力。
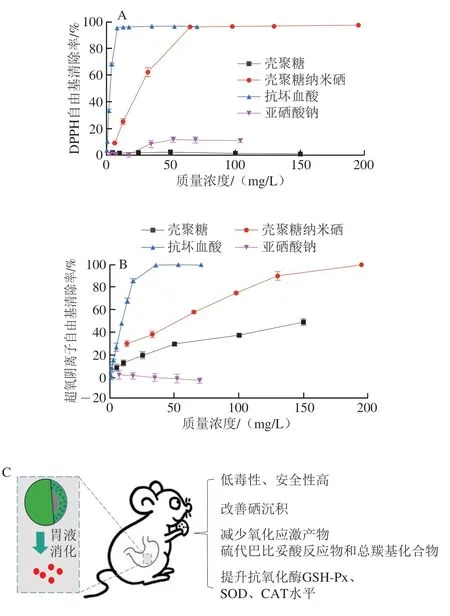
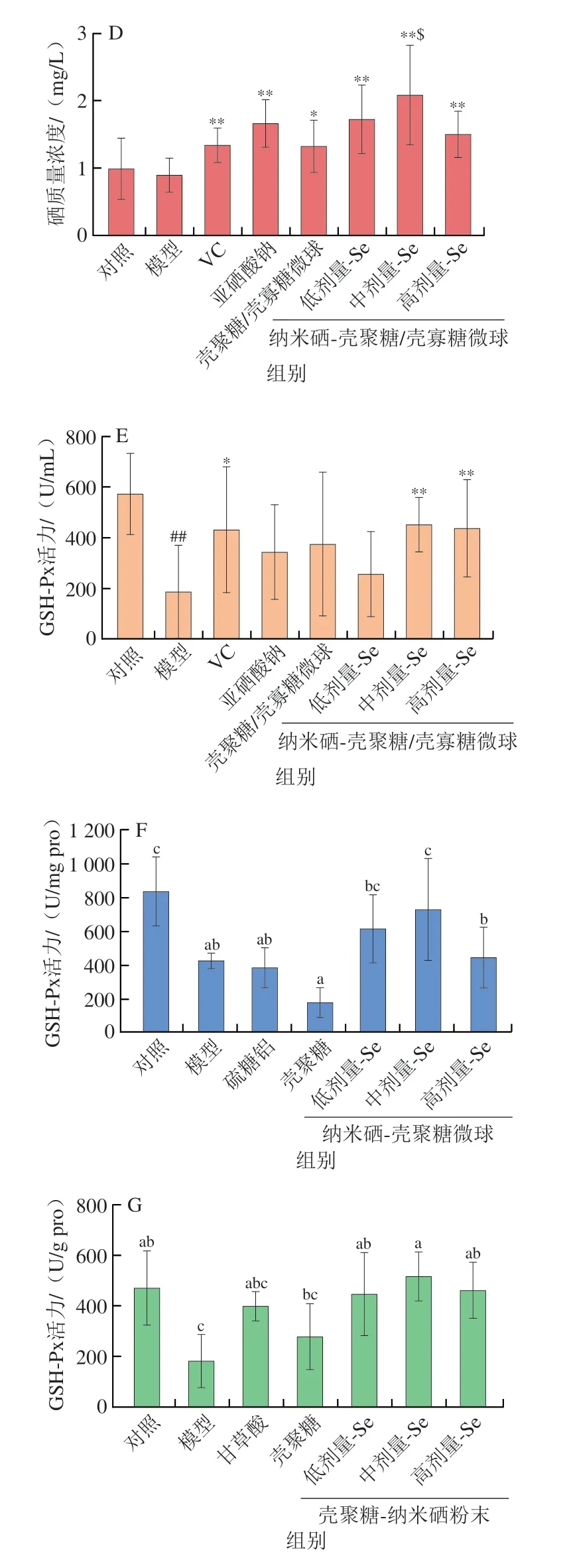
图5 多糖纳米硒的体外和体内抗氧化作用[8,12,27]Fig.5 Antioxidant activities of polysaccharides-SeNPs[8,12,27]
3.2 免疫调节
多糖和硒对动物的非特异性免疫和特异性免疫均具有重要影响。多糖纳米硒能够以硒蛋白和含硒氨基酸的形式参与循环和代谢过程,维持生理机能,并增强吞噬细胞的吞噬功能[10]、提高杀菌能力[47],进而提升非特异性免疫功能。Xia等[47]发现在野生斑马鱼饲料中添加壳聚糖纳米硒(CTS-SeNPs)可提升溶菌酶活性,增强脂多糖和刀豆蛋白A引起的吞噬细胞呼吸爆发反应和脾细胞增殖等免疫反应,其免疫调节作用优于壳聚糖和Na2SeO3,并对嗜水气单胞菌感染有显著的保护作用(图6)。Wang Jianguo等[10]探讨硫酸化灵芝多糖-纳米硒(SPS-SeNPs)的免疫调节能力,发现SPS-SeNPs可通过抑制MAPK和阻断NF-κB信号通路的磷酸化来减少NO的产生,抑制RAW264.7细胞的过度激活,发挥免疫调节的作用。此外,纳米硒也可激活或辅助增强机体的特异性免疫功能,诱导T细胞发生转化和抗原呈递,刺激B细胞产生免疫应答分泌大量抗体,最终刺激或提升细胞免疫和体液免疫效能。Neamat-Allah等[51]给罗非鱼饲喂含纳米硒的饲料,研究纳米硒对罗非鱼抗海豚链球菌感染的效果,发现纳米硒能增加罗非鱼的生长性能指标水平,提升溶菌酶活力,提高免疫球蛋白(immunoglobulin,Ig)M的表达,强化了罗非鱼的免疫调节作用,有效降低了注射海豚链球菌后罗非鱼的死亡率。Mohammadi[52]和Bami[53]等使用绵羊红细胞作为抗原考察纳米硒对肉鸡体液免疫的影响,发现纳米硒可显著提高肉鸡总抗体、IgM和IgG滴度(图7A、B),促进肉鸡的免疫应答和淋巴器官发育,明显提升肉鸡的特异性免疫功能,并发现纳米硒在改善肌肉组织(腿和胸)硒含量、提高抗体水平等方面较亚硒酸盐更具优势。鉴于多糖和硒多糖本身具备的免疫调节功能[54-55],由(硒)多糖与纳米硒组成的多糖纳米硒的免疫调节作用值得更深入的探索。

图6 多糖纳米硒对斑马鱼的免疫增强作用Fig.6 Immunoenhancing effect of polysaccharide-SeNPs on zebrafish
3.3 抗肿瘤
硒营养状态与肿瘤的诱发、进展和恶化密切相关。低硒人群更容易罹患癌症。补硒有利于肿瘤的化学防治,超营养剂量补硒则对化疗具有减毒增效作用[48]。多糖纳米硒抗肿瘤作用主要包括3 个方面:1)对肿瘤细胞的直接杀伤;2)影响肿瘤微环境,破坏肿瘤细胞营养供给;3)提高机体免疫能力。多糖纳米硒可以利用自身抗肿瘤效应和促凋亡机制直接发挥抗肿瘤作用(图8),如Ping Zhaohua等[14]发现黑木耳多糖纳米硒显著提升了MCF-7肿瘤细胞内ROS水平,通过天冬氨酸蛋白水解酶(Caspase)途径诱导MCF-7细胞凋亡。板栗多糖纳米硒则通过增加细胞内ROS含量、阻滞细胞周期、引发线粒体功能障碍等途径诱导HeLa细胞凋亡[42](图8)。此外,采用特异性配体对多糖纳米硒进行功能化,可进一步提高纳米硒的靶向能力;多糖纳米硒也可作为递送载体协同其他抗肿瘤药物共同发挥作用,增强对肿瘤细胞的杀伤力,如纳米硒协同放化疗[56]、协同免疫治疗[57]等。Zeng Lilan等[56]构建了半乳糖胺修饰的纳米硒负载抗肿瘤药物Fe(PiP)3,利用配体与细胞膜特异性受体之间的靶向识别和结合效应,显著增强了细胞对纳米药物的摄取,提升了抗肿瘤功效。陈填烽等[57]发现香菇多糖纳米硒能提高机体免疫功能、激活免疫应答、降低肺癌相关标志物的表达量、激活被抑制的免疫微环境,从激活免疫力的角度发掘多糖纳米硒的抗肿瘤功能,有助于肺癌恶性胸腔积液的治疗。
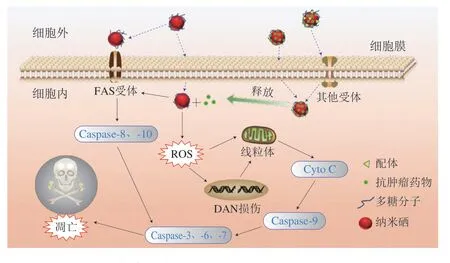
图8 功能化多糖纳米硒诱导细胞凋亡的可能机制Fig.8 Possible mechanisms of tumor cell apoptosis induced by functionalized polysaccharide-SeNPs
4 多糖纳米硒的应用
多糖纳米硒的生物安全性优于传统的硒强化剂[8-10],具有明显的硒营养强化效应和多种生理功能[39,42],可应用于农用肥料[58]、饲料[59]、食品包装材料[60]和药物递送载体[57]等领域。本文聚焦多糖纳米硒的营养强化功能及其在农副业和食品工业方面的应用。
4.1 农业富硒肥料和农药
施用硒肥可增加土壤中的硒浓度,使植物吸收利用硒并转化为有机硒,并可一定程度提高植物的生长性能和抗病力。胡万行等[61]用纳米硒溶液喷洒马铃薯的叶面,发现喷施纳米硒后的马铃薯各器官硒含量增加,同时马铃薯品质显著提高,生长状态得到明显改善。可见,施加多糖纳米硒是生产富硒农副产品的有效途径之一。Wu Zilin[62]和刘嘉伟[63]等的研究则表明,纳米硒可抑制农业生产中害虫的生长和繁殖,并可作为其他农药的载体,用于灰霉病的预防与抑制。Perfileva等[64]发现阿拉伯半乳聚糖纳米硒对密西根棒状杆菌具有显著的杀菌作用,对马铃薯环腐病的防治效果显著。总体而言,纳米硒肥料对农业种植的增益效果是多维度的:1)可作为硒补充剂以肥料的形式供给农作物,形成富硒农产品;2)可调节农作物生长,提高抗病力,增加农作物对土壤环境的适应能力;3)可刺激土壤有机质以及腐殖酸物质的释放,降低土壤重金属胁迫,改善土壤。
4.2 畜牧业、渔业富硒饲料
在饲料中添加多糖纳米硒不但能有效提升动物产品的硒含量,而且能改善动物的生长和发育,是提升蛋、奶和肉制品品质的一种新技术手段。研究表明,将利用从鲍鱼内脏提取的多糖-蛋白复合物(polysaccharideprotein complex,PSP)制备的PSP-SeNPs添加到罗非鱼饲料中,可显著促进罗非鱼的生长,其作用机制与纳米硒诱导的鱼类抗氧化防御能力增强和生长激素水平升高有关[44]。Abdullah等[65]的研究表明,纳米硒和VE协同使用能有效提升肉鸡胴体理化性能,改善血液中大部分生化指标和免疫性能。多糖纳米硒能有效提升家禽家畜体内硒含量、抗病力、生殖能力,可作为一种硒营养剂添加到动物饲料中。
4.3 富硒功能食品
纳米硒的高安全性已被较多研究报道,其可作为一种有效的硒营养强化剂,用于功能食品和保健食品的制备。张劲松等[66]研发的“硒旺胶囊”是以纳米硒、蛋白和淀粉为主要原料的一种高效补硒产品,具有免疫调节、延缓衰老等保健作用。壳聚糖/壳寡糖纳米硒可显著提高血液和肝组织的硒水平,对D-半乳糖引起的氧化衰老[36]和过量摄入酒精引起的氧化性损伤[12]有显著的预防效果,对高浓度酒精引起的胃黏膜损伤和刀豆蛋白A引起的化学/免疫性肝损伤均有辅助保护作用,表明壳聚糖/壳寡糖纳米硒具有抗氧化、胃黏膜损伤辅助保护和肝损伤辅助保护等保健功能,有望进一步开发成为功能食品或保健食品。杨雪[31]证明枸杞多糖-纳米硒(LBPSeNPs)可通过提高抗氧化酶水平和调节代谢机制来抑制有害代谢物的积累,增加糖原储备,显著延长小鼠游泳时间,具备缓解体力疲劳的功效。以纳米硒为原料的营养补充剂及功能性食品逐渐成为研发富硒食品的新关注点。
4.4 食品包装
良好的食品包装是食品得以稳定贮藏、运输的关键一环。安全性高、抗菌性能优异的包装材料对于食物保鲜至关重要。纳米硒和多糖本身具有一定的抗菌作用,二者有机结合形成的多糖纳米硒可进一步提高包装材料的抗菌性能[67]。Rangrazi等[68]的研究表明,壳聚糖纳米硒对革兰氏阳性菌(金葡球菌、血链球菌和粪肠球菌)展现出良好的抗菌活性,但对革兰氏阴性菌抑菌作用较弱。除了抗菌性能,纳米硒还可以改善食品包装的透湿性、氧气隔绝、纵向拉伸性等性能,提升包装效果[69]。然而,添加在食品包装材料中的纳米硒向食品中渗入、迁移所造成的食品安全隐患也需要引起注意。Vera等[70]将纳米硒加入到柔性多层塑料材料中,并在为期10 d的迁移实验中未观察到硒迁移到榛子或油性食品模拟物中。肖锡湘[69]则发现在普通包装材料中添加的纳米硒在多种食品模拟物中的迁移机制符合菲克扩散定律,且温度越高,纳米硒迁移量越大,表明纳米硒包装材料的实际应用会受到温度的限制。考虑到纳米硒在安全剂量内可以被人体安全吸收[59],多糖纳米硒作为食品包装抗菌粒子的应用前景值得期待。
5 多糖纳米硒应用于食品营养强化所面临的挑战
多糖纳米硒具备开发成为食品添加剂、功能食品和保健食品的潜力。然而,纳米硒引发的安全性问题、多糖的合理选择、活性作用机制不明和评价技术体系不合理等问题,仍然限制着多糖纳米硒在硒营养强化方面的应用。
5.1 纳米硒的安全性
尽管已有较多动物实验证明纳米硒的安全性明显优于传统补硒剂[12],但是公众对纳米材料暴露于人可能产生健康风险的担忧与日俱增。特别是公众对纳米硒在体内的吸收和代谢过程,及其对人体健康的潜在威胁不甚了解。目前,纳米硒尚未进入我国的保健食品原料名录和营养强化剂化合物来源名录,但已有纳米硒保健食品“硒旺胶囊”上市多年,且鲜见有关其安全性的不良报道,可见纳米硒具备安全性。与蛋白纳米硒相比,多糖纳米硒似乎呈现出相似或者更高的生物安全性,有望应用于食品领域,但仍需加强研究以提升其安全性。
5.2 多糖的选择
多糖的分子质量、官能团、糖链构型等结构特点对纳米硒的尺寸、形貌、表面荷电、表面亲水/疏水性能等理化性质影响较大,对纳米硒的稳定性和生物学活性也具有深远影响,并最终影响多糖纳米硒的整体功效[15]。目前,对多糖纳米硒的研究逐渐增多,但是针对多糖纳米硒“结构-生物活性”关系的系统性研究仍然较少,比如多糖的结构对于纳米硒在胃肠道吸收、细胞内化、代谢转化等过程的影响尚不清楚,不利于指导筛选合适的多糖。此外,应注意选择生物相容性较好、可在胃肠道内降解或分散、具有食用功能的多糖,在改善纳米硒稳定性的同时,保障纳米硒的可释放性[29]。
5.3 多糖纳米硒的评价技术体系和质量标准
纳米材料具有纳米尺度特征,其生物学效应及其变化规律有别于一般的食品组分或化合物,如纳米材料的剂量-反应曲线呈“钟形”分布,表现为生物效应随着剂量增加而先增强后减弱[71],与普通的小分子营养物质或药物的“S形”分布差异明显。这是因为纳米材料的生物效应不仅来源于其化学组分,而且受制于纳米尺寸产生的特殊物理结构和性质,如尺寸、形状、表面性质等[72]。此外,多糖纳米硒是以整体存在的纳米体系,多糖和纳米硒共同作用,发挥整体功效,而不能将纳米硒孤立出来评价其对多糖纳米硒生物学效应的贡献。因此,应针对多糖纳米硒的特点建立更合理的评价技术体系,并以此为基础构建多糖纳米硒的产品质量标准和评价技术标准,规范多糖纳米硒产品的研发和应用。
6 结语
纳米硒相比于传统有机硒和无机硒具有安全性高、吸收性好、生物活性多样等优势,同时具备载药能力,成为硒营养科学和纳米药物载体的研究热点。然而,纳米硒易团聚、稳定性差,导致生物活性严重削弱,限制了其进一步开发应用。采用化学还原法制备纳米硒,在制备过程中加入多糖进行调控,可控制纳米硒的尺寸和形貌,并能有效提升纳米硒的稳定性。多糖的种类和结构特性(链构型、官能团、分子质量和表面荷电性能等)对于纳米硒的理化性质和生物活性具有显著影响。多糖纳米硒兼具纳米硒和多糖的生物活性,可有效提升机体硒水平,在抗氧化、免疫调节和抗肿瘤方面效果显著,在富硒肥料和农药、动物饲料、富硒功能食品、食品包装等食品相关领域展现出广阔的应用前景。多糖纳米硒应用于食品营养强化方面仍面临着诸如提升安全性、选择适宜的多糖以及建立合理的评价技术体系和质量标准等挑战。综上,多糖纳米硒在食品营养强化领域具有良好的发展前景,并取得一定的进展,但仍面临不少技术难题,需要进一步研究与探讨。
