乌鸡肽对葡聚糖硫酸钠诱导的溃疡性结肠炎小鼠的保护作用
2023-11-07彭春彦魏林峰涂宗财
邓 梅,张 露,,*,罗 晶,彭春彦,丁 翘,芦 玲,魏林峰,涂宗财,3
(1.江西师范大学生命科学学院,国家淡水鱼加工技术研发专业中心,江西 南昌 330022;2.江西德上制药股份有限公司,江西 樟树 331200;3.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
溃疡性结肠炎(ulcerative colitis,UC)是一种复发性炎症性肠病,作为炎症性肠病的主要类型之一,UC的主要特征表现为体质量减轻、腹痛、腹泻和便血[1]。尽管UC在西方国家更为普遍,但近年来发展中国家的UC发病率也急剧增加,这导致UC成为21世纪全球健康问题之一[2]。UC的发生与多种因素密切相关,包括遗传因素、环境因素、免疫调节、肠道微生物和生活方式等,其确切的发病机制仍尚未明确,且目前还未找到有效的治愈方式[3]。常规的UC干预药物包括皮质类固醇、5-氨基水杨酸、免疫抑制剂和抗生素等,但效果有限并伴有一系列的副作用,长期服用产生的毒性也会限制其疗效[4]。因此,探索安全有效的预防或改善UC的方式至关重要。
近年来,越来越多的研究表明,食物中的许多活性成分,例如多酚、多糖、膳食纤维以及多肽等,均可积极地影响免疫反应、肠道屏障功能和肠道微生物构成,并进一步改善肠炎损伤症状[5]。食源性生物活性肽通常指通过酶解食物蛋白质产生的具有生理调节功能的寡肽或多肽,可通过与肠道菌群相互作用对人体产生有益作用,主要体现在降血脂、调节血压、抗衰老以及抗肠道炎症等方面,具有良好的安全性、吸收性和营养价值[6]。已有研究表明,生物活性肽可能参与调节肠道菌群组成,进而参与免疫反应,维持肠道健康,有利于炎症性肠病患者的康复[7]。研究发现,鸡卵清肽可通过调节肠道菌群构成,显著增加Candidatus saccharimonas和Lactobacillus等有益菌属的丰度,减轻葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导的结肠炎模型小鼠的结肠炎症状[5]。
乌骨鸡(Gallus gallus domesticlusBrisson)又名乌鸡、丝毛乌骨鸡等,属雉科动物,是我国传统的药食两用鸡种[8-9]。研究表明,乌骨鸡肉中含有蛋白质、脂肪酸、黑色素、矿物质和微量元素等营养素[10],具有提高免疫力、改善虚弱和消瘦、缓解月经异常和产后并发症等药用特性[11-12]。乌鸡肽是乌鸡肉经酶解后获得的蛋白酶解液,其中的小分子肽不需要进行额外的消化便可被人体吸收,其吸收更具完整性和主动性[13]。研究发现,乌鸡肽具有抗氧化、抗衰老、降血压、补血等多种生理活性[14],但目前还鲜有关于乌鸡肽结肠炎保护作用及其潜在机制的研究报道。
因此,本研究采用DSS构建结肠炎小鼠模型,通过比较小鼠体质量、血便、腹泻、结肠长度、炎症因子、结肠组织病理、肠道微生物构成以及短链脂肪酸含量等生化和病理指标的变化,探究乌鸡肽对DSS诱导的结肠炎小鼠的保护作用,并从肠道菌群变化角度初步分析其作用机制,为乌鸡肽的高值化利用提供参考依据和理论指导。
1 材料与方法
1.1 动物、材料与试剂
C57BL/6J雄性小鼠,7 周龄,体质量为(20±2)g,SPF级,购自北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2021-0006。小鼠饲养在温度22~24 ℃、相对湿度60%~80%、12 h/12 h明暗交替的环境中,实验获得南昌大学动物实验管理委员会批准(批准编号:0064257)。
乌鸡肽 江西倍得力生物工程有限公司;DSS 美国MP Biomedical公司;粪便隐血试剂盒 珠海贝索生物技术有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、IL-10、IL-1β、BCA蛋白浓度试剂盒 江苏酶免实业有限公司;苏木素-伊红(hematoxylin-eosin,HE)染液套装武汉赛维尔生物科技有限公司;4%多聚甲醛通用型组织固定液 合肥Biosharop公司;柳氮磺吡啶肠溶片上海信谊天平药业有限公司。
1.2 仪器与设备
Synergy H1酶标仪 美国伯腾仪器有限公司;HYQX-II厌氧培养箱 上海跃进医疗器械有限公司;5430R冷冻离心机 德国艾本德公司;超滤离心管美国Millipore公司;JB-P5包埋机 武汉俊杰电子有限公司;RM2016病理切片机 德国徕卡仪器有限公司。
1.3 方法
1.3.1 乌鸡肽基本成分分析、分子质量分布以及氨基酸组成测定
参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中凯氏定氮法测定乌鸡肽中蛋白质量分数;参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中水分测定仪法测定乌鸡肽的水分质量分数;参照GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》测定乌鸡肽的灰分质量分数;参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》中的索氏抽提法测定乌鸡肽的总脂肪质量分数;参照GB 31645—2018《食品安全国家标准 胶原蛋白肽》中高效分子排阻色谱法测定乌鸡肽的分子质量分布;采用全自动氨基酸分析仪测定乌鸡肽的氨基酸组成[15]。
1.3.2 动物实验分组及模型的建立
参照邓代霞等[16]的方法构建小鼠UC模型。55 只7 周龄C57BL/6J雄性小鼠自由饮水进食适应性喂养7 d,每天混匀所有垫料再分配至各笼使初期各组小鼠肠道菌群组成基本一致。然后按照体质量分为5 组(n=11),包括正常组(CG)、模型组(MG)、柳氮黄吡啶组(PG)、乌鸡肽低剂量组(LG)、乌鸡肽高剂量组(HG)。正常组自由饮水,其他各组用3%(质量分数,下同)DSS溶液代替,持续14 d构建UC模型,同时每天进行给药干预,其中正常组和模型组灌胃生理盐水,阳性对照组灌胃40 mg/(kgmb·d)柳氮黄吡啶,乌鸡肽低剂量和高剂量组分别灌胃100、200 mg/(kgmb·d)乌鸡肽。饲养期间每天定时称小鼠体质量并观察便血情况,同时记录疾病活动指数(disease activity index,DAI)评分。实验末期,小鼠摘眼球取血后脱颈处死,迅速取出结肠及其内容物、盲肠内容物并量取结肠长度。结肠分成3 份,一份浸泡于4%多聚甲醛中,2 份置于-80 ℃冰箱中保存备用。
1.3.3 小鼠体质量变化率、结肠长度测定及DAI评分
实验过程中,每天灌胃前称量小鼠体质量,采用粪便隐血试剂盒测定便血评分,根据夏圣坤等[17]的方法计算DAI,三者得分的平均值即为小鼠最终DAI评分,具体细则如表1所示。小鼠处死后测量每只小鼠结肠长度。按下式计算体质量变化率。

表1 DAI评分标准Table 1 Criteria for DAI scoring
1.3.4 结肠组织病理学观察
取固定于4%多聚甲醛溶液中的结肠组织,脱水、包埋、切片,之后使用HE进行染色并在光学显微镜下观察切片,分析其病理损伤情况。
1.3.5 结肠组织炎症因子的测定
取适量结肠样本,按照料液比1∶9加入预冷的生理盐水,匀浆离心后取上清液,根据BCA蛋白浓度试剂盒以及炎症因子试剂盒说明书测定蛋白含量和炎症因子TNF-α、IL-6、IL-10和IL-1β的含量。
1.3.6 肠道微生物组成的测定
将小鼠结肠内容物送至上海派森诺生物科技有限公司进行高通量测序。测序引物序列为F:5’-ACTCCTACGGGAGGCAGCA-3’,R:5’-GGACTACHVGGGTWTCTAAT-3’,测序区域16S_V3~V4。基于上海派森诺生物科技有限公司旗下派森诺基因云平台(https://www.genescloud.cn/home)进行生物信息分析。
1.3.7 盲肠内容物中短链脂肪酸含量的测定
称取300 mg解冻后的小鼠盲肠内容物于离心管中,加入1.0 mL甲基叔丁基醚,再加入体积分数2.0%浓盐酸,充分碾磨、涡旋混匀,再于冰水浴中超声5 min,最后4 ℃、10 000 r/min离心10 min,取上清液过0.22 μm滤膜,加入1%二乙基丁酸(10 mg/mL)作为内标,于棕色进样瓶中待测。
气相色谱分析条件:DB-FFAD 色谱柱(30 m×0.25 mm,0.25 μm);程序升温参数为:起始温度60 ℃,保持5 min后以10 ℃/min升温至160 ℃,维持2 min,最后以20 ℃/min升温至220 ℃,维持5 min;进样口温度为220 ℃,进样体积为1.2 μL,载气为氮气,吹扫流量3.0 mL/min,分流比为10∶1;火焰离子化检测器(flame ionization detector,FID)温度为250 ℃,尾气为氮气,尾气流量为30 mL/min,氢气流量为35 mL/min,空气流量400 mL/min[18]。
1.4 数据统计与分析
采用SPSS 22.0软件对实验数据进行分析,所有数据以平均值±标准差表示,除微生物数据每组5 个平行外,其余数据每组8 个平行,数据间的显著性采用Tukey单因素方差分析(one-way analysis of variance,ANOVA),显著水平为P<0.05,采用Origin 2019软件作图。
2 结果与分析
2.1 乌鸡肽的分子质量和氨基酸组成
乌鸡肽中蛋白质量分数为(80.06±0.44)%,水分、灰分和粗脂肪质量分数分别为(3.72±0.67)%、(9.03±0.53)%和(13.00±0.71)%。由图1可知,乌鸡肽主要由5 种不同分子质量的多肽片段组成,191~321、321~787、787~1 849、1 849~3 167 Da和3 167~7 967 Da的多肽相对含量分别为6.66%、34.76%、31.56%、13.07%和9.05%,其中3 200 Da以下的多肽占86.05%。由表2可知,共从乌鸡肽样品中鉴定出17 种氨基酸,其中必需氨基酸7 种,相对含量为23.77%;疏水性氨基酸7 种,相对含量为27.02%;带正电氨基酸3 种,相对含量为14.07%。氨基酸组成、残基类型以及疏水性均对多肽的生物活性有一定的影响,在肽段中带正电荷的氨基酸(例如精氨酸、赖氨酸)以及疏水性氨基酸对抗炎活性均具有促进作用[19]。
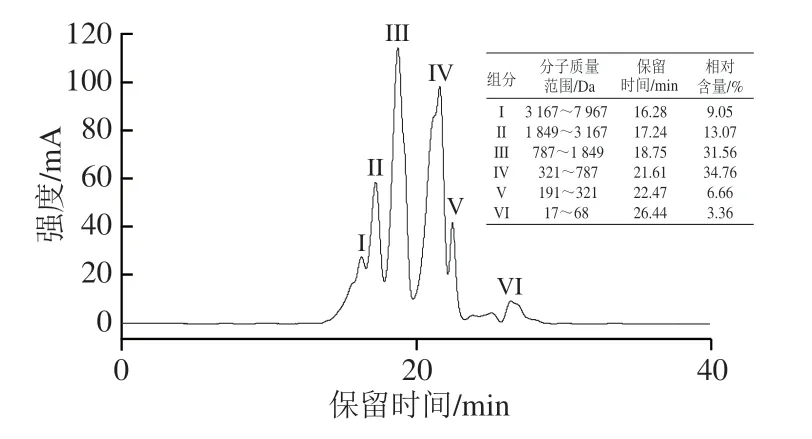
图1 乌鸡肽分子质量分布Fig.1 Molecular mass distribution of G.gallus domesticlus Brisson peptides
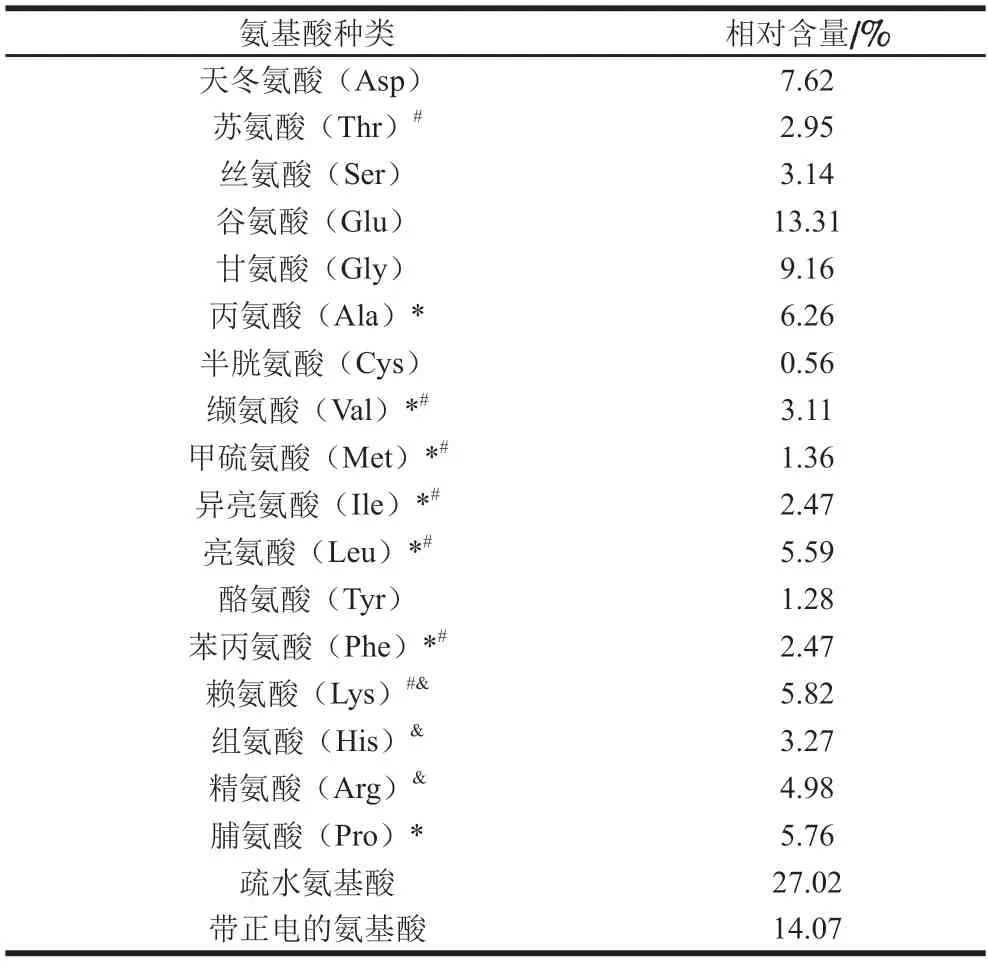
表2 乌鸡肽的氨基酸组成Table 2 Amino acid composition of G.gallus domesticlus Brisson peptides
2.2 乌鸡肽对结肠炎小鼠体质量和DAI评分的影响
结肠炎小鼠的常规症状主要表现为体质量减轻、腹泻、肠道出血、结肠缩短以及黏膜溃疡等[4]。由图2A可知,各组的平均初始体质量没有显著差异,正常组小鼠的体质量在整个实验期间呈逐渐上升趋势,而模型组、阳性对照组、乌鸡肽低剂量组和高剂量组小鼠的体质量从第6天开始明显降低,且逐渐有便血情况出现。第14天时,正常组小鼠的体质量变化率为(110.61±2.59)%,而模型组小鼠的体质量降低至初始体质量的(78.54±5.75)%;乌鸡肽干预后,与模型组相比,乌鸡肽低剂量组和高剂量组小鼠体质量均有所增加,分别增加至初始体质量的(90.16±2.93)%和(92.03±2.54)%,说明乌鸡肽具有一定的缓解结肠炎小鼠体质量减轻的效果。

图2 乌鸡肽对结肠炎小鼠体质量(A)和DAI评分(B)的影响(n=8)Fig.2 Effects of G.gallus domesticlus Brisson peptides on the body mass (A) and disease activity index score (B) of UC mice (n=8)
DAI评分常用于评估DSS诱导结肠炎的严重程度[20]。如图2B所示,第14天时模型组的DAI评分(2.59±0.17)高度显著高于正常组(0.33±0.00)(P<0.001),通过体质量和DAI评分结果可判定模型构建成功。乌鸡肽干预12 d后,乌鸡肽干预组小鼠的DAI评分高度显著低于模型组(P<0.001),至第14天,乌鸡肽低剂量组、高剂量组与阳性对照组之间没有明显差异。因此,乌鸡肽在缓解DSS诱导的结肠炎小鼠体质量减轻、腹泻和便血方面显示出潜在的保护作用,这与Yang Wenting等[7]使用大米蛋白肽干预DSS诱导结肠炎小鼠的效果一致。明珠等[21]使用肠道炎症临床治疗药物柳氮磺吡啶对UC模型小鼠进行干预,发现柳氮磺吡啶处理组结肠炎小鼠的体质量更趋近正常小鼠,本研究中柳氮磺吡啶干预后结肠炎小鼠体质量减轻得到缓解的结果与之一致。
2.3 乌鸡肽对小鼠结肠长度及病理学的影响
结肠缩短是DSS诱导结肠炎症的另一显著特征。如图3A、B所示,与正常组相比,模型组小鼠结肠长度((5.40±0.50)cm)显著缩短了3.09 cm(P<0.05),采用乌鸡肽干预后,低剂量组与高剂量组小鼠的结肠长度分别恢复到(6.72±0.56)cm和(7.00±0.41)cm,均显著高于模型组(P<0.05),此外也发现乌鸡肽干预后小鼠的结肠长度同样高于阳性对照((6.38±0.47)cm)。综上,补充乌鸡肽缓解了DSS诱导的结肠炎结肠缩短和肠道疾病症状。这可能与乌鸡肽中存在的疏水氨基酸有关,疏水氨基酸可以增强细胞膜与多肽之间的相互作用,有利于生物活性肽参与细胞内信号通路的调节,从而达到抗炎效果[19]。

图3 小鼠结肠图片(A)、结肠长度(B)和结肠组织HE染色(200×)(C)(n=8)Fig.3 Mouse colon photographs (A),colon length (B),and HE stained colon tissue (200 ×) (C) (n=8)
采用HE染色对结肠组织切片进行病理学观察,如图3C所示,正常组小鼠的结肠组织结构完整,可以观察到完整的上皮和隐窝,炎性细胞浸润极少,黏膜层肠腺丰富,黏膜下层未出现病理损伤。模型组小鼠的结肠组织出现黏膜上皮和肠腺结构缺失和黏膜下水肿,黏膜和黏膜下层出现严重的炎性细胞浸润。乌鸡肽和柳氮磺吡啶干预后结肠损伤情况有所改善,主要表现为隐窝缩短减轻、黏膜损伤减轻以及黏膜下炎症细胞浸润减少,表明乌鸡肽干预可减轻肠炎小鼠的结肠损伤程度。Li Lingyu等[4]发现皮蛋蛋白可以减少结肠黏膜损伤、缓解隐窝缩短以及减少炎症细胞浸润,从而改善DSS诱导的结肠炎小鼠结肠组织学损伤,并且其可以通过抑制核因子κB p65(nuclear factor-kappa B p65,NF-κB p65)和p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)蛋白磷酸化,抑制促炎细胞因子的分泌和基因表达。
2.4 乌鸡肽对小鼠结肠组织中炎症因子分泌的影响
炎症的发生和加重是一个复杂的过程,与巨噬细胞的病原体活化密切相关,活化的巨噬细胞会产生细胞因子,其中TNF-α和IL(IL-6、IL-1β)等被认为是引发炎症的关键因子,IL-10是一种具有抗炎特性的细胞因子[7]。因此,本研究采用酶联免疫吸附测定法测定结肠组织中炎症因子TNF-α、IL-1β、IL-6和IL-10的表达,结果如图4A~D所示。与正常组相比,DSS处理显著增加了小鼠结肠组织中促炎因子TNF-α((216.46±22.38)pg/mg pro)和IL-6((29.64±1.80)pg/mg pro)(P<0.05)的含量,使IL-1β的含量((19.37±1.95)pg/mg pro)有所上升,并使IL-10的含量((168.49±31.96)pg/mg pro)有所下降,但无显著变化(P>0.05)。与模型组相比,乌鸡肽低剂量组和高剂量组小鼠结肠中TNF-α和IL-6含量均显著降低(P<0.05),其中TNF-α含量分别降低至(166.66±23.98)pg/mg pro和(156.88±19.83)pg/mg pro,IL-6含量分别降低至(22.71±3.47)pg/mg pro和(23.39±3.74)pg/mg pro。与模型组相比,乌鸡肽低剂量组((13.24±1.51)pg/mg pro)和阳性对照组中IL-1β含量显著降低(P<0.05),而高剂量组((15.05±2.66)pg/mg pro)与之无显著差异(P>0.05)。另外,乌鸡肽处理组结肠组织中TNF-α、IL-1β和IL-6含量与阳性对照组相比均无显著性差异(P>0.05)。以上结果表明,乌鸡肽可通过抑制促炎因子TNF-α和IL-6的产生而起到抗炎作用。有研究发现大豆生物活性肽同样具有抑制炎症因子TNF-α和IL-1β分泌的作用,从而降低结肠炎症水平[19]。
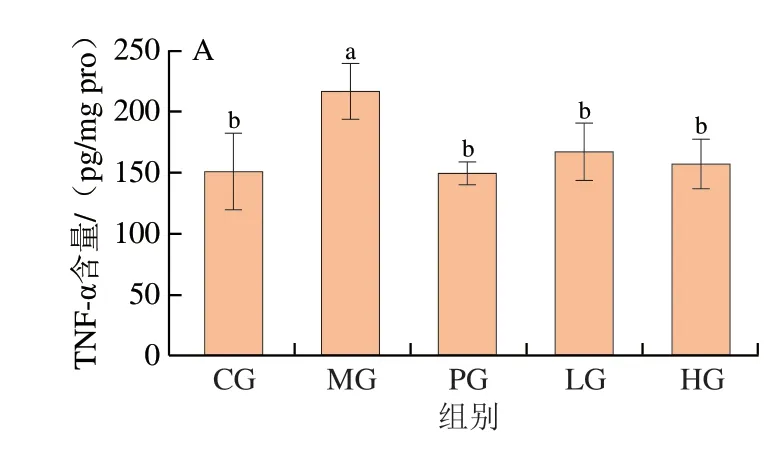
图4 小鼠结肠组织中炎症因子的含量(n=8)Fig.4 Contents of inflammatory factors in mouse colon tissue (n=8)
2.5 乌鸡肽对结肠炎小鼠肠道微生物的影响
2.5.1 肠道微生物多样性
由表3可知,各组小鼠的Coverage指数均大于0.99,表明样本覆盖率高,可以反映肠道微生物的真实情况。Shannon指数和Simpson指数常用于评价肠道微生物的多样性,Shannon指数越大,表示多样性越高,Simpson指数则相反[20]。由表3可知,与模型组相比,乌鸡肽干预的结肠炎小鼠Shannon指数升高(P>0.05),而高剂量组的Simpson指数下降(P>0.05),说明乌鸡肽干预可增加DSS诱导的结肠炎小鼠肠道微生物多样性。
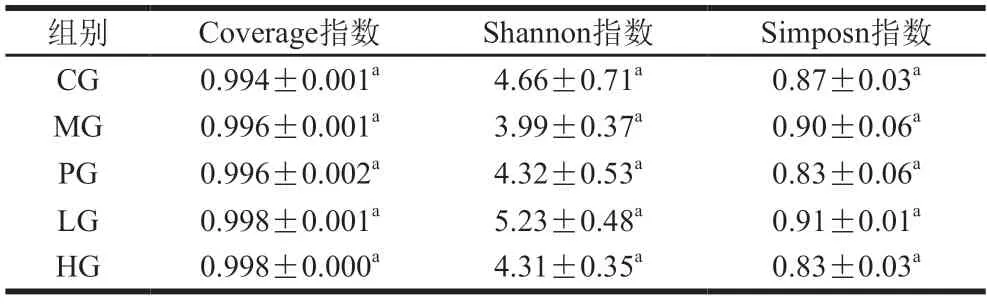
表3 小鼠肠道微生物多样性变化(n=5)Table 3 Changes of intestinal microbial diversity in mice (n=5)
2.5.2 门水平肠道微生物丰度变化
如图5A所示,机体中98%的肠道菌群是由拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)和放线菌门(Actinobacterota)组成。在正常组中,小鼠肠道微生物主要由Bacteroidetes(52.17%)、Firmicutes(40.92%)、Verrucomicrobia(5.62%)3 个优势菌门组成。模型组中Proteobacteria、Verrucomicrobia的相对丰度有所增加,Bacteroidetes的相对丰度降低,其中Proteobacteria的相对丰度增加最显著,从正常组的0.47%增加到了33.73%。研究发现,Proteobacteria是肠道菌群失调的微生物标志物,Proteobacteria相对丰度的异常增加会使得缺乏Toll样受体-5(Toll-like receptor 5,TLR-5)的小鼠出现自发性的结肠炎和菌群失调症状,从而出现结肠黏膜层紊乱[22]。与模型组相比,乌鸡肽的干预可增加Verrucomicrobia的相对丰度,降低Proteobacteria的相对丰度,这与Li Lingyu等[4]用蛋清干预DSS诱导的小鼠结肠炎肠道微生物的变化一致。
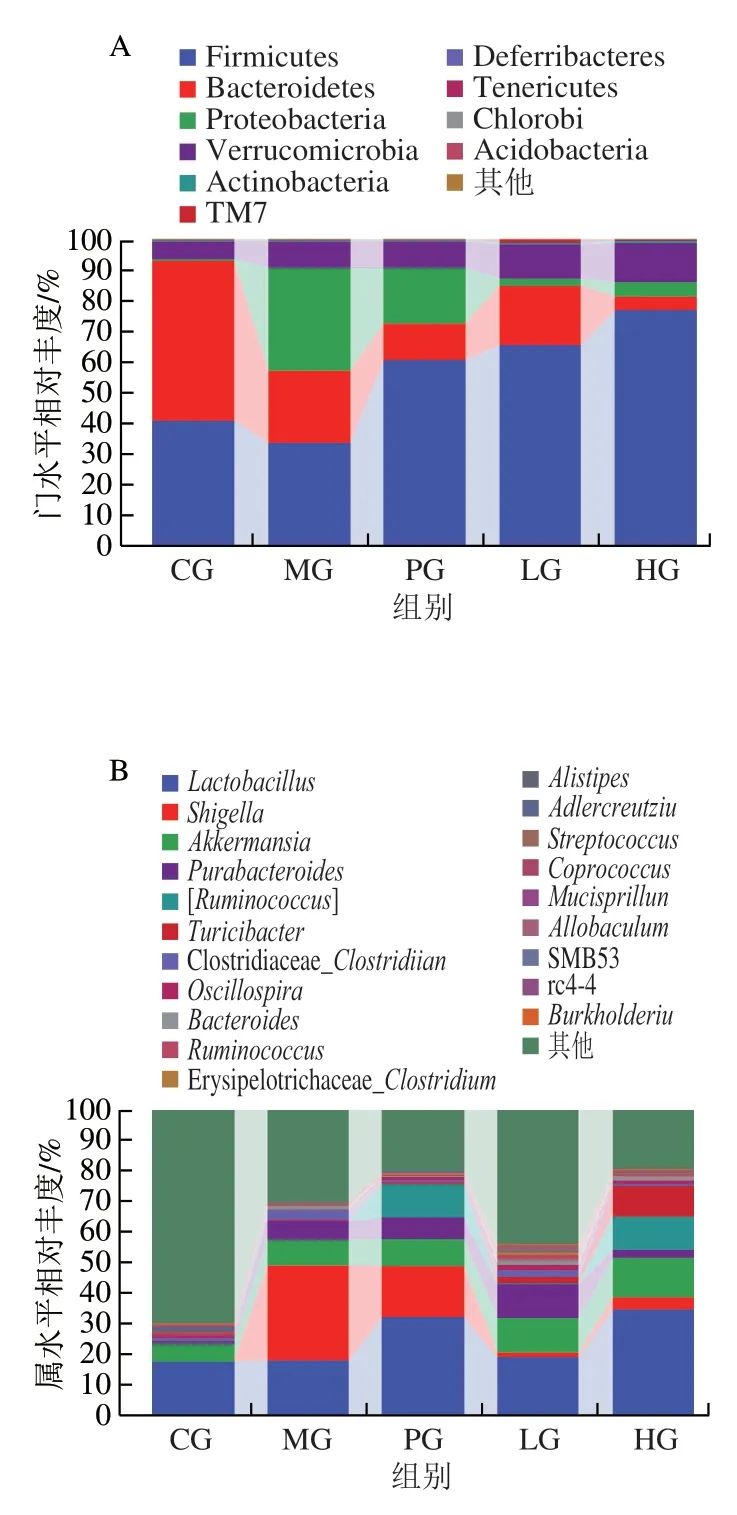

图5 小鼠肠道微生物差异分析(n=5)Fig.5 Analysis of intestinal microflora differences in mice (n=5)
2.5.3 属水平肠道微生物丰度变化
结肠炎常伴随致病菌丰度的增加和有益菌丰度的减少,志贺菌(Shigella)是常见的食源性病原菌,可引起结肠水肿、溃疡等一系列症状;Clostridiaceae是条件致病菌,被认为是引起腹泻和结肠炎的主要原因之一[23];瘤胃球菌(Ruminococcus)和颤螺菌(Oscillospira)分别是属于毛螺菌科和瘤胃菌科潜在的益生菌,与肠道炎症息息相关,其代谢产物乙酸或丁酸可以抑制肠道炎症[24-25];阿克曼菌(Akkermansia)是一种常见的肠道共生菌,在修复黏膜上皮、缓解炎症反应以及改善自身免疫中发挥积极作用[26]。
如图5B、D~H所示,各组小鼠肠道微生物的相对丰度在属水平上存在差异。与正常组比,模型组小鼠Akkermansia、Shigella和Clostridiaceae_Clostridium的相对丰度分别升高了2.82、30.95 个百分点和2.33 个百分点,Oscillospira的相对丰度下降了0.67 个百分点,说明DSS导致小鼠肠道微生物有益菌和有害菌相对丰度失调。Mo Jianling等[20]发现DSS诱导的小鼠Escherichia_Shigella的丰度显著升高。通过乌鸡肽干预,低剂量和高剂量组的有益菌Akkermansia、Ruminococcus和Oscillospira的相对丰度高于模型组,其中Akkermansia相对丰度分别升高了2.72、4.49 个百分点、Ruminococcus相对丰度分别升高了0.20、10.78 个百分点、Oscillospira相对丰度分别升高了1.65、0.85 个百分点,但低剂量组Ruminococcus相对丰度与模型组无显著差异(P>0.05)。通过乌鸡肽干预,有害菌Shigella和Clostridiaceae的相对丰度得到了有效控制,乌鸡肽低剂量组和高剂量组Shigella的相对丰度分别比模型组降低了29.26、27.04 个百分点,Clostridiaceae相对分度分别比模型组降低了1.10、2.52 个百分点,表明乌鸡肽可以通过减少有害菌的相对丰度、增加有益菌的相对丰度缓解结肠炎小鼠的结肠炎症状。有研究发现桑葚花青素可通过降低有害菌Escherichia_Shigella、上调潜在有益细菌Akkermansia的相对丰度来调节肠道微生物菌群的结构,从而增强肠道屏障功能[20]。
2.5.4 肠道微生物属水平热图分析
通过属水平群落组分相似度的物种组成热图统计分析(图5C)可以看出,正常组、模型组和乌鸡肽干预组小鼠的肠道微生物结构之间存在明显差异。同时,根据进化关系及颜色变化可发现,乌鸡肽低剂量组、高剂量组、阳性对照组、模型组小鼠的肠道菌群相对丰度与正常组具有明显差异,乌鸡肽高剂量组与阳性对照组的优势菌群结构更相似,进一步证明乌鸡肽可以改变结肠炎小鼠肠道微生物的相对丰度。
2.6 乌鸡肽对结肠炎小鼠盲肠内容物中短链脂肪酸的影响
短链脂肪酸是肠道微生物的代谢产物,是促进宿主与肠道微生物之间建立互利关系的关键因素,可参与机体的免疫调节、促进肠道消化吸收、保持肠道屏障完整等,与肠道疾病密切相关。肠道中的短链脂肪酸主要由乙酸、丙酸以及丁酸组成,而丁酸盐被多次证明是肠上皮细胞维持肠道屏障的必需能量来源,丁酸含量的降低会破环肠道屏障,增加肠道炎症发生的风险[27-28]。
如表4所示,模型组盲肠内容物中总短链脂肪酸含量显著低于正常组(P<0.05),其中乙酸、丙酸和丁酸含量降低最为明显,从正常组的(1.04±0.06)、(0.42±0.07)、(2.73±0.13)mg/g分别下降至(0.39±0.04)、(0.16±0.02)、(0.45±0.08)mg/g。Monk等[29]报道,短链脂肪酸特别是丁酸能够通过下调炎症信号通路表达、减少炎症细胞因子的产生以及增强肠道屏障完整性而发挥抗炎作用,灌肠短链脂肪酸可作为结肠炎的有效治疗方法。与模型组相比,灌胃乌鸡肽后,低剂量组和高剂量组中总短链脂肪酸含量显著增加(P<0.05),其中高剂量组中乙酸、丙酸和丁酸含量增加最为明显,分别增加至(1.21±0.12)、(0.44±0.08)、(1.33±0.15)mg/g,表明灌胃乌鸡肽可以通过增加短链脂肪酸的含量缓解结肠炎症水平,这可能与肠道中Akkermansia、Ruminococcus的相对丰度增加有关[4,26]。

表4 小鼠盲肠内容物中短链脂肪酸含量(n=5)Table 4 Short-chain fatty acid contents in cecal contents of mice (n=5)mg/g
3 结论
本实验研究了乌鸡肽对DSS诱导小鼠结肠炎的调节作用,结果发现,与正常组相比,DSS处理后小鼠体质量减轻、DAI评分增加、结肠长度缩短,结肠组织中促炎因子分泌增加,肠道黏膜和肠道上皮细胞严重受损。与模型组相比,乌鸡肽灌胃干预后,小鼠体质量明显增加,DAI评分下降,结肠长度更趋近于正常小鼠,并且结肠上皮细胞固有层和隐窝受损情况得以改善,结肠中促炎因子TNF-α和IL-6的表达量降低。16S rRNA高通量测序结果发现,乌鸡肽干预可通过降低有害菌Shigella、Clostridiaceae_Clostridium的相对丰度,增加有益菌Akkermansia、Ruminococcus、Oscillospira的相对丰度,减轻结肠炎小鼠的疾病症状。另外,与正常组相比,小鼠经DSS诱导后,总短链脂肪酸、乙酸、丙酸和丁酸含量显著降低,而经过乌鸡肽干预后,盲肠内容物中总短链脂肪酸、乙酸、丙酸和丁酸含量较模型组显著升高,且高剂量的乌鸡肽效果更明显。因此,乌鸡肽可通过缓解结肠长度缩短、DAI评分增加、结肠组织损伤、抑制促炎因子产生、改变小鼠肠道微生物的组成以及改变肠道微生物代谢产物短链脂肪酸的组成,达到缓解DSS诱导的小鼠UC的效果。
