鳀鱼蛋白肽和大豆蛋白肽的多肽组成和小肠黏膜免疫调节活性比较
2023-11-07刘银媛王寒梅逯良忠沈金华
刘银媛,王寒梅,逯良忠,沈金华,杨 颖,赵 雪,*
(1.中国海洋大学食品科学与工程学院,山东 青岛 266003;2.中海海洋科技股份有限公司,山东 青岛 266000)
肠道不仅具有消化吸收功能,还是机体最大的“天然免疫器官”[1]。肠黏膜自身的结构和功能以及其内部大量的有益微生物[2]构成了强大的肠道黏膜屏障系统,它可以维持肠道功能的稳定,保护宿主免受具有致病能力的毒素和微生物的入侵[3]。研究证明,化学药物造成肠道黏膜免疫系统损伤后,会造成肠道炎症和全身炎症反应[4],从而引起腹泻、肠炎和全身免疫低下,这会导致死亡率升高[5]。环磷酰胺是一种常用的化疗药物[6],广泛用于治疗血液恶性肿瘤和各种上皮肿瘤[7]。然而大剂量的环磷酰胺会损伤胃肠黏膜,从而导致机体产生免疫缺陷[8],并增加继发性感染的风险。因此,开发安全有效的免疫调节剂以减轻环磷酰胺对肿瘤患者肠道免疫的损伤具有重要的意义。
目前从大豆、三文鱼、小麦、乳清和胶原蛋白中发现了很多具有免疫调节活性的多肽[9]。Li Qiqi等[10]报道鳕鱼肽能够改善环磷酰胺造成的肠道免疫抑制,提高肠黏膜免疫球蛋白A(immunoglobulin A,IgA)、分泌型免疫球蛋白A(secretory immunoglobulin A,SIgA)以及相关免疫因子的分泌。Wen Lingrong等[11]研究发现,大豆蛋白肽能够很好地保护肠道结构和肠黏膜免疫功能。此外,大豆蛋白肽还具有很好的降血脂[12]、降血糖[13]和神经调节[14]等生物活性,因此在功能性食品和特医食品中普遍使用。鳀鱼(Engraulisjaponicus)是世界上单鱼种年产量最高的鱼类[15],但是目前鳀鱼大多仅被简单加工成低值的鱼糜和鱼粉[16]。鳀鱼中蛋白质量分数为15%~20%[17],其可为蛋白肽的开发提供丰富、经济的蛋白质资源。有研究发现,鳀鱼蛋白水解物可显著减轻动脉粥样硬化[18]及巨噬细胞RAW264.7的氧化应激[19],而鳀鱼蛋白肽在肠道免疫调节活性方面的研究还鲜有报道。目前鳀鱼蛋白肽在多肽组成和生物活性方面的研究很少,因此限制了其在健康食品方面的应用和开发。
本研究使用超高效液相色谱-高分辨多级质谱联用技术分析鳀鱼蛋白肽和大豆蛋白肽的多肽组成差异,然后采用环磷酰胺诱导肠黏膜免疫抑制小鼠模型[20],以大豆蛋白肽为对照,分析比较鳀鱼蛋白肽与大豆蛋白肽对肠道黏膜免疫调节的活性,以期为开发以鳀鱼蛋白肽为主要功能成分的健康食品以及改善化疗药物所致的肠黏膜免疫损伤相关的特医食品提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
6 周龄健康雄性BALB/c 小鼠,体质量为(20.0±2.0)g,SPF级,购自北京维通利华实验动物技术有限公司,生产许可证号为:SCXK(京)2020-0010。动物饲养环境温度为(23±1)℃,相对湿度为40%~50%,实验期间采用12/12 h明暗交替,小鼠均自由饮食饮水。本研究中所有方案和程序均符合中国海洋大学食品科学与工程学院实验动物护理伦理委员会的相关规定(伦理审查编号:20100409291)。
鳀鱼蛋白肽 中海海洋科技有限公司;大豆蛋白肽山东天骄生物技术股份有限公司;碱性蛋白酶、木瓜蛋白酶、中性蛋白酶 诺维信(中国)生物技术有限公司;环磷酰胺、胸腺肽肠溶片 阿拉丁试剂(上海)有限公司;干扰素-γ(interferon-γ,IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-4、IL-13、SIgA、IgA试剂盒 上海泛柯生物科技有限公司;实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qPCR)All-In-One 5× RT Master Mix试剂盒、BlastaqTMGreen 2× PCR Master Mix试剂盒 加拿大Applied Biological Materials Inc公司;PCR引物 上海生工生物工程股份有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
1260高效液相色谱仪 美国Agilent公司;Ultimate 3000超高效液相色谱-Q-Exactive四极杆-轨道阱超高分辨质谱仪 美国赛默飞世尔科技公司;Powerwave XS酶标仪 美国BioTek公司;Nano-1000微量分光光度计杭州奥盛仪器有限公司;FQD-96A qPCR仪 杭州博日科技股份有限公司;Ni-E电子荧光显微镜 日本尼康公司;KZ-III-F高速低温组织研磨仪 武汉赛维尔生物科技有限公司;L8900全自动氨基酸分析仪 日本日立公司。
1.3 方法
1.3.1 鳀鱼蛋白肽和大豆蛋白肽的制备
以鳀鱼为原料,采用压榨脱油、水洗脱盐、水提取蛋白、中性蛋白酶和碱性蛋白酶复合酶解,然后分别用100 Da和800 Da超滤膜超滤,收集100~800 Da组分为鳀鱼蛋白肽。以大豆为原料,采用水提取蛋白、木瓜蛋白酶和碱性蛋白酶复合酶解,然后用1 000 Da超滤膜超滤,收集小于1 000 Da组分为大豆蛋白肽。
经测定,鳀鱼蛋白肽和大豆蛋白肽的蛋白质量分数均大于90%,脂肪质量分数为1%~2%,矿物质盐质量分数分别约为2.5%和3.4%。
1.3.2 蛋白肽的分子质量和氨基酸组成分析
采用高效凝胶排阻色谱仪分析蛋白肽的分子质量。色谱条件:色谱柱为TSK gel G2000 swxl(300 mm×7.8 mm,8 μm );流动相为V(乙腈)∶V(三氟乙酸)∶V(水)=300∶1∶700;检测波长为225 nm;流速为0.5 mL/min;温度为35 ℃;进样体积为20 μL。使用GPC软件(美国安捷伦公司)处理数据。
氨基酸组成参照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》进行测定,采用L8900全自动氨基酸分析仪分析氨基酸组成。准确称量2 g样品,加入15 mL 6 mol/L盐酸溶液,110 ℃水解22 h。水解液5 000×g离心15 min,合并上清液,定容至50 mL。移取1 mL滤液至25 mL试管内,50 ℃真空旋转蒸发蒸干,然后加入2 mL水,再次真空旋转蒸发蒸干,加入1.0 mL pH 2.2柠檬酸钠缓冲液溶解,振荡混匀。吸取溶液经0.22 μm水相滤膜过滤,上机测定。
1.3.3 蛋白肽的多肽组成分析
使用超高效液相色谱-高分辨多级质谱分析蛋白肽产品中多肽的序列和含量。
色谱条件:色谱柱为C18柱(1.0 mm×150 mm,1.7 μm);柱温为40 ℃;流速为0.15 mL/min;进样量为10 μL;进样时间为50 min;流动相A为0.1%(体积分数,下同)甲酸-乙腈溶液,流动相B为0.1%甲酸溶液;流动相梯度为0~2 min 5% A,2~27 min 5%~10% A,27~37 min 10%~25% A,37~39 min 20%~80% A,39~42 min 80% A,42~43 min 80%~85% A,43~50 min 5% A。
质谱条件:电喷雾正离子(electron spray ionization,ESI+)模式;喷雾电压为3.4 kV;在数据依赖性采集模式下,质荷比(m/z)扫描范围为200~1 500。其他参数设置如下:1)一级质谱条件:分辨率70 000;扫描阱容量为1×106;2)二级质谱条件:分辨率17 500;扫描阱容量为1×105;每个采集循环中监测的最强离子数为20;碰撞能量分别为20、35、45 eV;鞘气(氮气)流速为40 Arb;辅助气体流速为10 Arb;毛细管温度为320 ℃;辅助气体加热温度为300 ℃;信号强度阈值为1.6×105。采用提取离子流质谱法分析多肽的相对含量。
采用Peaks Online 1.7软件对超高效液相色谱-高分辨多级质谱数据进行分析,获取蛋白肽中所有多肽的氨基酸序列。参数设置如下:母离子误差范围为1×10-5;子离子误差范围为0.02 Da;漏切位点为3;数据库为Glycine max20220325.fasta(560 472 条,下载自NCBI数据库)和Clupeiformes20220610.fasta(243 310 条,下载自NCBI数据库);平均局部置信度(average local confidence,ALC)≥50%,控制错误发现率(false discovery rate,FDR)≤1%。
根据每个多肽的单同位素峰计算多肽的实验分子质量(mExp)、理论分子质量(mTheor)和误差。通过提取离子质谱获得每种多肽的离子强度峰面积,记录为总离子强度。多肽的相对含量为每个多肽的总离子强度占所有多肽总离子强度的比例。采用Venny 2.1 BioinfoGP CNB-CSIC软件对两种蛋白肽产品的多肽组成进行维恩分析。
1.3.4 动物模型的建立
雄性BALB/c小鼠适应性饲养1 周后随机分为5 组,分别为:正常组、模型组、胸腺肽组、大豆蛋白肽组和鳀鱼蛋白肽组,每组8 只。实验期间第1~30天正常组和模型组每日灌胃一次蒸馏水,胸腺肽组每日灌胃一次50 mg/kgmb剂量的胸腺肽肠溶片,鳀鱼蛋白肽组和大豆蛋白肽组分别给予小鼠100、300 mg/kgmb和500 mg/kgmb的鳀鱼蛋白肽和大豆蛋白肽。每2 d称一次小鼠体质量。实验的第31~32天小鼠(除正常组)每天腹腔注射一次50 mg/kgmb剂量的环磷酰胺,正常组小鼠注射等体积的无菌生理盐水。在实验期间,观察各组小鼠的活动状态、毛色等。第32天夜间禁食不禁水12 h,第33天麻醉后摘眼球取血、脱颈椎处死小鼠;每只小鼠分别取脾脏和胸腺,用滤纸吸去表面水分后称质量。脏器指数按下式计算。
取小肠的空肠部分1~2 cm,于4%中性甲醛中固定,用于苏木精-伊红(hematoxylin-eosin staining,HE)染色。取约3 cm空肠段,称质量后置于EP管中,剪碎,加入2 mL磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.4,含0.01 mmol/L苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)),4 ℃下充分混合,并于4 ℃下5 000 r/min离心5 min,收集上清液为肠道黏膜液,置于-80 ℃保存,用于后续相关试剂盒测定。用锡箔纸将剩余的空肠包裹,置于-80 ℃液氮中保存,用于后续基因测定。
1.3.5 小肠组织形态学观察
小肠的空肠部分使用4%多聚甲醛固定24 h后,流水冲洗组织上的多聚甲醛,采用70%~100%梯度乙醇进行组织脱水,然后进行石蜡包埋。制备5 μm切片,进行HE染色,使用电子荧光显微镜观察其组织形态。
采用ImageJ软件测量小肠绒毛长度与隐窝深度,并计算绒毛长度/隐窝深度比值;小肠绒毛高度为从绒毛顶端至隐窝开口处的垂直距离;小肠隐窝深度为从隐窝开口至隐窝基部的垂直距离。
1.3.6 小肠黏膜免疫因子和免疫球蛋白含量的测定
取肠道黏膜液,按照相关试剂盒说明书,采用酶联免疫吸附测定(enzyme-linked immunosorbent assays,ELISA)法检测小鼠小肠黏膜中免疫因子IFN-γ、TNF-α、IL-4、IL-13和免疫球蛋白IgA、SIgA的含量。
1.3.7 TLRs/NF-κB信号通路相关因子mRNA表达量的测定
采用qPCR法检测Toll样受体4(Toll-like receptor 4,TLR4)/核因子-κB(nuclear factor kappa B,NF-κB)信号通路相关因子mRNA表达量。使用TRIzol试剂提取小鼠空肠组织总RNA,采用Nano-1000微量分光光度计测定RNA浓度和纯度。采用All-In-One 5xRT master Mix试剂盒将RNA逆转录成cDNA,并以此为模版进行qPCR反应。反应总体系20 μL,包括BlastaqTMGreen 2× qPCR Master Mix 10 μL,cDNA样品3 μL,各基因对应上游引物与下游引物各0.5 μL,无酶水(diethypyrocarbonate,DEPC)6 μL。反应参数:95 ℃预变性3 min;95 ℃变性15 s,60 ℃退火1 min,60 ℃沿伸1 min,40 个循环。以GAPDH为内参,引物序列见表1。
1.4 数据统计与分析
本实验所有数据均采用平均值±标准差表示,使用SPSS Statistics 23.0软件进行单因素方差分析,同时采用最小显著性差异法(least-significant difference,LSD)进行组间差异比较,以P<0.05表示差异显著。采用Graphpad Prism 8.0软件绘图。
2 结果与分析
2.1 蛋白肽多肽组成分析
在前期研究中,为了提高蛋白肽的得率,本课题组对鳀鱼蛋白和大豆蛋白的水解条件进行了探索,发现鳀鱼蛋白使用中性蛋白酶和碱性蛋白酶水解的得率最高,而大豆蛋白肽使用碱性蛋白酶和木瓜蛋白酶水解的得率最高。因此,以提高蛋白肽得率为目标,筛选出降解鳀鱼蛋白和大豆蛋白的最佳条件,获得了两种不同的蛋白肽产品(文章未发表)。如图1和表2所示,鳀鱼蛋白肽和大豆蛋白肽的重均分子质量分别为264.150 Da和413.124 Da,鳀鱼蛋白肽的重均分子质量小于大豆蛋白肽。鳀鱼蛋白肽和大豆蛋白肽均含有人体所需的8 种必需氨基酸(赖氨酸(Lys)、色氨酸(Trp)、苯丙氨酸(Phe)、甲硫氨酸(Met)、苏氨酸(Thr)、异亮氨酸(Ile)、亮氨酸(Leu)和缬氨酸(Val))。鳀鱼蛋白肽中谷氨酸(16.95%)、丙氨酸(12.00%)、赖氨酸(9.82%)、色氨酸(6.56%)和谷氨酸(16.95%)相对含量较高,而大豆蛋白肽中亮氨酸(8.08%)、天冬氨酸(9.40%)、亮氨酸(8.08%)、精氨酸(7.17%)和苯丙氨酸(6.35%)相对含量较高。大豆蛋白肽中天冬氨酸、酪氨酸和精氨酸相对含量远高于鳀鱼蛋白肽,丙氨酸和色氨酸相对含量远低于鳀鱼蛋白肽。

图1 鳀鱼蛋白肽和大豆蛋白肽的凝胶排阻色谱图Fig.1 Gel exclusion chromatogram of peptides from E.japonicus and Glycine max

表2 鳀鱼蛋白肽和大豆蛋白肽的分子质量及氨基酸组成Table 2 Molecular masses and amino acid compositions of peptides from E.japonicus and G.max
采用超高效液相色谱-高分辨多级质谱对蛋白肽进行分析,利用Peaks Online 1.7软件分析蛋白肽产品中所有多肽的序列和相对含量。超高效液相色谱能够将6 000 条多肽进行分离,四极杆-轨道阱超高分辨质谱可检测总离子强度为4.79×103~2.67×108的所有多肽。根据多肽的二级质谱,本研究从鳀鱼蛋白肽和大豆蛋白肽中分别解析出5 680 条和7 666 条多肽的准确序列。根据维恩分析,鳀鱼蛋白肽和大豆蛋白肽中多肽组成的差异如图2和表3所示。分析发现鳀鱼蛋白肽总肽段为5 680 条,2~5肽占比为65.05%;大豆蛋白肽总肽段为7 666 条,2~5肽占比(50.69%)低于鳀鱼蛋白肽,10肽以上的多肽占比(9.76%)高于鳀鱼蛋白肽(4.30%)。两种蛋白肽产品中相同的肽段为1 325 条(占比为11.0%),其中97.9%为2~5肽。鳀鱼蛋白肽中有4 355 条多肽段是其独有的,大豆蛋白肽中有6 341 条多肽段是其独有的。
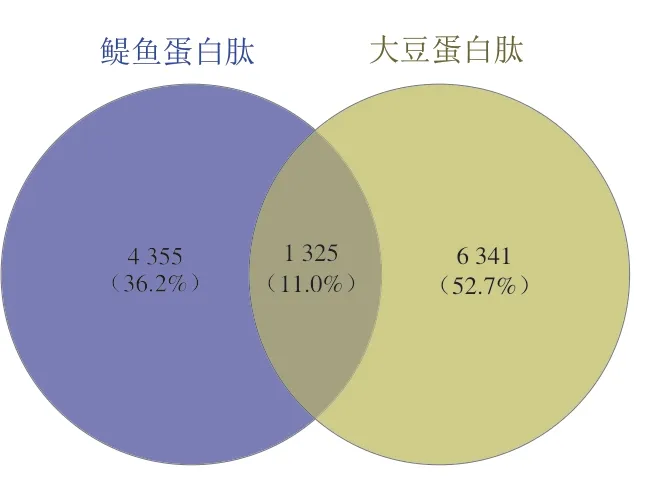
图2 鳀鱼蛋白肽和大豆蛋白肽的多肽组成维恩图Fig.2 Venn diagram of peptide compositions of peptides from E.japonicus and G.max

表3 鳀鱼蛋白肽和大豆蛋白肽的多肽组成比较Table 3 Composition analysis of peptides from E.japonicus and G.max
由表4可知,鳀鱼蛋白肽中相对含量较高的多为2~5肽,还有少量的10肽、11肽。而大豆蛋白肽中相对含量较高的多为10肽以上的多肽,与分子质量分析结果相印证。本研究结果说明鳀鱼蛋白肽和大豆蛋白肽的多肽种类和相对含量有很大不同。

表4 鳀鱼蛋白肽和大豆蛋白肽中相对含量最高的15 个多肽的序列和质谱解析Table 4 Sequence and mass spectral analysis of 15 fractions with the highest relative content in peptides from E.japonicus and G.max
2.2 蛋白肽对小鼠体质量和免疫器官指数的影响
分别给予小鼠100、300 mg/kgmb和500 mg/kgmb的鳀鱼蛋白肽和大豆蛋白肽30 d后,发现300 mg/kgmb鳀鱼蛋白肽和500 mg/kgmb大豆蛋白肽组小鼠的活动量增多,鼠毛光泽较好;而100 mg/kgmb鳀鱼蛋白肽和大豆蛋白肽组小鼠的生命力均较差。如图3所示,通过观察HE切片可以发现,300 mg/kgmb和500 mg/kgmb的鳀鱼蛋白肽和大豆蛋白肽对小肠黏膜结构的保护效果都较好,没有明显差异。100 mg/kgmb的鳀鱼蛋白肽和大豆蛋白肽组小鼠的肠黏膜损伤仍比较严重。因此后续实验中采用300 mg/kgmb剂量的鳀鱼蛋白肽和大豆蛋白肽,比较两种不同蛋白肽的肠黏膜免疫调节作用。

图3 不同剂量的鳀鱼蛋白肽和大豆蛋白肽对小鼠小肠黏膜结构的影响(×200)Fig.3 Effects of different doses of peptides from E.japonicus and G.max on small intestinal mucosal histomorphology of mice (× 200)
在注射环磷酰胺前,各组小鼠均反应灵敏、精神状态良好、鼠毛光亮。如图4所示,正常组小鼠体质量在实验期内缓慢上升,而注射环磷酰胺的模型组小鼠体质量明显低于正常组,同时观察到小鼠懒惰、反应迟钝、活动量减少、鼠毛无光泽。与正常组小鼠相比,模型组小鼠胸腺和脾脏指数均显著降低(P<0.05),说明环磷酰胺对小鼠机体和免疫器官造成了损伤。补充300 mg/kgmb鳀鱼蛋白肽/大豆蛋白肽30 d后,虽然小鼠的体质量与模型组相比没有明显差异,但是其活动量增加、鼠毛光泽较好。与模型组相比,大豆蛋白肽可显著提高小鼠的胸腺和脾脏指数(P<0.05);鳀鱼蛋白肽可显著提高小鼠的脾脏指数(P<0.05),但对胸腺指数没有显著影响,说明灌胃鳀鱼蛋白肽和大豆蛋白肽可以减轻环磷酰胺诱导的小鼠免疫器官损伤。

图4 鳀鱼蛋白肽和大豆蛋白肽对小鼠体质量和免疫器官指数的影响(n=8)Fig.4 Effects of peptides from E.japonicus and G.max on the body mass and immune organ indexes of mice (n=8)
2.3 蛋白肽对小鼠小肠黏膜组织形态的影响
如图5所示,正常组小鼠小肠绒毛结构完整,排列整齐且连接紧密。而模型组小鼠小肠绒毛矮短、松散,间隙增大,有些绒毛甚至断裂、脱落;同时绒毛长度和绒毛长度/隐窝深度值显著降低(P<0.05),而隐窝深度显著增加(P<0.05),说明环磷酰胺对小鼠小肠黏膜结构损伤严重。与模型组相比,300 mg/kgmb鳀鱼蛋白肽组与大豆蛋白肽组小鼠的小肠绒毛结构有所改善,绒毛长度显著增加而且排列较整齐,绒毛长度/隐窝深度显著增加(P<0.05),隐窝深度显著降低(P<0.05),说明补充鳀鱼蛋白肽和大豆蛋白肽可以改善环磷酰胺对小鼠小肠黏膜结构的损伤,维持小肠的正常组织结构和生理机能,且鳀鱼蛋白肽和大豆蛋白肽对小肠黏膜结构的保护效果并没有显著差异。

图5 鳀鱼蛋白肽和大豆蛋白肽对小鼠小肠黏膜结构的影响(n=8)Fig.5 Effects of peptides from E.japonicus and G.max on small intestinal mucosal histomorphology of mice (n=8)
2.4 蛋白肽对小鼠小肠黏膜相关免疫因子表达的影响
小肠免疫体统中,T细胞分泌的IFN-γ、TNF-α、IL-4和IL-13水平对肠黏膜的免疫功能非常重要[21]。如图6所示,与正常组相比,模型组小鼠小肠免疫因子IFN-γ、TNF-α、IL-4和IL-13的表达水平显著下降(P<0.05),而300 mg/kgmb鳀鱼蛋白肽组和大豆蛋白肽组小鼠小肠免疫因子IFN-γ、TNF-α、IL-4和IL-13的表达水平均显著高于模型组(P<0.05),且与胸腺肽组接近。说明环磷酰胺能显著抑制T细胞产生相关免疫因子,而鳀鱼蛋白肽与大豆蛋白肽可以改善环磷酰胺对免疫因子分泌的抑制。比较发现,鳀鱼蛋白肽组TNF-α水平显著高于阳性对照胸腺肽组(P<0.05),说明鳀鱼蛋白肽促进TNF-α因子表达的效果更好。

图6 鳀鱼蛋白肽和大豆蛋白肽对小肠黏膜免疫因子表达的影响(n=8)Fig.6 Effects of peptides from E. japonicus and G. max on the contents of immune factors in small intestinal mucosa (n=8)
2.5 蛋白肽对小鼠小肠免疫球蛋白IgA和SIgA表达的影响
免疫球蛋白IgA和SIgA是肠道中含量最高的免疫球蛋白[22],其含量可反映小肠黏膜获得性免疫能力。如图7所示,相比于正常组,模型组小鼠小肠黏膜中IgA和SIgA的表达水平显著下降(P<0.05),而300 mg/kgmb鳀鱼蛋白肽组和大豆蛋白肽组小鼠小肠黏膜中IgA和SIgA的表达水平均显著高于模型组(P<0.05)。说明环磷酰胺会抑制小肠黏膜免疫球蛋白IgA和SIgA的产生,而鳀鱼蛋白肽和大豆蛋白肽能够改善环磷酰胺对IgA和SIgA的抑制。通过比较发现,鳀鱼蛋白肽组SIgA的表达水平显著高于大豆蛋白肽组和胸腺肽组(P<0.05),说明鳀鱼蛋白肽促进肠黏膜免疫球蛋白SIgA表达的效果优于大豆蛋白肽。

图7 鳀鱼蛋白肽和大豆蛋白肽对小肠黏膜免疫蛋白表达的影响(n=8)Fig.7 Effects of peptides from E.japonicus and G.max on immune-related protein expression in small intestinal mucosa (n =8)
2.6 蛋白肽对TLRs/NF-κB信号通路相关基因表达的影响
TLR是先天免疫系统中发挥关键作用的一种模式识别受体,它会与指定的分泌蛋白一起刺激下游信号级联,从而激活NF-κB,诱导细胞因子的分泌[23]。如图8所示,与正常组相比,模型组小肠中TLR-4、TLR-6、TLR-9和NF-κB的mRNA相对表达量显著降低(P<0.05),而大豆蛋白肽组和鳀鱼蛋白肽组TLR-4、TLR-6、TLR-9和NF-κBmRNA相对表达量显著高于模型组(P<0.05),说明补充大豆蛋白肽和鳀鱼蛋白肽能够改善环磷酰胺对TLR和NF-κB基因表达的抑制。比较发现,大豆蛋白肽组和鳀鱼蛋白肽组小鼠的TLR-4mRNA表达水平、鳀鱼蛋白肽组小鼠的TLR-6mRNA表达水平显著高于正常组小鼠(P<0.05),说明鳀鱼蛋白肽和大豆蛋白肽对TLR基因表达有显著的促进作用,但是二者对TLR-4、TLR-6、TLR-9和NF-κB基因表达的影响没有显著性差异。

图8 鳀鱼蛋白肽和大豆蛋白肽对小肠TLRs/NF-κB通路相关因子基因表达的影响(n=8)Fig.8 Effects of peptides from E.japonicus and G.max on the expression of genes associated with intestinal TLRs/NF-κB signaling pathway (n=8)
3 讨论
目前市场上的蛋白肽产品种类很多,GB 31645—2018《食品安全国家标准 胶原蛋白肽》只规定了这类产品的分子质量和氨基酸组成,但是对不同蛋白来源的蛋白肽产品中多肽组成差异的研究还很少。高效液相色谱法是一种比较粗略的分析比较两种蛋白肽分子质量的方法,结果误差比较大。而采用高效液相色谱-高分辨多级质谱联用技术能够准确解析出两种蛋白肽产品的多肽序列和每一种多肽占比的差异,其可为蛋白肽产品生物活性和产品质量控制的研究提供依据。高效液相色谱和高分辨质谱技术是分析复杂的蛋白肽样品中多肽组成的有效工具,反相色谱的有效分离和质谱的二级碎裂有助于获得肽组学分析核心数据[24]。多肽质谱分析的难点在于鉴定复杂的生物样品中几千甚至几万个长短肽的序列和含量,而基于人工智能算法的PEAKS Online云计算平台解决了批量质谱数据集高通量解析的难题。研究发现,与目前国际上其他算法平台相比较,PEAKS Online平台可以多解析出5%~30%的肽段序列,其将对质谱数据依赖性采集模式(data dependent acquisition,DDA)和数据非依赖性采集模式(data independent acquisition,DIA)数据的解析和挖掘能力提升到了一个全新的高度[25]。大豆蛋白肽和鳀鱼蛋白肽分别属于植物蛋白和动物蛋白,为了揭示其多肽组成差异及与生物活性之间的关系,本研究采用超高效液相色谱-高分辨多级质谱联用技术,结合PEAKS Online云计算平台,分析了酶解工艺制备的大豆蛋白肽和鳀鱼蛋白肽中所有多肽的相对含量和序列。经比较发现,两种蛋白肽产品虽然分子质量接近,但是多肽组成有很大的差异。从鳀鱼蛋白肽中发现了5 680 条肽段,从大豆蛋白肽中发现了7 666 条肽段。大豆蛋白肽中2~5肽相对含量(50.69%)比鳀鱼蛋白肽(65.05%)低,而10肽以上的多肽含量(9.76%)高于鳀鱼蛋白肽(4.30%),说明大豆蛋白肽分子质量较大。大豆蛋白肽和鳀鱼蛋白肽中相同的肽段有1 325 条,鳀鱼蛋白肽中有4 355 条独有的多肽,而大豆蛋白肽中有6 341 条独有的多肽。比较相对含量最高的15 个多肽的序列和相对含量,发现鳀鱼蛋白肽中相对含量较高的多为2~5肽,而大豆蛋白肽中相对含量较高的多为10肽以上的多肽。说明鳀鱼蛋白肽和大豆蛋白肽的多肽序列和组成比例也有很大的不同,本研究结果为鳀鱼蛋白肽和大豆蛋白肽生物活性研究提供了依据,也为生产出高活性蛋白肽产品提供了可靠的质量分析技术。
免疫调节肽中最常见的氨基酸残基是疏水性氨基酸(包括Gly、Val、Leu、Pro和Phe)、Glu和Tyr[26]。文献[27]结果表明,疏水性氨基酸与一个或多个Glu、Gln、Tyr、Trp、Cys、Asp和Asn的组合是免疫调节肽的优选序列。根据这一原理将本研究中鉴定出的鳀鱼蛋白肽和大豆蛋白肽进行比较,发现绝大多数均为免疫调节肽。这一结果表明,免疫调节肽在本研究获得的鳀鱼蛋白肽和大豆蛋白肽中占主导地位。它们的存在解释了鳀鱼蛋白肽和大豆蛋白肽对环磷酰胺诱导的肠黏膜免疫抑制小鼠的影响。
肠道是机体重要的防御屏障,肠黏膜是机体抵御病原微生物的第一道防线[28]。环磷酰胺易损伤自我更新的细胞(例如肠黏膜上皮细胞)[29],因此快速生长的肠绒毛最容易受到攻击和损伤。而补充鳀鱼蛋白肽与大豆蛋白肽(300 mg/kgmb)30 d均可以改善肠黏膜免疫抑制小鼠的脾脏指数、胸腺指数及环磷酰胺造成的肠黏膜结构损伤,使小肠绒毛排列更加整齐,与模型组相比绒毛长度显著增加,隐窝深度显著降低,说明鳀鱼蛋白肽和大豆蛋白肽可以改善环磷酰胺造成的小肠机械屏障结构的损伤,维持小肠的正常组织结构和生理机能。
肠道黏膜免疫是肠道重要的防御屏障,免疫细胞(主要为T 细胞)分泌的细胞因子在维持肠黏膜系统的平衡中也起着重要作用[30]。辅助性T 细胞1(T helper cell 1,Th1)产生的IFN-γ和TNF-α作为标志性的细胞因子,被认为是细胞介导炎症的关键[31]。Th2细胞产生的IL-4和IL-13可保护宿主免受细胞外病原体的侵袭[32]。Th1和Th2细胞互相协调,调节肠黏膜平衡,维持机体正常的黏膜免疫功能[33]。补充鳀鱼蛋白肽和大豆蛋白肽可以很好地改善环磷酰胺对Th1和Th2细胞分泌IFN-γ、TNF-α、IL-4和IL-13的抑制,其中鳀鱼蛋白肽组TNF-α的含量高于胸腺肽组,说明鳀鱼蛋白肽与大豆蛋白肽可以减轻环磷酰胺对Th1和Th2细胞免疫反应功能的抑制,促进肠黏膜中免疫因子的产生。
SIgA 由多聚免疫球蛋白受体(polymeric immunoglobulin receptor,pIgR)、J-链和α-链组成,其由肠道上皮细胞分泌,是肠黏膜行使免疫屏障功能的主要因素[34],其可在黏膜表面形成保护层,抵抗细菌、病毒和其他病原体的黏附,防止肠道感染的发生。免疫细胞产生的IgA是肠道中含量最高的免疫球蛋白,其在内皮细胞之间通过细胞转运转化成SIgA,也是肠道黏膜SIgA的主要组成成分[35]。本研究结果表明,鳀鱼蛋白肽和大豆蛋白肽改善了环磷酰胺对上皮细胞分泌免疫球蛋白IgA和SIgA的抑制,从而保护肠黏膜的获得性免疫功能。Li Qiqi等[10]也发现鳕鱼蛋白肽能够改善环磷酰胺对免疫球蛋白的抑制。经比较发现,鳀鱼蛋白肽促进肠黏膜细胞分泌SIgA的效果要优于大豆蛋白肽,说明不同的蛋白肽产品对免疫球蛋白表达量的影响有所不同。
TLR作为机体先天免疫的“哨兵”,其对应的配体被识别时会触发促炎细胞因子、趋化因子和共刺激分子的转录激活,随后启动对宿主存活至关重要的防御机制[36]。本研究结果显示,与模型组相比,鳀鱼蛋白肽和大豆蛋白肽组中TLR-4、TLR-6、TLR-9和NF-κB的基因表达量均显著上调,改善了环磷酰胺对TLRs/NF-κB信号通路的抑制作用,与免疫因子和免疫球蛋白IgA、SIgA表达量上调的结果相印证,说明鳀鱼蛋白肽和大豆蛋白肽可以通过影响TLRs/NF-κB信号通路中相关因子的表达,促进小肠中免疫因子和免疫球蛋白的分泌,从而保护小肠的免疫功能。
本研究发现鳀鱼蛋白肽和大豆蛋白肽都有一定的肠道黏膜免疫保护活性,说明鳀鱼蛋白肽和大豆蛋白肽中都含有提高免疫力的多肽。但值得重视的是,两种蛋白肽在调节肠免疫方面的活性和机制没有明显差异,这可能是因为蛋白质酶解物中多肽种类高达5 000~7 000 种,结合每种免疫多肽活性和含量综合考虑,由多肽组成的混合物在保护肠黏膜结构和调节小鼠黏膜免疫活性方面并没有明显差异。本研究基于超高效液相色谱-高分辨多级质谱联用的肽组成分析技术,为蛋白肽中免疫多肽的进一步挖掘提供了有效的技术和方法,为发现更多不同的免疫活性肽提供了可能性,为生产出具有高免疫活性的蛋白肽产品提供指导。
目前大豆蛋白肽已经广泛应用于健康食品和保健食品中,而鳀鱼蛋白肽的研究和应用较少。比较发现,鳀鱼蛋白肽与大豆蛋白肽在调节肠免疫活性方面效果相似,说明鳀鱼蛋白肽在健康食品方面也具有很好的应用开发前景。
4 结论
本研究采用超高效液相色谱-高分辨多级质谱联用技术,结合PEAKS Online云计算平台,研究鳀鱼蛋白肽和大豆蛋白肽中多肽的序列和比例。本研究发现补充300 mg/kgmb鳀鱼蛋白肽和大豆蛋白肽30 d能够减少环磷酰胺造成的小鼠体质量下降,提高小鼠的胸腺指数和脾脏指数,保护肠黏膜组织结构,上调小肠免疫因子IFN-γ、TNF-α、IL-4、IL-13和免疫球蛋白SIgA、IgA的表达,同时上调TLRs/NF-κB信号通路中TLR(TLR-4、TLR-6、TLR-9)和NF-κB基因的表达,说明鳀鱼蛋白肽和大豆蛋白肽改善环磷酰胺引起肠黏膜损伤的作用机制与TLR介导的NF-κB信号通路相关。虽然鳀鱼蛋白肽和大豆蛋白肽的多肽组成存在较大差异,但是活性实验结果表明,鳀鱼蛋白肽仅在促进肠黏膜SIgA表达方面优于大豆蛋白肽,鳀鱼蛋白肽和大豆蛋白肽在改善环磷酰胺造成的肠黏膜损伤、免疫因子的表达、TLRs/NF-κB信号通路重要因子表达等方面并没有明显差异。
