HER2阳性乳腺癌中p95HER2表达与细胞增殖的相关性研究
2023-11-04吴旸张薇董丽平徐迪邓飞唐金海
吴旸, 张薇, 董丽平, 徐迪, 邓飞, 唐金海
癌症是威胁人类健康的一大重要因素,约20%的乳腺癌患者存在人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)过表达,此类患者更易发生肿瘤复发转移,预后较差。鉴于其在乳腺癌、胃癌和胃-食管交界处癌、结直肠癌、胆道癌、非小细胞肺癌和膀胱癌等多种癌症中扩增或过表达[1-2]。当前已经开发出多种靶向HER2的治疗方法,并在乳腺癌和胃癌中显示出疗效[1,3]。其中,曲妥珠单抗(Trastuzumab)为全球批准的第一个针对HER2过表达乳腺癌的人源化单克隆抗体,它可与HER2的细胞外结构域相结合,从而抑制肿瘤细胞生长。由于HER2在一些重要器官如肝、肺和心脏中也有弱至中度表达,Trastuzumab可能会产生不良反应,因此限制了给药剂量[4],从而使乳腺癌患者对HER2治疗不敏感或逐渐发生耐药。
HER2阳性乳腺癌患者Trastuzumab耐药有多种形式,其中肿瘤细胞表面HER2蛋白结构形态的改变能够导致HER2阳性肿瘤细胞对Trastuzumab抵抗。而人表皮生长因子受体-2突变蛋白(N-terminal truncated isoform of HER2,p95HER2)是HER2受体的缩短形态,缺少Trastuzumab结合位点但仍具有酶活性,可以作为接受Trastuzumab治疗的HER2阳性转移性乳腺癌患者不良预后标志(图1A)[5-7]。p95HER2的表达与全长HER2表达正相关,大约40%的HER2阳性肿瘤表达p95HER2[4,8]。既往研究表明,p95HER2表达是一个独立的预后因素,高水平的p95HER2与预后较差相关[8-11]。p95HER2在促进肿瘤进展和转移方面比全长HER2更具侵袭性,并且被认为与Trastuzumab耐受密切相关[12-13]。与HER2不同,p95HER2在HER2阳性的正常组织中不表达,这使得p95HER2成为一个值得研究的HER2阳性肿瘤亚群的肿瘤特异性抗原[4,14]。p95HER2的表达提示曲妥珠单抗治疗HER2阳性乳腺癌存在一定的肿瘤抗性的现象,已被广泛接受。而p95HER2除了在肿瘤耐药方面的价值外,是否与肿瘤的其他生物学行为如增殖、转移等有关系,尚未被充分研究。本文旨在探讨p95HER2的表达情况与临床病理之间的相关性,探索其在肿瘤增殖中可能发挥的作用。
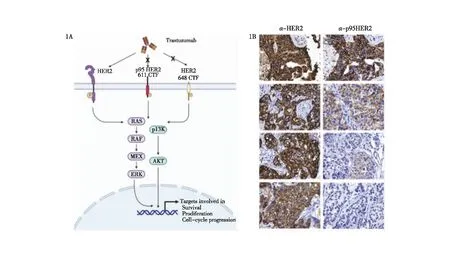
图1 p95HER2及HER2在正常组织和乳腺癌中的表达 1A:HER2及p95HER2与Trastuzumab作用机制示意图;1B:乳腺癌组织HER2及p95HER2蛋白表达情况的免疫组化图,×20
1 材料和方法
1.1 患者入组 调取江苏省人民医院生物样本库保藏的2020年12月至2021年12月由普外科切除的、经3位病理医师确诊的47例乳腺癌HER2阳性患者标本,患者均为女性;年龄31~80岁,中位年龄52岁,纳入标准为HER2++且病理Fish确定或HER2++,排除标准为HER2+或HER2-。患者使用AC-THP方案治疗8周后或直接手术治疗,收集患者肿瘤组织样本及首次入院前后的生化及血常规数据。研究经本院医学伦理委员会批准通过,患者及家属签署知情同意书。
1.2 实验资料 人乳腺导管癌细胞(BT474)购于中国科学院细胞库,培养条件为含10%胎牛血清的RPMI 1640培养基,5%二氧化碳,37 ℃下培养。p95HER2过表达慢病毒载体购于南京晶麦生物科技公司,RPMI 1640培养基购于南京凯基生物公司,胎牛血清(FBS)购于南京维森特生物公司。抗p95HER2抗体,购于abcam(上海)公司,货号为ab32074,抗兔二抗购于武汉PROTEINTECH生物公司和CST中国公司,货号为SA00001-2,93702S。DAB 显色试剂盒等购于碧云天生物科技公司。
1.3 组织样本获取及免疫组化染色 取乳腺癌手术切除组织,石蜡包埋切片,二甲苯脱蜡,梯度乙醇水化,90%乙醇和3%过氧化氢封闭,去除内源性过氧化物酶后于室温下3%H2O2孵育10 min,磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗3次,煮沸抗原修复,加入枸橼酸缓冲液中煮沸15~20 min,取出至室温冷却,PBS冲洗,封闭10 min,顺序一抗和二抗孵育,PBS冲洗3次,二氨基联苯胺法染色(Super Sensitive Polymer-HRP ISH Detection System, DAB),苏木精复染,乙醇脱水至二甲苯透明,干燥后树脂封片。PBS为对照,染色标准判断以肿瘤细胞膜着色为基准,统计20个高倍视野(×400)下免疫组化染色细胞。染色面积,着色范围≤10%为0分,10%<着色范围≤25%为1分,25%<着色范围≤50%为2分,50%<着色范围≤75%为3分,着色范围>75%为4分。染色强度,无色0分,弱染色1分,中染色2分,强染色3分。以两种积分之和0分为阴性,1~2分为弱阳性(+),3~5分为阳性(++),>5分为强阳性(+++)。对p95HER2的判断标准,0~+判断为p95HER2低表达,++~+++为p95HER2高表达。染色玻片分别按照美国临床肿瘤学会/美国病理学家学会(ASCO/CAP)2013年发布和更新的乳腺癌检测指南进行解读。
1.4 p95HER2稳定表达细胞株的构建 取处于对数生长期的BT474细胞,消化计数并以1×105个细胞每孔种入24孔板中,培养过夜待转染。取p95HER2慢病毒质粒载体,以MOI值为10与聚凝胺(polybrene)混合孵育15 min后,加入到RPMI 1640培养基中,使polybrene终浓度达到5 μg/mL。将含p95HER2慢病毒质粒载体的RPMI 1640培养基加入BT474细胞中,共孵育6 h后,更换新鲜RPMI 1640培养基。细胞继续培养48 h后,向24孔板的每孔中加入终浓度为0.5 μg/mL的嘌呤霉素与细胞共同孵育,待显微镜下观察到未转染慢病毒质粒载体的空白BT474细胞组全部死亡后,更换不含嘌呤霉素的RPMI 1640培养基继续培养细胞得p95HER2稳定表达的BT474细胞株(BT474-p95)。
1.5 细胞株的p95HER2的mRNA与蛋白表达检测 取对数生长期的BT474-p95细胞,消化细胞后离心倾倒干净离心管中液体,将含有细胞的离心管置于冰上,加入500 μL 总RNA抽提试剂(trizol)溶液充分裂解细胞,细胞裂解完成后于4 ℃下12 000 g离心15 min,将上清转移至新离心管中并加入100 μL氯仿,涡旋震荡溶液后4 ℃下12 000 g离心15 min,将上层液体转移至新离心管中并加入等体积的异丙醇,涡旋震荡溶液后4 ℃下12 000 g离心15 min,弃上清向离心管中加入75%乙醇,4 ℃下12 000 g离心5 min,弃上清室温下晾干沉淀后加入50 μL无酶水溶解沉淀并测定总mRNA含量。随后根据mRNA逆转录试剂盒在20 μL体系下将mRNA逆转录为cDNA,并取定量cDNA通过实时荧光定量PCR检测p95HER2 mRNA在细胞中的表达情况。
取对数生长期的BT474-p95细胞,加入预冷的含有1 % PMSF的RIPA裂解液,冰上裂解0.5 h后12 000 g离心15 min取上清,通过BCA蛋白浓度检测法(BCA)检测上清中细胞总蛋白含量。将所需量的蛋白溶液与5 X的蛋白上样缓冲液混合后,置于金属浴上99 ℃加热10 min,冷却至室温后将蛋白样本加入制备好的SDS-PAGE胶孔中,分别以80 V和150 V的电压使蛋白样本通过压缩胶和分离胶。裁剪与胶相对应大小的PVDF膜,浸泡于甲醇中约15 s,将在转模液中浸湿后的海绵、滤纸、胶、PVDF膜、滤纸、海绵按顺序置于转模夹中夹紧,放入转膜槽中并加入转膜液,转膜槽放在碎冰中以260 mA转膜1.5 h。转模结束后,将PVDF膜置于5%的BSA溶液中封闭2 h,随后分别将PVDF膜与p95一抗和HRP二抗室温孵育2 h和1 h,最后将显影液滴加在PVDF膜上并进行曝光拍照检测p95HER2蛋白在细胞中的表达情况。
1.6 p95HER2阳性细胞增殖与克隆形成实验 取处于对数生长期的p95HER阳性BT474细胞(BT474-p95),并以未转染p95HER慢病毒质粒载体BT474细胞(BT474-NC)为对照,用含EDTA的胰酶消化后,以3 000个细胞每孔铺入96孔板中,分成BT474-NC、BT474-p95、BT474-NC加曲妥珠单抗和BT474-p95加曲妥珠单抗组,曲妥珠单抗在培养基中的终浓度为3.5 μg/μL,每组6个重复孔。采用细胞活力检测法(CCK8)于0、12、24、48 h检测每组细胞的增殖情况,即96孔板中加入10 μL CCK-8试剂后避光孵育2 h,用酶标仪检测96孔板在450 nm处的吸光值。
取处于对数生长期的BT474-p95和BT474-NC细胞,胰酶消化计数后以300个细胞每孔铺入6孔板中,细胞均匀分布,随后加入终浓度为3.5 μg/μL的曲妥珠单抗。每2 d更换新鲜培养基,待细胞克隆形成后,倾倒培养基并用PBS缓冲液清洗细胞3次,吸干PBS缓冲液后用4%的多聚甲醛固定细胞0.5 h,随后加入0.5 %的结晶紫溶液染色15 min,PBS缓冲液冲洗残留染色液,室温晾干拍照并计算细胞克隆形成数。
1.7 统计学方法 本研究数据采用R包compareGroups进行分析,计数资料以例(%)表示,连续性变量符合正态分布采用组间t检验,不符合正态分布则描述为中位数+四分位数,采用秩和检验;二分类变量组间比较采用卡方检验或Fisher精确检验。P<0.05表示差异有统计学意义。
2 结果与讨论
2.1 p95HER2及HER2在正常组织和乳腺癌中的表达情况 通过47例人乳腺癌的组织切片进行免疫组化染色法检测乳腺癌标本中全长HER2和p95HER2的表达,结果显示47例的乳腺癌标本全长HER2表达阳性,其中44.7 %(21/47)的乳腺癌标本中p95HER2表达阳性(图1B,表1)。此外,我们发现大部分p95HER2阳性分布在HER2 免疫组化(immunohistochemistry,IHC)3+的乳腺癌样本中,而在HER2 IHC1+及以下的样本中未检测到p95HER2阳性,这与之前的报道一致[8]。综上所述,p95HER2在大约48%的HER2阳性(≥IHC2+)乳腺癌中表达,但在正常组织中检测不到,这使得它成为一个有吸引力的肿瘤特异性靶点。
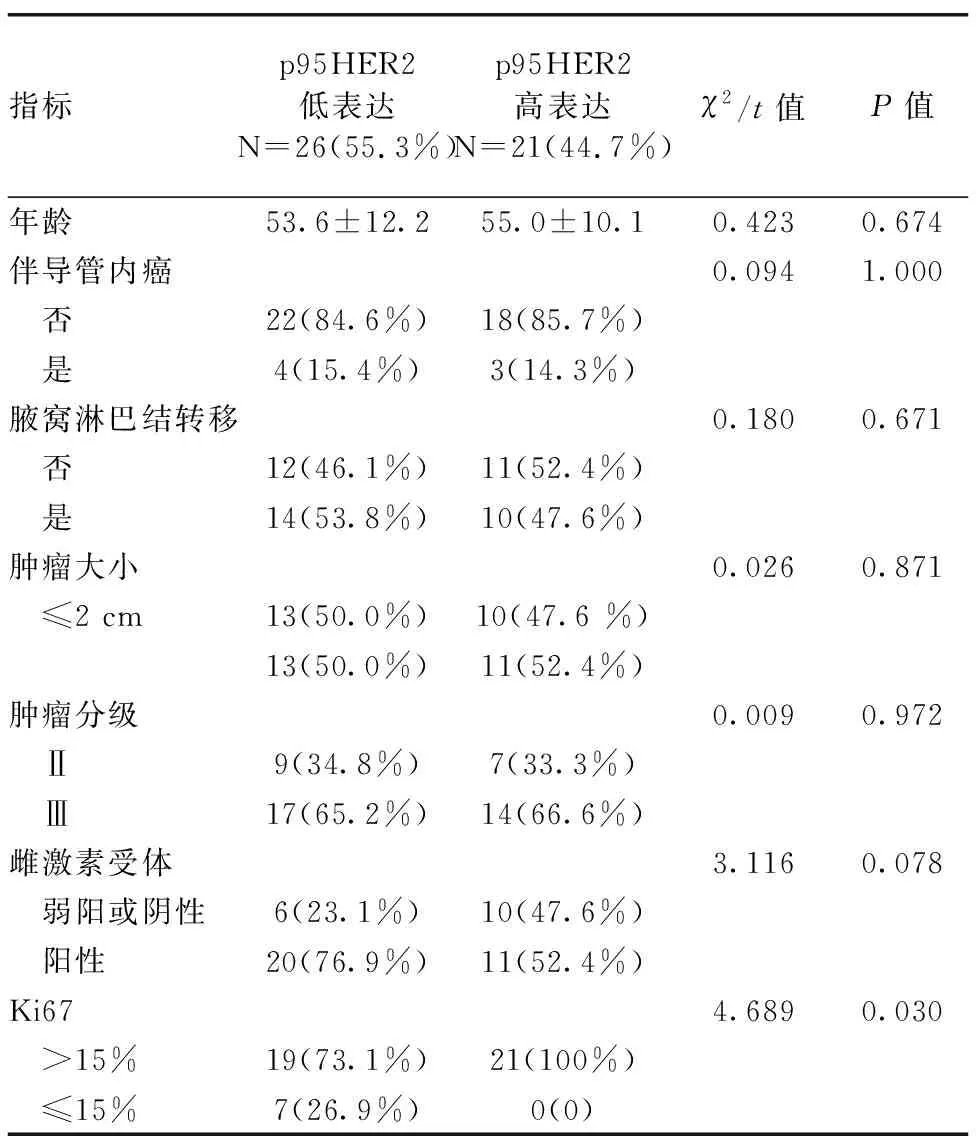
表1 p95HER2在HER2阳性乳腺癌患者肿瘤组织中表达与临床指标的关系
2.2 临床病理特征与p95HER2蛋白表达的关系 p95HER2在不同年龄、肿瘤大小、淋巴结转移、浸润性癌是否合并导管内癌等指标上的差异无统计学意义(P>0.05);而在原发病灶的p95HER2分组中,患者Ki67的表达差异有统计学意义(P<0.05),见表1。进一步,我们专门分析其与血常规及生化治疗方面是否有联系,结果发现在碱性磷酸酶、肌酸激酶、胆固醇、甘油三酯、低密度脂蛋白胆固醇同样差异有统计学意义(P<0.05),见表2。
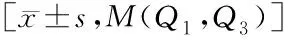
表2 p95HER2 在 HER2 阳性乳腺癌患者肿瘤组织中表达与血生化及血常规指标的关系
2.3 p95HER2稳定表达细胞株的构建 p95HER2稳定表达细胞株的构建,是通过慢病毒转染含嘌呤霉素抗性的p95HER2表达质粒筛选得到。随后,通过实时荧光定量法和Western blot法,对构建好的p95HER2稳定表达细胞株(BT474-p95)的p95HER2基因和蛋白表达进行验证。其结果如图2A,经过转染后BT474细胞在荧光显微镜下发出大量绿色荧光,同时在嘌呤霉素的筛选下未经过慢病毒转染的BT474细胞全部死亡。BT474-p95细胞在嘌呤霉素的筛选下与BT474-NC细胞比其p95HER2 mRNA表达有显著差异,同时Western blot结果也证明了p95HER2蛋白可以在BT474细胞上稳定表达(图2B)。因此,后续实验以嘌呤霉素筛选后的p95HER2慢病毒转染的BT474细胞(BT474-p95)作为p95HER2基因稳定表达细胞株。

图2 p95HER2稳定表达细胞株的构建 2A:荧光显微镜下BT474细胞转染p95HER2慢病毒质粒载体,×5;2B:RT-qPCR与Western blot检测转染p95过表达慢病毒质粒载体后BT474细胞中p95HER2基因在的表达情况
2.4 p95HER2阳性细胞的增殖与克隆形成实验 p95HER2基因是HER2基因在其氨基酸序列第611处截短所表达出的蛋白,其细胞外段截短,是导致曲妥珠单抗无法识别、结合而发挥抗体药物功能的原因之一,进而导致表达p95HER2基因的HER2阳性乳腺癌细胞对曲妥珠单抗抵抗。而p95HER2及HER2是一种具有激酶活性的跨膜蛋白,属于表皮生长因子跨膜受体,其表达与细胞增殖、存活密切相关。实验通过细胞CCK8法和结晶紫染色法,检测在有曲妥珠单抗药物的作用下,表达p95HER2的乳腺癌细胞(BT474-p95)及表达HER2的乳腺癌细胞(BT474-NC)的增殖情况。结果如图3C所示,BT474-NC在未加曲妥珠单抗药物组,48 h增殖迅速与0 h比有极显著差异(P<0.01),而加入3.5 μg/μL曲妥珠单抗药物后,BT474-NC细胞迅开始死亡(48 h,P<0.01),在48 h时BT474-NC细胞数量仅有实验开始0 h时细胞总量的14.0%左右。在BT474-p95未加曲妥珠单抗药物组,乳腺癌细胞增殖对比BT474-NC在未加曲妥珠单抗药物组12~48 h内无显著性差异(P>0.05),加入曲妥珠单抗药物后BT474-p95明显产生药物抵抗,与BT474-NC加药组比其在24-48 h内细胞继续增殖(P<0.01),但增殖比例低于BT474-p95未加曲妥珠单抗药物组,其原因为BT474-p95细胞有一定的HER2基因表达,可与曲妥珠单抗药物作用。

图3 p95HER2阳性细胞的增殖与克隆形成实验 3A:结晶紫染色后的细胞克隆情况照片;3B:不同实验组细胞克隆情况统计图;3C:不同实验组细胞增殖情况,**P<0.01
细胞克隆形成实验是测定细胞增殖能力的方法之一,细胞贴壁后必须是有增殖活力的细胞才能形成克隆,而细胞存活及形成克隆的数量多少,可以有效反应实验外加条件对细胞增殖的影响。细胞克隆形成实验结果如图3所示,在BT474-NC组3.5 μg/μL的曲妥珠单抗药物有效抑制了细胞克隆的形成,而在转染了p95HER2慢病毒质粒载体后,BT474-p95组细胞克隆数量虽有抑制,但与使用了曲妥珠单抗药物BT474-NC组比较差异有统计学意义,实验结果进一步说明BT474-p95细胞对曲妥珠单抗药物具有抵抗作用。同时,p95HER2保留了HER2的生物功能因而导致了肿瘤细胞的增殖。
3 讨论
HER2是表皮生长因子(epidermal growth factor,EGF)受体酪氨酸激酶家族的一员[1]。HER2在胚胎发育,特别是在心脏发育过程中起着至关重要的作用[15]。HER2在一些上皮来源的正常组织中具有中低表达水平,其在乳腺癌、胃癌和胃-食管交界处癌、结直肠癌、胆道癌、非小细胞肺癌和膀胱癌等多种癌症中扩增或过表达。在HER2在乳腺癌研究中,p95HER2 仅在肿瘤组织中高表达,并且表达率超过30%[6]。
这些研究主要集中在p95HER2蛋白表达曲妥珠单抗的抵抗方面,以及与患者预后的关系上,而其与肿瘤增殖等生物学行为有无关系,目前并没有详细评估,由于入组患者为两年内的HER2阳性乳腺癌患者,未得到乳腺癌耐药随访结果,同时在患者入院后新辅助患者病例不足且有研究表述p95-HER2蛋白表达参与了曲妥珠单抗治疗抵抗,后续我们将纳入更多病例并增加随访时间以分析p95HER2蛋白表达与曲妥珠单抗治疗效果情况。有研究证实,HER2阳性乳腺癌接受曲妥珠单抗+拉帕替尼双靶治疗,Ki67的抑制程度更高[16]。此前有文章研究拉帕替尼对p95HER2过表达的HER2阳性乳腺癌带来获益[17]。结合两者研究,我们有理由相信,p95HER2因为避开靶向药的结合且维持HER2的活性,从而发挥维持肿瘤细胞的高增殖特性。在我们的研究中,p95HER2与Ki67存在显著相关性。在p95HER2阴性组,Ki67低表达数目占比26.9%(7/26);而p95HER2阳性组中,Ki67低表达占比为0(0/21),提示p95HER2可能在恶性肿瘤细胞增殖过程中同样发挥作用。为了探讨p95HER2较全长HER2是否有更高的细胞增殖特性,我们进行了相关细胞株的细胞克隆形成实验,结果同样发现p95HER2过表达的BT474细胞具有更强的增殖能力,并且胞外段截短的p95HER2蛋白有着与HER2蛋白类似的促进细胞增殖的生物学功能,同时p95HER2蛋白可以抵抗HER2抗体药物(曲妥珠单抗)对HER2阳性细胞的抑制作用。此外,有研究针对不同乳腺癌分子亚型分析对比临床病理资料的关系,发现Ki67与血脂之间存在联系,且在TNBC及HER2阳性乳腺癌中,血清TC和LDL-C明显升高[18]。肥胖与癌症之间存在关联的流行病学证据是确凿的,而与肥胖相关的脂蛋白水平与癌症之间的关联则不那么明显。有文献研究提示循环血液载脂蛋白平与多种癌症风险相关[19]。另有研究提示血清中TC,HDL-C和APOA1的水平与乳腺癌风险相关[20]。因此,我们针对患者的生化指标进行了相关性分析,发现p95HER2阳性组TG较p95HER2阴性组高,该现象有待进一步探索。同时,研究提示了在HER2阳性乳腺癌患者中,当p95HER2蛋白的表达水平升高时,肿瘤组织中的Ki67增殖指数也会上升,肿瘤细胞的增殖能力增强。而p95HER2因为其表达在细胞外蛋白的截短而失去与曲妥珠单抗结合位点,导致肿瘤细胞对曲妥珠单抗治疗产生内在的抵抗性,这些研究对于理解HER2阳性乳腺癌的内在抗性和治疗方法具有重要意义。
