胰腺癌相关性成纤维细胞中前列腺环素合成酶对胰腺癌细胞作用研究
2023-11-04潘越刘勇李壮朱峰
潘越, 刘勇, 李壮, 朱峰
胰腺癌是世界上最具侵袭性和致命性的恶性肿瘤之一,预后极差,中位生存期不足6个月,然而目前胰腺癌的发病率仍在逐年上升[1-2]。胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDACs)是胰腺癌中最常见的病理类型(>90%)[3],其特点为起病隐匿,大部分患者确诊时已发生远处转移[4-5],并且治疗效果极不理想,即使在欧美等发达国家,患者5年生存率也仅为10%[5]。因此,深入探究与胰腺癌发生、发展相关的分子及机制,为临床治疗以及新型抗癌药的研发提供新的潜在靶点显得尤为重要。
癌相关性成纤维细胞(cancer-associated fibroblasts,CAFs)作为肿瘤微环境的重要组成部分,目前已有多项研究表明其在肿瘤发生、发展过程中发挥着重要作用,如参与肿瘤细胞外基质的建立与重塑[6],与癌细胞通过多种分泌方式相互对话[7],影响肿瘤细胞的增殖与侵袭[8],参与肿瘤细胞的免疫逃逸及扩散转移等[9]。在胰腺癌中,CAFs也已被证实是癌症进展的主要因素之一,其参与胰腺癌的血管生成、淋巴管生成、上皮-间充质转化以及转移前生态位的形成等[10-11]。前列腺环素合成酶(prostacyclin synthase,PGIS/PTGIS)是一种膜结合性血红素蛋白,有研究表明PGIS的高表达在肺癌[12]、乳腺癌[13]、卵巢癌[14]、结直肠癌[15]以及黑色素瘤[16]的进展中发挥重要作用,并与患者的不良预后相关,但尚未见PGIS与胰腺癌或CAFs的相关作用研究报道。现有研究者通过生物信息学分析表明PGIS在胰腺癌中的表达水平明显上调[16],提示可作为胰腺癌的潜在治疗靶点之一。因此,本研究拟通过系列体内外实验,探究胰腺癌CAFs细胞中的PGIS在胰腺癌发生、发展过程中的调控作用及相关作用机制,为胰腺癌的临床诊疗提供新的思路及科学理论依据。
1 材料和方法
1.1 材料
人胰腺癌细胞系Aspc-1、Bxpc-3、Capan-1、Panc-1、SW1990为南京医科大学附属逸夫医院中心实验室保存,人胰腺癌相关性成纤维细胞购于上海赛百慷生物技术股份有限公司,人胰腺星状细胞购于湖南丰晖生物科技有限公司。胎牛血清(FBS)、DMEM培养基、RPMI-1640培养基、青霉素-链霉素双抗溶液均购自赛默飞世尔科技(中国)有限公司,iCell原代成纤维细胞培养体系购自上海赛百慷生物技术股份有限公司。TRIzol试剂购自北京天根生化科技有限公司,逆转录试剂购自上海睿铂赛生物科技有限公司,q-PCR定量试剂购自上海翌圣生物科技股份有限公司。BCA蛋白质测定试剂盒、转染试剂Lipo 8000购自上海碧云天生物技术有限公司。Transwell小室培养板购自广州洁特生物过滤股份有限公司,基质胶购自美国Corning公司。CCK-8试剂盒购自上海翌圣生物科技股份有限公司,结晶紫购自上海生工生物工程股份有限公司。人PGIS过表达质粒pLV3-CMV-PGIS-EF1a-CopGFP-Puro购自武汉淼灵生物科技有限公司。siPGIS小干扰RNA、抗PGIS抗体、抗HIF-1α抗体均购自美国Santa Cruz公司,抗VEGFA抗体购自上海生工生物工程股份有限公司,抗Akt抗体、抗p-Akt抗体、抗GAPDH抗体、山羊抗兔IgG(H+L)HRP和山羊抗小鼠IgG(H+R)HRP二抗均购自武汉Proteintech公司。CoCl2购自上海Sigma-Aldrich公司。qRT-PCR相关引物均由南京金斯瑞生物科技有限公司合成。
1.2 方法
1.2.1 数据库分析 通过对GEPIA、Kaplan-Meier数据库胰腺癌组织的相关数据分析,观察PGIS在胰腺癌组织及正常胰腺组织中的表达差异,并进一步分析其表达水平与患者预后的关系,利用统计学软件进行数据处理,对PGIS在胰腺癌中的表达差异预测结果及预后情况进行描述,绘制出箱式图及生存曲线。
1.2.2 引物的设计与合成 从NCBI数据库查找人源PGIS、HIF-1α、VEGFA、FGF-2、α-SMA及MMP-9的mRNA序列,并依据Molloy等[17]的研究设计合成人源PGIS、HIF-1α特异性检测引物,依据Wang等[18]的研究设计合成人源VEGFA特异性检测引物,引物序列见表1。

表1 引物序列的设计与合成
1.2.3 CoCl2溶液的制备及细胞缺氧处理 在无菌蒸馏水中制备50 mmol/L CoCl2储备溶液,并在培养基中进一步稀释,以获得最终所需浓度。SW1990和CAFs细胞分别加适量10%FBS、1%青霉素/链霉素的DMEM和iCell培养基在标准CO2培养箱中培养,孵育24 h后,用不同浓度的CoCl2处理胰腺癌细胞和CAFs细胞。
1.2.4 总RNA提取及实时荧光定量PCR(qRT-PCR) 将细胞在TRIzol试剂中裂解,并根据制造商的方案,使用5×All-in-One RT MasterMix将提取的总RNA合成cDNA,用SYBR Green Master Mix进行实时荧光定量PCR。以GAPDH为内参基因,qRT-PCR反应体系为:2×SYBR Green Master Mix 5 μl,上下游引物各0.5 μl,cDNA 2 μl,无酶水补充至10 μl。每组设置3个平行复孔,采用相对定量法2-ΔΔCt分析mRNA的表达情况。
1.2.5 Western blot检测蛋白表达水平 将细胞用PBS洗一遍后吸净,加蛋白裂解液于冰上裂解5 min,12 000 rpm 4 ℃离心10 min,吸净上清液,用BCA试剂盒测定蛋白质浓度后煮沸变性。以GAPDH为内参,经电泳、转膜、封闭、一抗孵育过夜、洗膜、二抗孵育、洗膜后曝光,利用Image J软件进行蛋白条带的定量分析。
1.2.6 小干扰RNA(siRNA)瞬时转染 将CAFs细胞提前接种到6孔板(每个孔约2×105个细胞)中过夜,使用6 μl Lipo 8000及80 nM siRNA转染,6 h后换液,48 h后收取细胞上清液并提取细胞RNA,通过q-PCR实验检测其转染效率。
1.2.7 PGIS过表达稳转株的构建 将293T细胞接种到6孔板(每个孔约6×105个细胞)中过夜,使用10 μl PEI(1 mg/ml)将2.5 μg核心质粒(pLV3-CMV-EF1a-CopGFP-Puro及pLV3-CMV-PGIS-EF1a-CopGFP-Puro)、1 μg pMDLg/pRRE、0.4 μg pRSV-Rev和0.6 μg pMD2.G共转染至293T细胞中。48 h后,收集细胞上清液并用0.45 μm滤器过滤后分装冻于-80℃。将CAFs细胞接种到6孔板中(每孔约6×105个细胞)过夜,然后每孔分别加400 μl慢病毒感染48 h,之后再用1 μg/ml的嘌呤霉素筛选细胞,1周后验证转染效率。
1.2.8 细胞增殖实验 将胰腺癌细胞系接种在96孔板中(每个孔2×103个细胞,100 μl重悬液),以过表达PGIS的CAFs细胞上清作为培养基,分别在第0、1、3和5天的时间点,向该组的每个孔中加入10 μl CCK-8试剂,并在37 ℃下孵育1.5 h。孵育后,使用酶标仪在450 nm处测量吸光度值。
1.2.9 Transwell细胞迁移及侵袭实验 将胰腺癌细胞系提前饥饿12 h后,使用200 μl无血清培养基将5×104个细胞重悬后接种在Transwell小室内(侵袭实验需提前1 h于小室中加入35 μl基质胶并置于37 ℃培养箱孵育),在下室内加入过表达PGIS的CAFs细胞上清600 μl。培养48 h后,使用4%多聚甲醛室温下固定细胞20 min,并用0.1%结晶紫染色30 min后,洗去多余染料,用棉签擦除上室表面细胞后拍照,利用Image J软件进行计数分析。
1.2.10 胰腺原位成瘤模型构建 在NCG免疫缺陷鼠(雄性,4~6周龄)的胰尾部以1∶3的比例将control、过表达PGIS的CAFs细胞与胰腺癌细胞Aspc-1以100 μl PBS重悬后注射入小鼠胰腺(每只5×105CAFs,1.5×106Aspc-1)。8周后,对小鼠实施安乐死,解剖异种移植的肿瘤组织,剥离并称量肿瘤的重量,用游标卡尺测量肿瘤体积,计算公式为:肿瘤长径×肿瘤宽径2/2。
1.3 统计学方法
所有数据均使用GraphPad Prism软件进行分析,并以平均值±SEM表示,多组间比较采用单因素方差分析,两组间比较采用Student’st检验。P<0.05被认为差异具有统计学意义。
2 结果
2.1 PGIS在胰腺癌组织和正常胰腺组织中的差异表达
首先,为了探究PGIS在胰腺癌发展过程中的潜在作用,我们通过对GEPIA数据库中的胰腺癌相关数据进行分析,观察到PGIS在胰腺癌组织中的表达水平显著上调(图1A),并且表达量显著高于正常胰腺组织(图1B)。其次,我们利用Kaplan-Meier数据库分析了PGIS表达水平对胰腺癌患者预后的影响,发现PGIS高表达患者的预后显著低于PGIS低表达的患者(图1C)。这些分析结果表明,PGIS对胰腺癌的发生、发展可能具有促进作用。
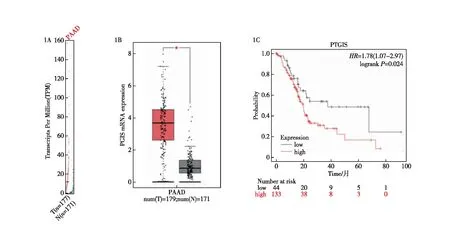
图1 PGIS在胰腺癌组织和正常胰腺组织中的差异表达及预后 1A:PGIS在胰腺癌组织中的表达水平明显上调;1B:PGIS mRNA在胰腺癌组织中的表达水平明显高于正常胰腺组织;1C:PGIS高表达患者的预后明显劣于PGIS低表达患者;T:胰腺癌组织;N:正常胰腺组织
2.2 PGIS在胰腺癌相关性成纤维细胞和正常胰腺星状细胞中的差异表达
有研究报道正常胰腺星状细胞(HPSC)是胰腺癌相关性成纤维细胞(CAFs)的主要来源[19],因此为进一步探究验证PGIS在原代细胞系中的表达差异,我们通过提取CAFs与HPSC的细胞RNA,通过q-PCR实验检测其PGIS的表达水平(图2)。通过此实验结果我们证实PGIS在CAFs中的表达水平显著高于其在HPSC中的表达水平,与PGIS在胰腺癌组织中的表达水平显著上调相符。
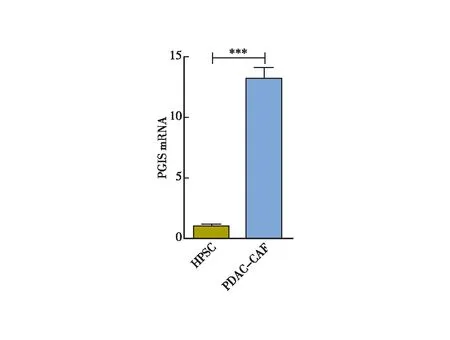
图2 PGIS在胰腺癌相关性成纤维细胞和正常胰腺星状细胞中的差异表达 注:PGIS mRNA在CAFs中的表达水平显著高于HPSC;***:P<0.001
2.3 低氧条件下培养胰腺癌细胞模拟肿瘤微环境模型的构建
通过上述结果,我们已经明确PGIS在胰腺癌中表达显著上调,并与胰腺癌患者的不良预后有关。为进一步验证其表达是否上调,我们利用CoCl2化学诱导构建肿瘤微环境缺氧模型,模拟胰腺癌发生、发展时的肿瘤微环境状态,以250 μM的终浓度加于胰腺癌细胞SW1990的完全培养基中,分别于0、4、8、12 h的时间点收取细胞蛋白,通过Western blot实验检测PGIS及HIF-1α的表达水平(图3)。通过此实验结果我们探究发现胰腺癌细胞在一定范围内随着缺氧时间的延长,PGIS及HIF-1α的表达水平均明显上调,与PGIS在胰腺癌组织中的表达水平显著上调相符。

图3 低氧条件下培养胰腺癌细胞模拟肿瘤微环境模型的构建 3A:Western blot检测SW1990细胞的PGIS和HIF-α表达水平;3B:SW1990细胞的PGIS和HIF-1α蛋白灰度分析;***:P<0.001
2.4 低氧条件下培养CAFs模拟肿瘤微环境模型的构建
由于CAFs在胰腺癌中发挥着十分重要的作用,为进一步探究CAFs在胰腺癌发生、发展过程中的具体作用及相关机制,我们首先通过利用CoCl2化学诱导构建肿瘤微环境缺氧模型,模拟胰腺癌发生、发展时的肿瘤微环境状态,以500 μM的终浓度加于CAFs的完全培养基中,分别于0、2、4、6 h的时间点收取细胞RNA,通过q-PCR实验检测PGIS、HIF-1α及VEGFA的表达水平(图4)。通过此实验结果我们发现CAFs在一定范围内随着缺氧时间的延长,PGIS、HIF-1α及VEGFA的表达水平均明显上调,提示CAFs在胰腺癌的发生、发展过程中可能具有促进作用,并且与PGIS密切相关。
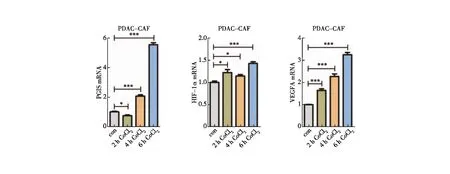
图4 低氧条件下培养CAFs模拟肿瘤微环境模型的构建注:q-PCR检测CAFs细胞的PGIS、HIF-1α和VEGFA表达水平;*:P<0.05;***:P<0.001
2.5 构建敲低和过表达PGIS的CAFs细胞模型
为继续深入探究CAFs中的PGIS在胰腺癌发生、发展过程中的明确作用及相关机制,我们通过利用siRNA转染和慢病毒感染的方式构建敲低和过表达PGIS的CAFs细胞,建立敲低和过表达PGIS的CAFs细胞模型,通过q-PCR和Western blot实验检测其敲低及过表达效率(图5)。通过以上实验结果显示,过表达PGIS的CAFs细胞中PGIS蛋白和mRNA的表达水平均显著上调,敲低PGIS的CAFs细胞中PGIS的mRNA表达水平显著下调,表明我们已成功构建出敲低及过表达PGIS的CAFs细胞模型并可以进行后续功能实验。
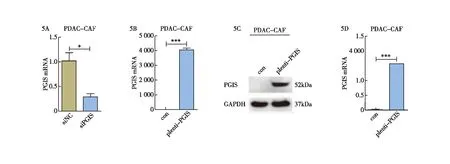
图5 构建敲低和过表达PGIS的CAFs细胞模型 5A:q-PCR检测CAFs细胞中PGIS的敲低效率;5B:q-PCR检测CAFs细胞中PGIS的过表达效率;5C:Western blot检测CAFs细胞中PGIS的过表达效率;5D:CAFs细胞的过表达PGIS蛋白灰度分析;*:P<0.05;***:P<0.001
2.6 CAFs中的PGIS在体外促进胰腺癌细胞的增殖
为探究CAFs中的PGIS在胰腺癌中的具体功能,我们首先检测了CAFs中的PGIS对胰腺癌细胞的增殖功能的影响。通过收取敲低和过表达PGIS的CAFs细胞培养上清,将其上清与胰腺癌细胞SW1990、Panc-1进行共培养,通过CCK-8实验检测,我们发现敲低CAFs中的PGIS可以明显抑制胰腺癌细胞的增殖速率,而过表达CAFs中的PGIS可以明显促进胰腺癌细胞的增殖速率(图6)。因此,通过以上实验结果我们可以确定CAFs中的PGIS在体外促进胰腺癌细胞的增殖功能。
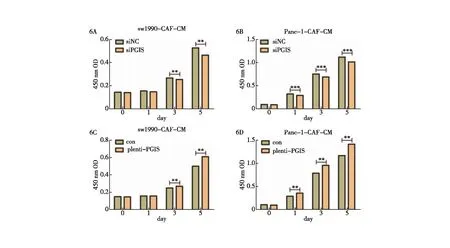
图6 CAFs中的PGIS在体外促进胰腺癌细胞的增殖 6A:敲低PGIS的CAFs对SW1990细胞增殖的影响;6B:敲低PGIS的CAFs对Panc-1细胞增殖的影响;6C:过表达PGIS的CAFs对SW1990细胞增殖的影响;6D:过表达PGIS的CAFs对Panc-1细胞增殖的影响;**:P<0.01
2.7 CAFs中的PGIS在体外促进胰腺癌细胞的迁移与侵袭能力
其次,我们探究了CAFs中的PGIS对胰腺癌细胞的迁移与侵袭能力的影响。通过收取敲低和过表达PGIS的CAFs细胞培养上清,将其上清作为胰腺癌细胞Bxpc-3、SW1990、Panc-1的下室培养液,通过Transwell迁移实验探究,我们发现敲低CAFs中的PGIS后胰腺癌细胞的迁移数量明显减少,而过表达CAFs中的PGIS后胰腺癌细胞的迁移数量明显增多(图7A~7E);将收取的敲低和过表达PGIS的CAFs细胞培养上清作为胰腺癌细胞Aspc-1、Bxpc-3、Capan-1的下室培养液,通过Transwell侵袭实验探究,我们发现敲低CAFs中的PGIS后胰腺癌细胞穿过基质胶的数量明显减少,而过表达CAFs中的PGIS后胰腺癌细胞穿过基质胶的数量明显增多(图7F~7J)。因此,通过以上实验结果我们可以确定CAFs中的PGIS在体外促进胰腺癌细胞的迁移与侵袭能力。
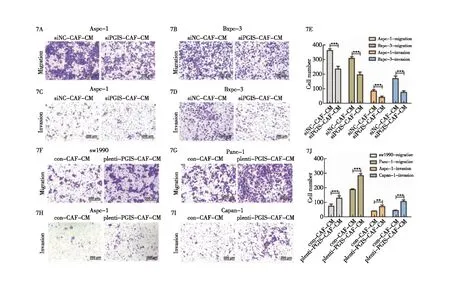
图7 CAFs中的PGIS在体外促进胰腺癌细胞的迁移与侵袭能力 7A:敲低PGIS的CAFs对Aspc-1迁移能力的影响(×10);7B:敲低PGIS的CAFs对Bxpc-3迁移能力的影响(×10);7C:敲低PGIS的CAFs对Aspc-1侵袭能力的影响(×10);7D:敲低PGIS的CAFs对Bxpc-3侵袭能力的影响(×10);7E:敲低PGIS的CAFs对胰腺癌细胞迁移和侵袭能力的定量统计分析;7F:过表达PGIS的CAFs对SW1990迁移能力的影响(×10);7G:过表达PGIS的CAFs对Panc-1迁移能力的影响(×10);7H:过表达PGIS的CAFs对Aspc-1侵袭能力的影响(×10);7I:过表达PGIS的CAFs对Capan-1侵袭能力的影响(×10);7J:过表达PGIS的CAFs对胰腺癌细胞迁移和侵袭能力的定量统计分析;**:P<0.01;***:P<0.001
2.8 过表达PGIS的CAFs在体内促进胰腺肿瘤的生长
为进一步探究CAFs中的PGIS在体内对胰腺癌细胞增殖能力的影响,我们构建了胰腺原位荷瘤模型,以1∶3的比例将过表达PGIS的CAFs细胞与胰腺癌细胞Aspc-1共注射于NCG小鼠,8周后解剖取肿瘤,实验结果发现与对照组相比,过表达PGIS的CAFs可以明显促进胰腺肿瘤的形成能力(图8)。通过此实验结果,我们证实了过表达PGIS的CAFs在体内同样具有促进胰腺肿瘤生长的能力。
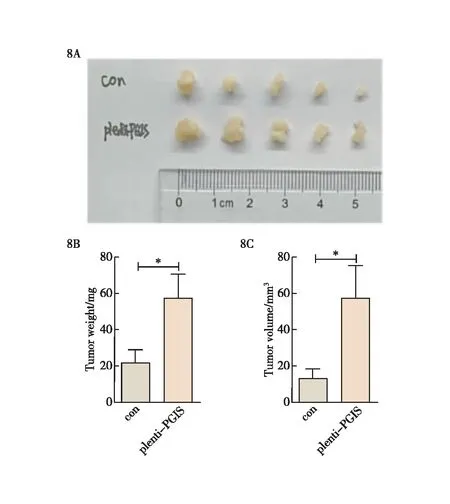
图8 过表达PGIS的CAFs在体内促进胰腺肿瘤的生长 8A:过表达PGIS的CAFs在体内对胰腺癌细胞增殖的影响;8B:小鼠肿瘤重量的定量统计分析;8C:小鼠肿瘤体积的定量统计分析;*:P<0.05
2.9 PGIS促进CAFs正调控VEGFA因子的表达
通过以上实验,我们已经确定CAFs中的PGIS可以促进胰腺癌的发生、发展,然而其调控胰腺癌发生、发展的机制仍需进一步探索研究。我们通过提取过表达PGIS的CAFs细胞蛋白,利用Western blot实验探究检测发现过表达PGIS后可明显提高CAFs对VEGFA因子的表达水平(图9)。通过此实验结果我们发现CAFs中的PGIS对正调控VEGFA因子的表达具有重要作用。
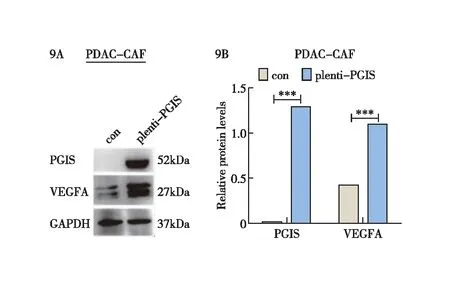
图9 PGIS促进CAFs正调控VEGFA因子的表达 9A:Western blot检测过表达PGIS的CAFs细胞的VEGFA表达水平;9B:CAFs细胞的PGIS和VEGFA蛋白灰度分析;***:P<0.001
2.10 PGIS在CAFs中通过正调控PI3K/Akt通路促进胰腺癌发展
为进一步探究CAFs中的PGIS促进胰腺癌发生、发展的具体机制及相关通路,我们将收取的过表达PGIS的CAFs细胞培养上清与胰腺癌细胞Aspc-1进行共培养,48 h后提取细胞蛋白,通过Western blot实验检测我们发现过表达CAFs中的PGIS后Aspc-1的Akt磷酸化水平呈现出明显升高趋势(图10)。通过以上实验结果,我们发现在胰腺癌中,CAFs中的PGIS可以促进Akt磷酸化,正向调控Akt信号通路的激活。
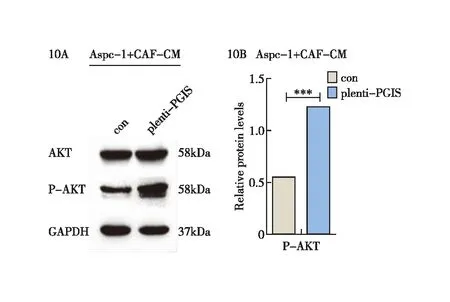
图10 PGIS在CAFs中通过正调控PI3K/Akt通路促进胰腺癌发展 10A:Western blot检测Aspc-1细胞的Akt蛋白及其活化形式p-Akt蛋白的表达水平;10B:p-Akt蛋白的灰度分析;***:P<0.001
2.11 PGIS促进CAFs正调控FGF-2、α-SMA及MMP-9等因子的表达
最后,我们通过提取过表达PGIS的CAFs细胞RNA,利用q-PCR实验探究检测发现过表达PGIS后可明显提高CAFs对FGF-2、α-SMA、MMP-9等因子的表达水平(图11)。通过此实验结果,我们发现CAFs中的PGIS可以正调控FGF-2、α-SMA、MMP-9等因子的表达,可能对促进胰腺癌的发生、发展具有重要作用。
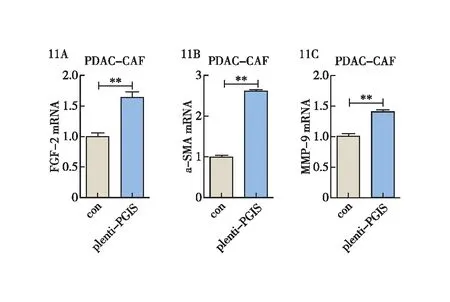
图11 PGIS促进CAFs正调控FGF-2、α-SMA及MMP-9等因子的表达 11A:q-PCR检测过表达PGIS的CAFs细胞FGF-2的表达水平;11B:q-PCR检测过表达PGIS的CAFs细胞α-SMA的表达水平;11C:q-PCR检测过表达PGIS的CAFs细胞MMP-9的表达水平;**:P<0.01;***:P<0.001
3 讨论
胰腺癌是最具侵袭性的恶性肿瘤之一,世界上发病率最高的地区为北美、欧洲和澳大利亚[2]。胰腺癌在欧洲最常见的癌症中排名第14位,但却是继肺癌、结直肠癌和乳腺癌之后第4位导致患者死亡的癌症相关原因[20],可见胰腺癌预后之差及恶性程度之高。目前手术治疗仍是根治胰腺癌的唯一方法,但即使在接受手术治疗的患者中,术后5年生存率也仅为15~25%[2]。因此,深入探索研究胰腺癌发生、发展以及侵袭、转移的具体相关机制显得尤为迫切。CAFs是肿瘤微环境中含量最丰富、最主要的成分[10],在肿瘤的发生、发展中发挥着十分重要的作用,目前研究已证实CAFs可通过旁分泌和细胞外基质重塑等多种方式促进肿瘤进展,产生治疗耐药和介导免疫抑制等[21-23]。近些年来,CAFs在肿瘤发生、发展中的作用越来越受到重视,然而CAFs与胰腺癌进展的相互作用机制研究尚不足,尤其是探究CAFs中相关基因或分子的表达水平对胰腺癌发生、发展的作用机制研究有较大空缺。
PGIS为前列环素合成酶,是CYP450家族的成员之一,其可以催化PGH2转化为PGI2[24]。目前已经发现PGIS在肺癌、乳腺癌、卵巢癌、结直肠癌以及黑色素瘤等多种恶性肿瘤中表达上调,并且与患者预后不良有关[12-16]。在本研究中,我们利用生物信息学分析发现PGIS在胰腺癌组织中的表达水平明显上调,并与患者的不良预后相关,我们通过构建敲低及过表达PGIS的CAFs细胞,将收集的CAFs细胞培养上清与胰腺癌细胞进行共培养,并且将过表达PGIS的CAFs细胞与胰腺癌细胞共注射入小鼠胰尾部构建胰腺原位成瘤模型,进而探究CAFs细胞中的PGIS在胰腺癌发生、发展过程中的调控作用以及相关作用机制。我们首次证明敲低CAFs中的PGIS后可明显抑制胰腺癌细胞的生长、迁移及侵袭,而过表达CAFs中的PGIS后又可明显促进胰腺癌细胞的生长、迁移及侵袭,在胰腺癌中具有促癌作用,可能是胰腺癌的潜在治疗靶点之一。
在本研究中,我们发现在过表达PGIS的CAFs细胞中血管内皮生长因子A(VEGFA)在整个培养期间显著上调。研究表明VEGFA是调节病理性血管生长和维持的关键介质,也是一种有效的血管通透性诱导剂[4]。PI3K/Akt通路是一条经典信号通路,已有多项研究证实胰腺癌可通过PI3K/Akt通路促进肿瘤的发生、发展[25-27]。我们将CAFs细胞培养上清与胰腺癌细胞进行共培养,收取细胞蛋白,通过Western blot实验探究发现过表达CAFs中的PGIS后可以明显上调磷酸化Akt的蛋白水平,正向调控Akt信号通路的激活,表明PGIS可通过激活PI3K/Akt信号通路促进胰腺癌的进展。最后,我们还通过q-PCR实验发现,过表达CAFs中的PGIS后可促进CAFs细胞对FGF-2、α-SMA及MMP-9等因子的表达,可能对促进胰腺癌的发生、发展具有一定的作用。
综上所述,我们通过体内外实验探究证实了过表达PGIS的CAFs细胞可以通过PI3K/Akt信号通路正向调控VEGFA的表达上调,进而促进胰腺癌的发生、发展,明确了CAFs中的PGIS在胰腺癌进展中发挥的重要调控作用,可能为胰腺癌的潜在治疗靶点之一。然而,PGIS、VEGFA及Akt信号通路之间发挥作用联系的具体分子机制尚未阐明,后续我们将继续深入探究CAFs中的PGIS调控胰腺癌的具体机制,并通过收集相关临床标本及患者资料进一步检测证实我们的实验结果,为胰腺癌的临床诊疗以及新型抗癌药的研发提供新的理论依据。
