铁硫比对施氏矿物微观结构及吸附铬性能的影响
2023-11-04李佳蔓王晓明胡欣蕊谢莹莹文震
李佳蔓,王晓明,胡欣蕊,谢莹莹*,文震
1. 韩山师范学院化学与环境工程学院,广东 潮州 521041;2. 深圳大学化学与环境工程学院,广东 深圳 518060
酸性矿山废水(Acid Mine Drainage,AMD)主要来源于黄铁矿等硫化矿物的氧化风化,其中含有大量的重(类)金属和SO42-等离子,pH 介于2-5.5 之间(Chen et al.,2015;谢莹莹,2018),容易引起矿区各介质中重金属污染的环境问题。在此极端酸性的条件下极易形成一种典型的铁羟基硫酸盐次生矿物——施氏矿物,化学式为Fe8O8(OH)8-2x(SO4)x(1≤x≤1.75)(Bigham et al.,1996;Regenspurg et al.,2004),比表面积较大且含有大量羟基、SO42-等基团。在AMD 条件下,施氏矿物结构中的SO42-能够被与其离子半径、所带电荷相似,且与矿物结构中Fe(III)具有较强络合能力的AsO43-、CrO42-和 MoO42-等含氧阴离子取代(Wilkinson et al.,1987;Dzombak et al.,1990;Antelo et al.,2012),同时这些含氧阴离子能一定程度上提高施氏矿物的稳定性(Regenspurg et al.,2005)。鉴于其特殊的“管状隧道”结构及类质同象现象(Jonsson et al.,2005),施氏矿物能够通过吸附作用来固载AMD 中有毒有害金属元素,阻止它们进一步的转移扩散(Liao et al.,2011;Chen et al.,2015)。因此,许多研究通过实验合成施氏矿物并应用于环境修复领域重金属的吸附去除(Liao et al.,2009;Paikaray et al.,2011)。
施氏矿物的合成方法主要有化学法和生物法,其中化学法又可再分为双氧水氧化Fe2+法和Fe3+的水解透析法(Xie et al.,2022;Zhou et al.,2022)。生物法合成施氏矿物颗粒均匀且矿物比表面积高于化学法合成者(李浙英等,2011),但相对于化学法合成过程,生物法的合成过程较复杂且耗时长,因而其经济效益较之化学法合成低。因此,在环境修复领域中较多采用的是化学法合成制备的施氏矿物。研究表明,化学法合成的矿物颗粒呈现细小球状且颗粒轮廓相对圆滑,粒径约为400-600 nm 之间,稍小于生物法合成的施氏矿物粒径(2-3 μm),但存在显著的颗粒团聚现象(李浙英等,2011;梁剑茹等,2012)。并且即使相同体积、浓度的FeSO4·7H2O 溶液为合成原料时,不同方法合成的施氏矿物其化学式、矿物的颜色和比表面积等都存在着一定的差异(李浙英等,2011)。已有前人研究通过调控合成时的pH 和温度控制施氏矿物的矿化作用,影响该矿物对重金属不同的吸附性能(Ying et al.,2020;Ding et al.,2022)。自然界形成的施氏矿物也存在一定的差异性,如在Ohio 煤矿废水中发现的施氏矿物Fe-S 比率介于4.60-8.00 之间(Bigham et al.,1996),而在山西省马兰煤矿废水中形成的施氏矿物Fe-S 比率为3.43-4.97(孙红福等,2006),鉴于施氏矿物Fe-S比率多变性(Jae-Young et al.,2002;Meng et al.,2021),我们可推测不同Fe-S 比率的施氏矿物会呈现不同的表面性质和特征,进而可能影响着其环境化学过程与修复应用。目前鲜见于探究不同Fe-S比率对施氏矿物微观结构及其吸附重金属性能的影响报道。
铬是AMD 环境以及水体污染中常见的重金属之一,关于铬吸附材料已有大量的报道(Rao et al.,2012;郑君里等,2022)。施氏矿物作为酸性矿山废水中天然的矿物吸附剂,由于拥有巨大的比表面积、丰富的表面羟基活性基团和同晶置换的特点(Eskandarpour et al.,2008),因而在环境中铬治理研究领域中得到了高度的关注,此外,施氏矿物还具备在强酸强碱环境中结构易破坏和重金属易回收的特点。基于此认识,本文拟通过调控Fe-S 比率,分析Fe-S 比率对施氏矿物微观结构的影响,在此基础上探究施氏矿物对重金属铬吸附能力的差异性能,阐明施氏矿物吸附铬的作用机理及影响规律。研究结果,可为AMD 中重金属污染的环境修复提供理论依据。
1 材料与方法
1.1 实验主要试剂与仪器
主要试剂或药品: 七水硫酸亚铁(FeSO4·7H2O)、硝酸(HNO3)、硫酸(H2SO4)、丙酮(C3H6O)、氢氧化钠(NaOH)、无水硫酸钠(Na2SO4)均为分析纯,均由天津市大茂化学试剂厂提供。过氧化氢(H2O2,纯度为30%)、铬酸钾(K2CrO4,纯度为 99.5%)和二苯碳酰二肼(C13H14N40,AR)等分别由西陇科学股份有限公司、麦克林单位提供。实验用水为去离子水。
主要仪器:摇床(BSD-WX3300,上海博迅)、离心机(TDZ5-WS,湖南湘仪)、X 射线衍射仪(XRD,Ultima VI,日本理学)、扫描电子显微镜(SEM,Tescan MIRA LMS,捷克泰斯肯)、全自动比表面及孔隙度分析仪(BET,MicromeriticsTristar 3000,美国麦克)、傅立叶红外光谱(FTIR,Shimadzu IRTracer-100,日本岛津)和透射电子显微镜(TEM,FEI Tecnai G2 F20,美国FEI)。
1.2 施氏矿物的合成
施氏矿物采用快速化学法(Xie et al.,2022;郑妍婷等,2023)合成,以硫酸钠为变量控制合成矿物中SO42-的含量以控制Fe-S 比率,具体步骤为:将5 等份83.0 g 的FeSO4·7H2O 溶于5.00 L 的去离子水中,并分别加入0.00、8.70、21.3、42.7、85.3 g 无水硫酸钠充分溶解后,迅速滴加50.0 mL 双氧水并快速搅拌使之充分溶解后静置培育24 h,得到施氏矿物的悬浊液,倒掉上清液,收集沉淀物,再加入去离子水静置洗涤,重复多次。待上述步骤完成后,放置于20.0 ℃的烘箱中烘干,所得的施氏矿物分别标记为Sch 1、Sch 2、Sch 3、Sch 4 和Sch 5,矿物具体元素含量通过盐酸消解并测定Fe 和S的含量而确定(Antelo et al.,2012;Zhang et al.,2021)。
1.3 吸附实验步骤
称取一定量的施氏矿物(0.100、0.300、0.600 g)分别加入Cr(Ⅵ)初始浓度为5.00、20.0、50.0 mg·L-1的溶液中,通过0.100 mol·L-1NaOH 调节pH 值3-7 之间随后将反应瓶置于25 ℃,180 r·min-1摇床中进行振荡吸附反应。于180 min 进行取样(预实验证明180 min达到吸附饱和),所取子样品过0.450 μm 滤膜后置于冰箱中保存待测。Sch 1、Sch 2、Sch 3、Sch 4 和Sch 5 等5 种施氏矿物的操作同上,同时设置3 组平行实验。
1.4 分析测定方法
离子的测定:置于冰箱中的样品溶液中,使用二苯碳酰二肼分光光度法测定六价铬离子的浓度,波长为540 nm,测定完毕后,并使用Origin 绘图软件对数据进行整合并绘制成相应的关系图。
固体样品的测定:反应前后的矿物样品进行烘干收集后,采用XRD 对其进行晶型结构分析,其中的X 射线为Cu 靶Kα 射线,扫描区域为10.0°-80.0°,扫描速度为2.00 (°)·min-1。利用SEM 分析矿物的颗粒及其表面形貌,TEM 分析结晶颗粒的大小。采用全自动比表面及孔隙度分析仪测定矿物的比表面积和介孔粒径等,通过傅立叶红外光谱对矿物表面官能团进行表征。
2 结果与讨论
2.1 合成矿物的组成和表征分析
2.1.1 合成矿物的化学组成和晶体结构特征
矿物的元素组成及化学式如表1 所示,固体样品的铁硫Fe-S 比率并不随着制备体系中加入SO42-质量的增加而呈现规律性的降低,当制备体系中SO42-浓度到达一定值后,固体矿物的铁硫比会随着制备体系中SO42-浓度的升高而增大,即Sch 4 的铁硫比率最低,为4.72,而Sch 5 的铁硫比最高(6.13),5 种矿物对应的化学式分别为Fe8O8(OH)5.16(SO4)1.42、Fe8O8(OH)5.00(SO4)1.50、Fe8O8(OH)4.78(SO4)1.61、Fe8O8(OH)4.62(SO4)1.69和Fe8O8(OH)5.38(SO4)1.31。本研究所合成的施氏矿物铁硫比与文献报道的一致,即施氏矿物中铁硫比范围一般在4.60-8.00之间(Bigham et al.,1990;Jonsson et al.,2005)。此外,还可通过控制微生物合成或培育过程中的环境pH 等方法调控铁硫比,如Ding et al.(2022)报道,通过控制快速合成法合成施氏矿物时体系的pH 为2.50、2.70 和2.90 可得到对应施氏矿物的Fe-S 比率分别为4.63、4.45 和4.53。

表1 合成矿物的化学组成和晶胞参数Table 1 The chemical composition and cell parameter of the synthetic mineral
矿物样品的XRD 谱图如图1 所示,存在较多毛刺,峰宽较大,均出现8 个特征衍射峰,对应JCPDS 卡片中施氏矿物的特征峰18.2o(210)、26.3o(310)、35.2o(212)、39.5o(302)、46.5o(113)、55.3o(522)、61.3o(004)和63.7o(204),这说明合成的矿物样品均为施氏矿物。从XRD 粉末衍射数据中精修得到的施氏矿物单元晶胞参数(表1)可知,硫酸钠的加入使得参数c和体积V降低。据报道(Bigham,1994),施氏矿物的晶胞参数a=10.7 Å,c=6.04 Å,V=687 Å3,其中Z=1.00,可能的空间群为P4/m,与本研究结果接近。5 种矿物样品在35.2o峰位处出现轻微漂移,对应着晶胞参数的变化。此外,不同Fe-S 比率的施氏矿物总体晶型不变,未见明显的退化结构现象,但Sch 2 在35.2o和63.7o处的特征峰减弱现象相对明显。有文献(Ying et al.,2020)报道,随着合成时水解温度从25 ℃升高到60 ℃时,Fe-S 比率从6.25 下降到5.18,得到的纯施氏矿物结晶度会逐渐增大,即峰值强度在2.55 Å(35.2o)处增强。因此,施氏矿物的结晶度可能与硫酸盐含量有关,即硫酸盐含量越高导致结晶度增加。
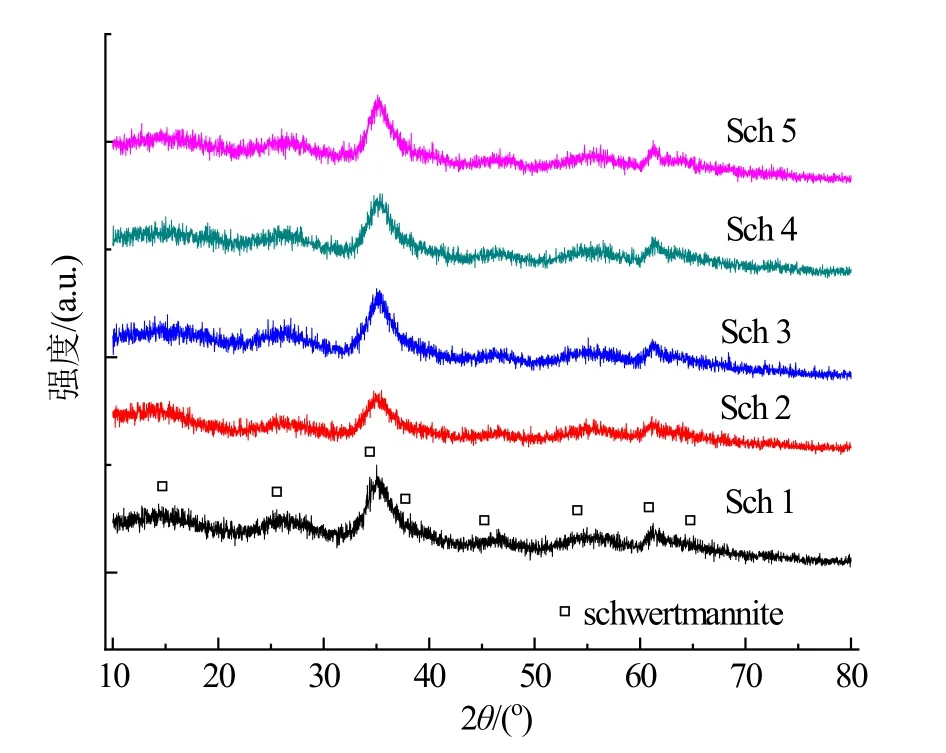
图1 矿物XRD 图Figure 1 XRD patterns of minerals samples
2.1.2 合成矿物的形貌特征
合成的施氏矿物主要呈现棕黄色的细散颗粒状,据报道,次生铁矿物的颜色与矿物中铁的含量相关,当铁含量较低时呈现黄色,随着铁含量升高矿物颜色呈现红棕色(Gramp et al.,2008;刘奋武等,2015;李旭伟等,2020)。矿物的表面形貌由SEM 图(图2)分析,Sch 1、Sch 2、Sch 3、Sch 4为堆叠的球状颗粒,颗粒轮廓相对圆滑,但表面有少量小颗粒毛刺出现,可为后续吸附污染物提供较多的吸附点位,与文献(Regenspurg et al.,2005)报道的结果一致,且颗粒孔隙逐渐增大。施氏矿物颗粒大小可从TEM 图(图3)中清晰体现,大约在100-300 nm 之间,与文献报道的快速法合成施氏矿物平均直径约250 nm(Paikaray et al.,2011)一致。颗粒不太规则,且呈现大量堆叠结构,个别聚集体颗粒为600-800 nm,其中Sch 5 的粒径最小,分散性最差,其质地较为坚硬。高分辨的TEM 图中可发现样品Sch 1、Sch 2、Sch 3、Sch 4 和Sch 5的矿物表面少量细小颗粒或毛刺的局部区域存在微弱的晶格条纹,表明合成的施氏矿物结晶性差,其分别对应施氏矿物的(212)、(522)、(310)、(310)和(212)晶面。此外,EDS 对矿物元素分析结果表明不同铁硫比施氏矿物的Fe、O 与S 元素半定量含量分析推断施氏矿物的铁硫比率在4.60-8.00 范围内(Bigham et al.,1996),进一步验证该矿物是施氏矿物。

图3 矿物的透射电子显微镜图Figure 3 TEM images of the mineral samples
2.1.3 合成矿物的表面官能团结构
不同铁硫比的施氏矿物FTIR 谱图未见明显变化(图4)。据文献的报道,SO42-主要有4 种振动峰,形态包括了SO42-分子内三重简并非对称伸缩振动宽峰ν3(SO4)在1 130 cm-1出现尖锐峰,伴随着两个肩峰分别为1 052 cm-1和1 200 cm-1肩峰;波数 983 cm-1为硫酸盐对应的分子内的伸缩峰ν1(SO4);位于610 cm-1的是分子内的弯曲振动峰ν4 700 cm-1对应为F-O 的伸缩振动峰,波数为3 460 cm-1和1 620 cm-1的是-OH。随着铁硫比的降低,在波数1 130 cm-1、983 cm-1、610 cm-1处的特征峰出现减弱的现象,其中样品Sch 4 处减弱的现象最为明显,表明矿物的表面SO42-和-OH 等官能团减少。样品Sch 4 的铁硫比为4.72,是5 个样品中最低,可见硫酸盐含量越高,矿物的结晶度越好。

图4 矿物的红外谱图Figure 4 FTIR images of the mineral samples
2.1.4 合成矿物的矿物比表面积及孔隙结构分析
N2吸-脱附曲线如图5 所示,根据国际纯粹与应用化学联合会(IUPAC)针对气体物理吸附法的吸附等温线形态将吸附过程的分类(Thommes et al.,2015)可知,样品Sch 1、Sch2、Sch3、Sch 4和Sch 5 吸附等温线均可被看作是IV(a)类和II 类吸附等温线的组合。这表明实验合成的5 种样品存在一定的介孔特征,等温线的吸附曲线与脱附曲线不一致,可以观察到迟滞回线。在P/P0值较高的区域可观察到一个平台。与等温线分类类似,IUPAC 也将物理吸附过程中出现的不同形状的回滞环进行分类(Thommes et al.,2015),对比观察可以发现Sch 1、Sch3、Sch 4 和Sch 5 样品的回滞环类似于H3 型,表明样品可能为层状结构的聚集体,孔型为产生狭缝的介孔。而Sch 2 样品的回滞环可在一定程度上被划分为H2 型,表明样品可能为呈现密堆积的球型颗粒,孔型为“墨水瓶”孔或球形颗粒间隙孔(李旭伟等,2020)。由表2 可知,5 种样品BET 的大小规律为Sch 1>Sch 5>Sch 2>Sch 4>Sch 3;其中Sch 1 的比表面积最大,为81.8 m2·g-1,BET比表面最小的是Sch 3,其铁硫比为4.97;BJH 吸附平均孔径Sch 2 最小,为7.33 nm;最大为样品Sch 4,对应的BJH 吸附平均孔径为14.5 nm。

图5 矿物的N2-吸附-脱附等温线Figure 5 N2 adsorption-desorption isotherms of the mineral samples

表2 矿物比表面积及平均孔径的变化Table 2 The specific surface area and average pore size of minerals
2.2 吸附实验结果分析
不同Fe-S 比率的施氏矿物对应的六价铬去除率随着浓度的升高而降低(图6a),本结果与朱立超等(2017)报道的类似。其中Sch 2 样品在相同条件下取得了最大的铬去除率为83.0%。通过对比可知,当吸附饱和时,Cr 溶液初始浓度从5 mg·L-1升高到50 mg·L-1的过程中,Sch 1、Sch 2、Sch 3、Sch 4 和Sch 5 溶液中Cr(Ⅵ)去除率分别从70.4、83.0%、73.6%、73.3%和67.3%下降至57.2%、69.9%、58.7%、56.7%和56.1%。由图6b 可知,不同Fe-S比率的Sch 对应的Cr(Ⅵ)去除率随着施氏矿物投加量的增加而升高,这是因为施氏矿物与Cr(Ⅵ)的反应是接触反应,施氏矿物投加量的增加增大了施氏矿物与Cr(Ⅵ)有效接触面积,提高二者接触的可能性。当Sch 投加量为0.6 g 时,Sch 1、Sch 2、Sch 3、Sch 4 和Sch 5 对应的去除率分别为79.7%、85.6%、79.0%、78.5%、80.8%。同样地,相同条件下Sch 2对Cr(Ⅵ)的去除能力最佳。初始pH 值对于施氏矿物吸附Cr(Ⅵ)效果的影响如图6c 所示,当初始pH值为5.00 时,均取得最大的去除率。据报道,pH值在3.00-6.00 之间时,施氏矿物对于Cr(Ⅵ)的去除率随着pH 值的增大而增大,但是在6.00-10.00之间时,Cr(Ⅵ)的去除率随着pH 值的增大而减小,所以最佳的pH 范围为6.00-7.00 之间(陈福星,2006;朱立超等,2017);但也有报道pH 在4.50时施氏矿物对于Cr(Ⅵ)去除效率最高(Antelo et al.,2012)。此外,根据文献的报道施氏矿物的零电荷点为 4.20-7.20 之间(Jonsson et al.,2005;Eskandarpour et al.,2008),当溶液的pH 小于pHpzc时,施氏矿物表面带正电荷,有利于吸附阴离子CrO42-(Rakhunde et al.,2012)。在本研究中,当pH 为从3.00 升到5.00 时,Sch 1、Sch 2、Sch 3、Sch 4和Sch 5 对Cr(Ⅵ)的去除率分别升高了15.7%、13.1%、15.0%、18.6%、14.8%,但其中Sch 2 获得最高的去除率。

图6 初始铬浓度、投加量和pH 对施氏矿物吸附CrO42-的影响Figure 6 Effects of initial Cr(VI) concentration, dosage and pH on the adsorption of CrO42- by schwertmannite
Ding et al.(2022)通过反应过程中矿物中SO42-的释放动力学证明了施氏矿物对Cr(Ⅵ)的吸附过程涉及SO42-产生配位体交换的离子置换反应,本文也初步测定了溶液中SO42-的浓度,呈现升高的趋势,与文献报道的一致。根据陈福星(2006)的报道,当溶液中SO42-的浓度大于10.0 mmol·L-1时,施氏矿物对Cr(Ⅵ)的吸附去除效果开始下降。Sch 4中SO42-的含量最高,而Sch 5 虽然SO42-含量低,但质地较硬,松散性较差,导致其吸附性能差。矿物Sch 3 的比表面积最低,不利于吸附。而矿物Sch 1 的比表面积大于Sch 2,但是吸附效果较弱。因此下文通过比较反应后矿物的晶型和官能团来进一步明确吸附的差异性。
2.3 反应后矿物的XRD 和FTIR 表征
根据反应后产物的施氏矿物XRD 谱图(图7a)可知,Sch 1、Sch 2、Sch 3、Sch 4 和Sch 5 反应后的矿物相仍以施氏矿物为主,从XRD 粉末衍射数据中精修得到的施氏矿物单元胞参数可知,由于CrO42-的离子半径略大于SO42-,反应后施氏矿物的晶胞参数a 和体积均略微增大。由于Sch 1 矿物的稳定性相对较差,呈现向针铁矿相(特征峰分别为21.3、33.5、36.5、40.8、50.7、52.9、58.8、61.3 和63.7°)转变的趋势。据报道(Rakhunde et al.,2012),施氏矿物的相转变产物主要为针铁矿,但由于针铁矿的比表面积比施氏矿物小,吸附性能也相对较差,所以Sch 1 的环境稳定性较差,导致其吸附能力弱于Sch 2。相比于反应前的矿物FTIR 谱图(图7b)可知,反应后的波数在1 000 cm-1左右处发生了较大的变化。在1130、983、610 cm-1所对应的峰ν3(SO4)、ν1(SO4)和ν4(SO4)强度减弱,说明了CrO42-的吸附与结构中的SO42-存在一定的相关性;此外,反应后的该矿物在946、781 和761 cm-1处均有较明显的吸收,且而这3 处波数可以归属为CrO42-吸收峰(Regenspurg et al.,2005)。另据报道(Xie et al.,2022),当环境条件改变时,施氏矿物容易产生相转变,而其中pH 是施氏矿物结构稳定最重要的控制参数,当pH 升高时,施氏矿物会自发转变为更稳定的针铁矿,相应地引起吸附的重金属再次分配,因此,除了合成时应适当控制Fe-S 比率外,还应注意施氏矿物应用的环境条件,防止施氏矿物失稳。
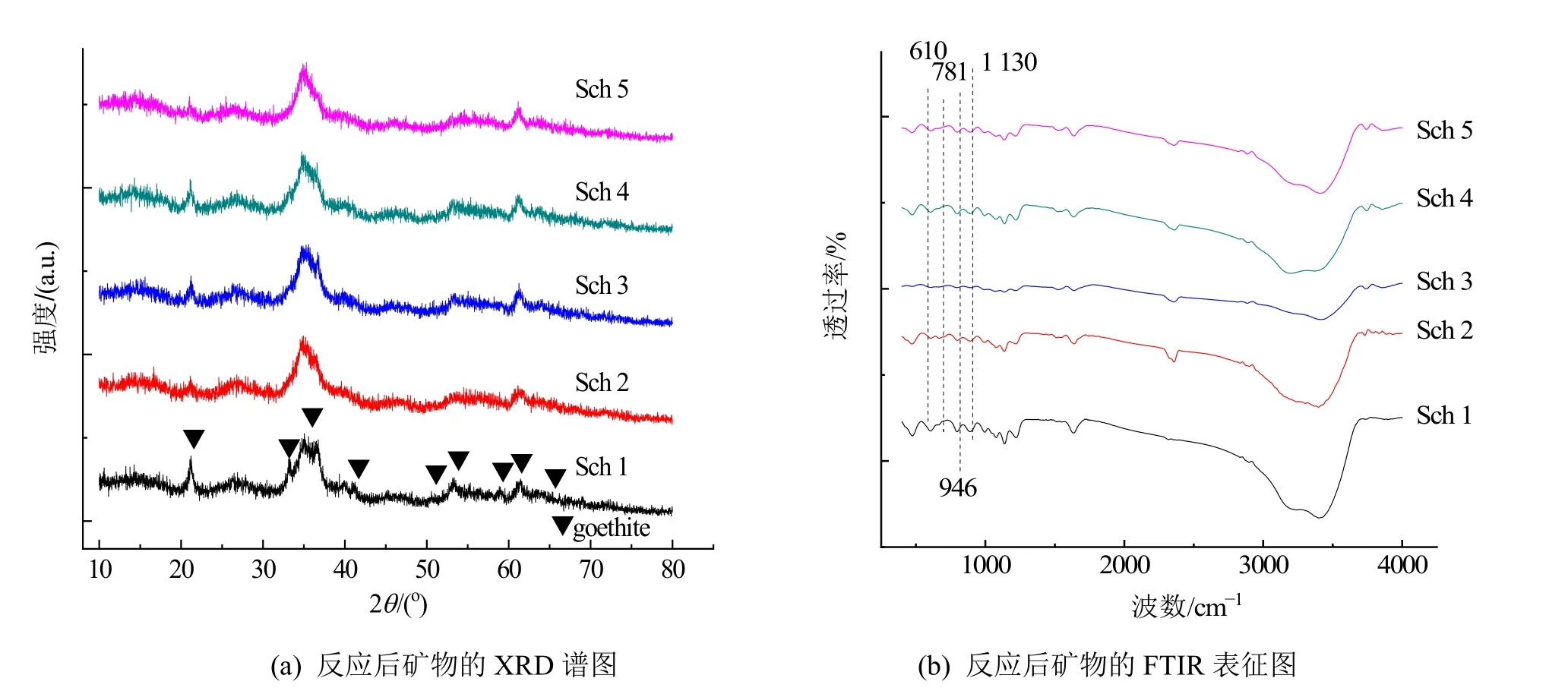
图7 反应后矿物的XRD 和FTIR 表征图Figure 7 XRD and FTIR images of schwertmannite after reaction
3 结论
本文通过快速化学法利用硫酸钠调控合成制备了不同Fe-S 比率的施氏矿物,当硫酸钠投加量为85.3 g 时,得到的施氏矿物Fe-S 比率为最大值,5种施氏矿物的Fe-S 比率大小顺序为Sch 5>Sch 1>Sch 2>Sch 3>Sch 4。施氏矿物的Fe-S 比率越低其硫酸盐含量越高,则矿物的结晶度越好。施氏矿物中适当的SO42-含量有利于矿物对水体中六价铬的吸附,且在相同的实验条件下,当Fe-S 比率为5.32时取得最佳的吸附效果,当pH 为5.00 时有利于吸附的进行,同时反应后施氏矿物晶体结构基本不变。因此,当施氏矿物作为吸附剂应用于环境修复治理时,应注意施氏矿物的环境稳定性。
