一例化疗联合免疫治疗无效胰腺癌患者再联合靶向治疗有效
2023-11-04唐科忠
张 波,唐科忠,董 鑫
浙江大学医学院附属第二医院外科,浙江 杭州 310009
胰腺癌是一种常见的消化道恶性肿瘤,是目前所有消化道肿瘤中病死率最高、存活率最低的癌症,患者5 年存活率仅7%~9%。由于其位置深,且缺乏早期诊断方法,70%~80%的胰腺癌患者确诊时已为局部晚期或远处转移,只有10%的患者适合手术切除[1]。即使患者可接受手术,其术后发生复发、转移的概率也很大,并且这些复发及晚期患者往往放疗和化疗效果不佳。在过去十几年里,尽管外科手术技术进步、各种新型化疗药物出现、联合治疗方案不断更新,胰腺癌患者的预后仍然没有明显改善[2]。在精准治疗时代,伴随着肿瘤靶向治疗及免疫治疗的进展,胰腺癌的综合治疗也有了更多选择[3]。本文报道一例晚期胰腺癌患者通过化疗联合免疫及靶向治疗后行根治手术切除已生存19个月的病例,以供同道参考。本研究通过浙江大学医学院附属第二医院伦理委员会审查[2023 伦审研第(2023-0912)号],且获得患者知情同意。
1 病历摘要
患者男性,68岁,因“纳差1 个月,加重3 d”于2022 年3 月11 日 在我院就诊。入院后诊治过程见图1。患者1 个月前无明显诱因下出现纳差,未予治疗。3 d 前诉胃纳加重,偶伴有上腹隐痛。外院查腹部MRI 发现胰尾部占位,临近脾静脉受侵,肝内多发占位。入院后查腹部增强CT 发现胰尾部占位,大小约39 mm×23 mm×21 mm;肝内多发占位,较大者为17 mm×14 mm(图2)。肿 瘤 标 志 物CA199 为2003.4 U/mL,且CA125(92.6 U/mL)、CA242(109.8 U/mL)水平均有明显升高。血常规、肝功能检查未见明显异常。行肝转移灶穿刺活检,病理检查结果提示恶性肿瘤,细胞巢、腺样分布,部分区见黏液样物分泌,考虑胰腺导管腺癌来源可能性大。免疫组织化学检查结果显示,CK(AE1/AE3)阳性、CK19 阳性、CK7 阳性、Muc-1 阳性、GPC3 阴性、GS散在阳性、HSP70散在阳性、Muc-4阴性、Muc-5AC散在阳性、Muc-6 阴性、CDX2 阴性、CK20 阴性、Ki-67阳性率50%。患者既往有高血压、结肠癌术后病史。患者入院诊断考虑胰腺癌伴肝转移。

图2 患者治疗期间的腹部增强CT成像图Figure 2 The contrast-enhanced CT images of the patient during the treatment
结合患者病理检查结果,排除化疗禁忌后予改良FOLFIRINOX 化疗方案即“奥沙利铂+亚叶酸钙+伊利替康+5-氟尿嘧啶”联合派安普利单抗0.2 g,每三周一次。两周期治疗后复查发现胰尾及肝脏肿块未减小(图2),CA199 水平较前明显升高(图3)。考虑化疗联合免疫治疗效果欠佳,2022 年5 月3 日起加用安罗替尼10 mg,1 次/d,于化疗第1~14 天给药。期间定期复查发现胰尾及肝脏肿块减小(图2),CA199水平较前下降(图3)。加用安罗替尼四周期后再次评估,发现胰腺病灶及肝转移灶较前明显缩小,经多学科讨论及与家属商议后于2022 年8 月24 日行腹腔镜下胰体尾切除、脾切除及肝转移灶切除术,术后标本外观见图4。术后再次行三周期改良FOLFIRINOX 联合安罗替尼及派安普利单抗治疗,三周期后维持安罗替尼及派安普利单抗治疗,随访至2023 年9 月30日患者未见明显复发(图2)。
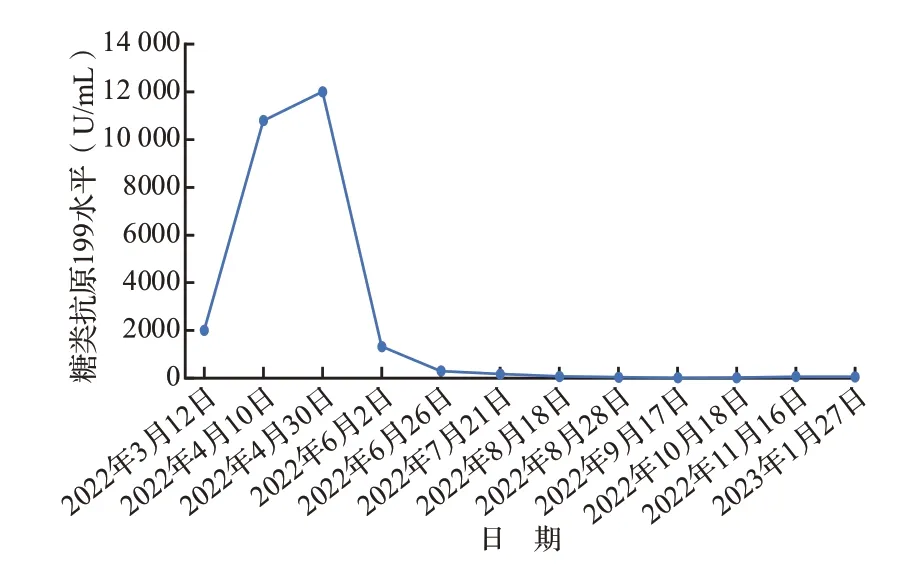
图3 患者治疗期间的糖类抗原199变化曲线Figure 3 The level of CA199 during the treatment
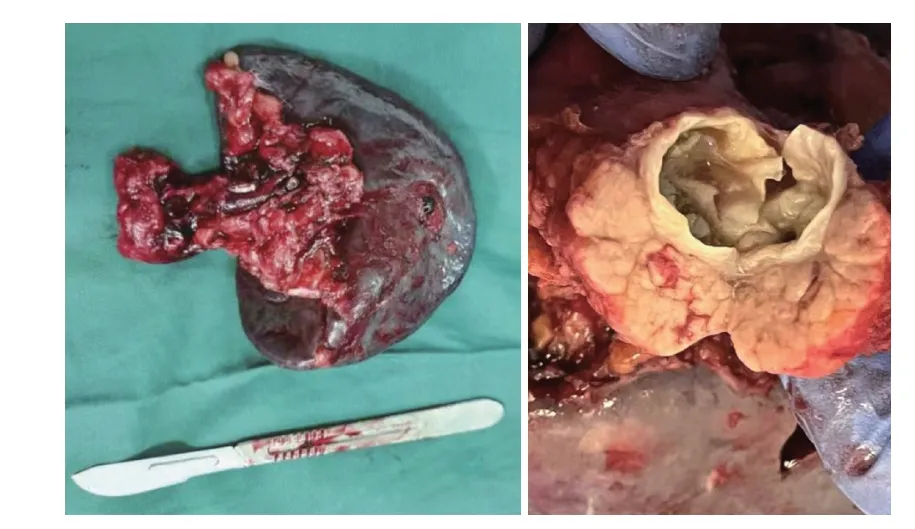
图4 患者手术标本大体观Figure 4 The morphology of the patient’s specimen
2 讨 论
由于胰腺癌的早期症状不典型,肿瘤细胞生物侵袭性强,常伴有微转移,很大一部分患者确诊时已丧失了手术切除的可能性,因此姑息性化疗成为晚期胰腺癌的标准治疗方法[1]。标准一线化疗方案包括吉西他滨联合白蛋白结合型紫杉醇或改良FOLFIRINOX[4]。作为二线治疗药物,伊立替康脂质体通过靶向肿瘤细胞,促进肿瘤血管正常化、改善肿瘤缺氧环境,延缓肿瘤的进展,对肿瘤转移患者有较好的疗效[5]。研究表明,与单独使用吉西他滨比较,FOLFIRINOX、吉西他滨联合白蛋白结合型紫杉醇、白蛋白结合型紫杉醇联合替吉奥、吉西他滨联合替吉奥、伊立替康脂质体联合氟尿嘧啶等多药化疗方案有一定优势,可以获得较好的疾病控制和患者更长的存活时间[6]。然而,本例患者中,改良FOLFIRINOX 方案并未取得令人满意的效果,显示肿瘤对该化疗方案耐药,推测与致密的组织结构如透明质酸、胶原蛋白等构成物理屏障,肿瘤微环境中如肿瘤干细胞、肿瘤相关成纤维细胞[7]及免疫相关细胞如肿瘤相关巨噬细胞、肿瘤浸润淋巴细胞等会增加胰腺癌细胞的抗药性等有关。
免疫治疗对大部分肿瘤如淋巴瘤、胃癌等有很好的疗效。然而对于胰腺癌,除了一些特定类型如高卫星不稳定型和错配基因缺失型[8],免疫治疗并没有取得较理想的疗效。研究表明,常用的免疫检查点抑制剂如抗细胞毒性淋巴细胞抗原4 及抗程序性死亡受体1,无论是单独使用还是联合使用,均不能明确改善胰腺癌患者的存活时间[9-10]。本文资料中,患者采用化疗联合派安普利单抗治疗,没有获得良好的疗效。胰腺癌免疫治疗低效的原因可能与其独特的肿瘤微环境(T 淋巴细胞浸润性差)和由胰腺星状细胞、免疫细胞和内皮细胞等多种致癌细胞构成胰腺癌的特异性细胞外基质等因素有关[11]。
抗血管生成的靶向药物目前在临床上广泛应用,用于胰腺癌治疗也获得了更多的临床证据。抗血管生成抑制剂只能抑制肿瘤细胞生长但不能杀死肿瘤细胞,因此,抗肿瘤血管生成的靶向药物常需要与细胞毒性化疗药联合使用[12]。本例胰腺癌患者在化疗联合免疫治疗无效的情况下加用抗血管生成靶向药物获得了较好的抗肿瘤效果,但其具体机制尚不明确。有研究显示,酪氨酸激酶抑制剂伊鲁替尼(Ibrutinib)联合化疗药物可以改善肿瘤微环境,增加免疫治疗药物对转移性胰腺癌患者的疗效,表现为效应CD8+T 细胞增加及肿瘤微环境改变,如肥大细胞功能抑制、血管生成减少、结缔组织形成减少,进而增强抗肿瘤反应[13]。脯氨酸异构酶Pin1 抑制剂可诱导促结缔组织的破坏和免疫抑制的微环境,增强药物的穿透性和功能[14]。因此,本例患者肿瘤明显缩小,肿瘤指标下降,反映出肿瘤对化疗及免疫治疗的良好反应,推测酪氨酸激酶抑制剂安罗替尼具有多个靶点,可能通过改变肿瘤微环境促使血管正常化,增加免疫细胞浸润,促使派安普利单抗发挥效应,同时利于化疗药物更多地进入肿瘤内部。但是,上述推测需要积累更多病例资料来证实。
志谢 研究得到国家自然科学基金(81570698)支持
Acknowledgements This work was supported by National Natural Science Foundation of China (81570698)
利益冲突 所有作者均声明不存在利益冲突
Conflict of Interests The authors declare that there is no conflict of interests
©The author(s) 2023.This is an open access article under the CC BY-NC-ND 4.0 License (https://creativecommons.org/licenses/by-nc-nd/4.0/)
