重庆地区高香型花椒种质资源品质评价
2023-11-03黄明曾维友张义刚程玥晴阚建全彭先容谢永红
黄明 曾维友 张义刚 程玥晴 阚建全 彭先容 谢永红









摘 要 对采集自丰都县的5种高香型新鲜花椒样品(丰椒1号、丰椒2号、丰椒3号、丰椒4号、丰椒5号)进行了品质分析,包括花椒的百粒重、籽皮比、水分含量、总灰分含量、醇溶抽提物含量、不挥发性乙醚抽提物含量、挥发油含量等,同时使用气相色谱-质谱联用(GC-MS)对挥发油的组成成分进行了定性与定量分析,使用高效液相色谱(HPLC)对主要麻味物质(花椒酰胺)含量进行了定量分析。此外,还依靠严格培训过的感官评价小组分别对花椒样品的香味和麻味特征属性进行了多指标感官定量评价,对花椒样品整体麻度做了时间-强度感官评价。结果表明:5种鲜花椒的颗粒大小和籽皮比没有显著差异,丰椒1号中的矿物质含量最高,丰椒1号和丰椒5号中的有机物质含量最高,丰椒5号中的不挥发性有机物质含量最高。从香气和麻味这两个指标综合分析认为,综合品质较好的为丰椒1号和丰椒5号,其中丰椒1号的香气品质最好,丰椒5号的麻味品质最好。
关键词 花椒;品质;香气;麻味;成分分析;感官评价;重庆地区
中图分类号:S573 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2023.15.004
芸香科(Rutaceae)花椒属(Zanthoxylum L.)植物在全球范围内约有250个种,广泛分布于亚洲、美洲、非洲和大洋洲的亚热带和热带地区,以中国的花椒种质资源最为丰富,已发现45个种和13个变种,主要分布于中国西南地区。目前,全球花椒的栽培种主要是花椒(Zanthoxylum bungeanum)和竹叶花椒(Zanthoxylum armatum)两个种,规模化栽培花椒的国家主要有中国、印度、韩国和日本,中国的花椒栽培面积和产量均居全球首位。花椒在我国华北、华中、华南、西北和西南地区均有大规模栽培,其中西南地区是我国花椒产业的主产区。近年来,随着花椒消费的普及,花椒作为重要的香辛料经济林木,产业规模持续扩大,花椒产量以每年约20%的增速快速增长,在荒山治理,生态保护、脱贫攻坚及乡村振兴等方面都发挥了重要的作用[1-2]。
花椒的大小、颜色、香气与麻味都是评价其品质的重要指标。不同品种、不同产地、不同栽培环境下花椒的大小与颜色差异较大,而且采后加工与贮藏方法也会严重影响产品的表观颜色。相对于花椒大小与颜色,香气与麻味则是花椒作为香辛料的关键评价指标。香气和麻味均来源于花椒果皮,构成花椒果皮的主要化学成分是挥发油、酰胺类、生物碱、香豆素、黄酮类与脂肪类物质,其中花椒挥发油是香气的主要来源,烯烃类、醇类、酮类、酯类和环氧化合物是挥发油的主要组分,其中含量相对较高的是月桂烯、柠檬烯和芳樟醇[3]。芳樟醇、柠檬烯、乙酸芳樟酯和乙酸松油酯可能是区别不同竹叶花椒(Z. armatum)品种的特征挥发成分,但区别不同花椒(Z. bungeanum)品种的特征挥发物还不明确[4]。而溶于醇的酰胺类有机物是花椒麻味的主要来源,这类长链不饱和脂肪酸酰胺通常被称为花椒麻味物质或花椒麻素。我国花椒种质资源果皮中酰胺类物质含量分布区间是1.3~20.1 mg·g-1,平均含量为12.0 mg·g-1 [5]。花椒麻味物质主要包括花椒素、异花椒素、双氢花椒素、四氢花椒素、α-山椒素、γ-山椒素、脱氢γ-山椒素、羟基α-山椒素、羟基β-山椒素、羟基γ-山椒素等[6-7]。虽然花椒的麻味强度与酰胺类物质的总量有一定的相关性,但不同酰胺类物质的麻味强度却不尽相同,所以不同花椒的麻味强度实际上是受这些酰胺类物质的组成和含量的双重影响[8-9]。
我国花椒种质资源种类丰富、分布广泛,蕴含了大量品质优良的种质。相对于日本、韩国等国家,我国花椒种质资源的收集保存与选育工作虽然起步較晚,但通过近30年的努力探索,已取得显著成就。前期对花椒种质资源的评价主要集中在形态学、细胞学和生理生化等方面,而近年来随着分子标记、基因组测序技术与色谱质谱联用技术的运用普及,对花椒种质资源的遗传多样性进行了较为全面深入的评价[10-14],也陆续选育出一批优质、多抗的种源或品种,为花椒产业发展提供了重要支撑和保障。此外,我国科研工作者最近陆续对多个花椒种及其近缘种的全基因组进行了高质量绘制与组装,这也为深入挖掘花椒品质性状种质及解析花椒品质形成的分子机理奠定了重要基础[15-18]。
1 材料与方法
1.1 材料与试剂
1.1.1 植物材料
5种丰都花椒新鲜样品:丰椒1号、丰椒2号、丰椒3号、丰椒4号、丰椒5号。所有花椒样品均于2022年6月21日在重庆市丰都县采摘,采摘后当天冷藏运输至实验室进行检测。花椒样品运至实验室后各取一部分立即测定水分、百粒重及籽皮比重,剩余样品贮藏于-80 ℃冰箱中用于后续指标测定。
1.1.2 仪器设备
BSA124S-CW电子分析天平,赛多利斯科学仪器(北京)有限公司;DZF-6020鼓风干燥箱,上海齐欣科学仪器有限公司;Agilent 1260高效液相色谱仪,安捷伦科技有限公司;Centrifuge 5810离心机,艾本德(上海)国际贸易有限公司进口;PS-60AL超声仪,深圳市雷德邦电子有限公司;GCMS-QP2010气相色谱-质谱联用仪,日本岛津公司。
1.1.3 试剂药品
甲醇:分析纯,重庆市钛新化工有限公司;甲醇:色谱纯,重庆市钛新化工有限公司;乙醚:分析纯,重庆市钛新化工有限公司;无水乙醇:分析纯,重庆市钛新化工有限公司;正癸烷标准品:≥99.0%,重庆市钛新化工有限公司;羟基-α-山椒素、羟基-β-山椒素、羟基-ε-山椒素、羟基-γ山椒素标准品:≥98.0%,成都麦德生科技有限公司;柠檬烯标准品,重庆市跃翔化工有限公司;芳樟醇标准品,重庆朋强石油化工有限公司。
1.2 试验方法
1.2.1 样品预处理
将新鲜花椒的梗、叶去除,干燥处理后分离籽和皮,计算籽与皮比重。挥发油的提取按照要求用整粒新鲜花椒进行,其余指标的测定用整粒鲜花椒粉碎后的冷冻花椒样品进行。
1.2.2 花椒百粒重测定
参考中华人民共和国国家标准“GB/T 5519-2018 谷物与豆类 千粒重的测定”并做适当修改,对花椒中百粒重进行测定。
1.2.3 花椒水分含量测定
参考中华人民共和国国家标准“GB 5009.3—2016 食品安全国家标准 食品中水分的测定”对花椒中水分含量进行测定。
1.2.4 花椒总灰分含量测定
参考中华人民共和国国家标准“GB 5009.4—2016 食品安全国家标准 食品中灰分的测定”对花椒中总灰分含量进行测定。
1.2.5 花椒醇溶抽提物测定
参考中华人民共和国国家标准“GB/T 12729.10-2008 香辛料和调味品 醇溶抽提物的测定”对花椒中醇溶抽提物进行测定。
1.2.6 花椒不挥发乙醚抽提物测定
参考中华人民共和国国家标准“GB/T 12729.12-2008 香辛料和调味品不挥发性乙醚抽提物的测定”对花椒中不挥发性乙醚抽提物进行测定。
1.2.7 花椒麻味物质(花椒酰胺)含量测定
参考中华人民共和国供销合作行业标准“GH/T 1291-2020 花椒及花椒加工产品 花椒酰胺总含量的测定 高效液相色谱法”并做如下适当修改,对花椒中主要花椒酰胺的含量进行测定。称取0.5 g粉碎后的鲜花椒样品与50 mL甲醇混合,并在50 ℃和300 W条件下超声处理40 min。处理后的混合物于4 500 r·min-1离心10 min,保留离心后上清液,并将剩余沉淀物再次与30 mL甲醇混合重复提取。取以上两次提取得到的上清液混合并定容至100 mL,以0.22 μm有机滤膜过滤后即为提取的麻味素溶液。色谱分析使用安捷伦Eclipse XDB-C18色谱柱(250 mm×4.6 mm,5 µm),流动相为离子水(洗脱液A)和甲醇(洗脱液B)。柱温40 ℃,检测波长为270 nm,流速为1 mL·min-1,进样量为10 μL。梯度洗脱40 min。以羟基-α-山椒素、羟基-β-山椒素、羟基-ε-山椒素及羟基-γ-山椒素的标准曲线计算麻味物质含量。
1.2.8 花椒挥发油含量测定
参考中华人民共和国国家标准“GB/T30385-2013/ISO 6571:2008 香辛料和调味品 挥发油含量的测定”对花椒中挥发油含量进行测定。收集的挥发油继续用于其组成成分的测定。
1.2.9 花椒挥发油组成成分测定
参考中华人民共和国供销合作行业标准“GH/T 1294—2020 花椒挥发性成分的测定 气相色谱-质谱法”并做如下做适当修改,对花椒中挥发油组成成分与含量进行测定。准确吸取15 µL提取的青花椒挥发油,加入150 µL正癸烷(0.01 g·mL-1)作为内标物,用无水乙醇定容至5 mL用于GC-MS分析。GC-MS色谱条件:色谱柱为DB-5MS石英毛细柱(30 m × 0.25 mm,0.25 µm);升温程序:60 ℃保持10 min,先以2 ℃·min-1升至70 ℃,然后以10 ℃·min-1升至140 ℃,再以5 ℃·min-1升至170 ℃维持1 min,最后以15 ℃·min-1升至230 ℃并保持10 min;进样口温度:250 ℃;载气:He;流速:3 mL·min-1;压力:40.7 kPa;进样量:5 μL;进样方式:以分流比5∶1分流进样。质谱条件:电子轰击(EI)离子源;离子源温度:230 ℃;电离能:80 eV;采集方式:Scan;扫描速度:1 666 u·s-1;质量扫描范围:35~500 m/z。挥发油样品中成分的定性通过计算保留指数,由计算机检索与NIST 08s. LIB和NIST 17. LIB谱库匹配获得,柠檬烯和芳樟醇采用外标法进行准确定量。定量分析按公式计算:
Cvo=Cd·ms1·V1/( ms2·V2) (1)
(1)式中,Cvo为挥发油组分浓度,Cd为正癸烷内标浓度,mg·mL-1;ms1为挥发油组分峰面积,ms2为正癸烷内标峰面积,ng·(mL-1·h-1);V1为内标物体积,V2为挥发油体积,mL。
1.2.10 花椒香氣感官评价
从西南大学本科学生中招募了50名年龄18~20岁、拥有良好的感官敏锐度及经常食用花椒的人作为培训对象。按照中华人民共和国国家标准“GB/T 16291.1—2012 感官分析选拔、培训与管理评价员一般导则 第1部分:优选评价员”的基本要求,进一步筛选出13名符合要求的评价员,组成了感官评价小组。参考本课题组之前建立的花椒麻感和香气评价指标,对小组成员进行了总共30 h的培训。
通过小组讨论将每种香气属性配有1~4个参比,通过定量描述分析法(QDA法)对多个评价指标进行评分(见表1)。最终的评估过程是在白色评价隔间中进行的。评价时,整颗新鲜花椒样本以随机顺序依次呈现,所有样本均采用三位数随机编码,以消除偏差。感官小组成员分别评估鲜花椒样品中嗅闻到的香气强度,且对在训练期间产生的每个香气属性都进行了评估。数值范围为0~15,增量为0.5,其中0表示无,15表示极高。为了最大限度地减少评估员嗅觉疲劳的影响,每次会议都向每位小组成员提供热毛巾。
1.2.11 花椒麻味感官评价
1.2.11.1 定量描述分析法(QDA法)
通过小组讨论将每种麻感属性配有1~4个参比样。通过定量描述分析法(QDA法)对多个评价指标进行评分(见表2)。最终的评估过程是在白色评价隔间中进行的。评价人员在正式评价前先漱口,再将1颗鲜花椒果皮送至舌尖,左右牙齿各咀嚼3下后吐出。评价时,花椒样本以随机顺序依次呈现,所有样本均采用三位数随机编码,以消除偏差。感官小组成员分别评估样品中感受到的麻感属性,且对在训练期间产生的每个麻感属性都进行了评估。数值范围为0~15,增量为0.5,其中0表示无,15表示极高。
1.2.11.2 时间-强度法(TI法)
采用实验室前期研究建立的鲜花椒麻度感官评价的15 cm标记线性标度。由经验丰富的感官分析师统一评价小组的感觉测量范围,建立3点麻感标度及其标度值:“3 cm-微麻”“7.5 cm-较麻”“10 cm-麻”,并通过培训使评价员能够很好地掌握麻度标度值对应语义。实验在经过标准化设计的纸质回答表上进行,由感官分析师进行统一计时,评价员在规定的时间点上参考15 cm麻感强度参比标度进行强度估计。评价人员在正式评价前先漱口,再将1颗鲜花椒果皮送至舌尖,左右牙齿各咀嚼3下后吐出,同时由感官分析师计时,在感官评价回答表上进行,整体麻感强度记录评价时间为入口开始计时,90 s前每隔10 s记录口腔感知的整体麻感强度,90 s后每隔30 s记录1次,直至900 s实验结束。每个样品重复测定3次,样品呈送符合随机、平衡原则。在实验过程中允许小组成员在实验期间短暂休息,并在必要时离开感官实验室进行调整,避免味觉疲劳给实验结果造成不必要的误差。
1.2.12 试验数据处理
通过主成分分析(PCA)对 QDA数据进行处理,数据使用每个香气属性或麻感属性的小组平均数据得分。运用XLSTAT对TI数据进行非线性曲线拟合。所有显著性检验均采用GrapPad Prism 8软件,在5%的显著性水平下进行方差分析。
2 结果与分析
2.1 花椒百粒重、籽皮比及水分、总灰分、醇溶提取物、不溶性乙醚抽提物含量
测定结果显示(见表3),5种鲜花椒的百粒重与籽皮比在统计学上均没有显著差异;丰椒2号的含水量显著高于丰椒4号和丰椒5号,丰椒1号的总灰分含量最高,其次是丰椒2号、丰椒4号和丰椒5号,丰椒3号的总灰分含量最低,说明丰椒1号中的矿物质含量最高;丰椒3号和丰椒4号的醇溶抽提物含量最低,而丰椒1号和丰椒5号的醇溶抽提物含量最高,说明丰椒1号和豐椒5号中的有机物质含量最高;丰椒5号的不挥发性乙醚抽提物含量最高,其次是丰椒1号和丰椒2号,丰椒3号和丰椒4号的不挥发性乙醚抽提物含量最低,说明丰椒5号中的不挥发性有机物质含量最高,但按照中华人民共和国国家标准《花椒》(GB/T30391-2013),这5种鲜花椒的不挥发性乙醚抽提物均达到了“鲜花椒一级标准”。
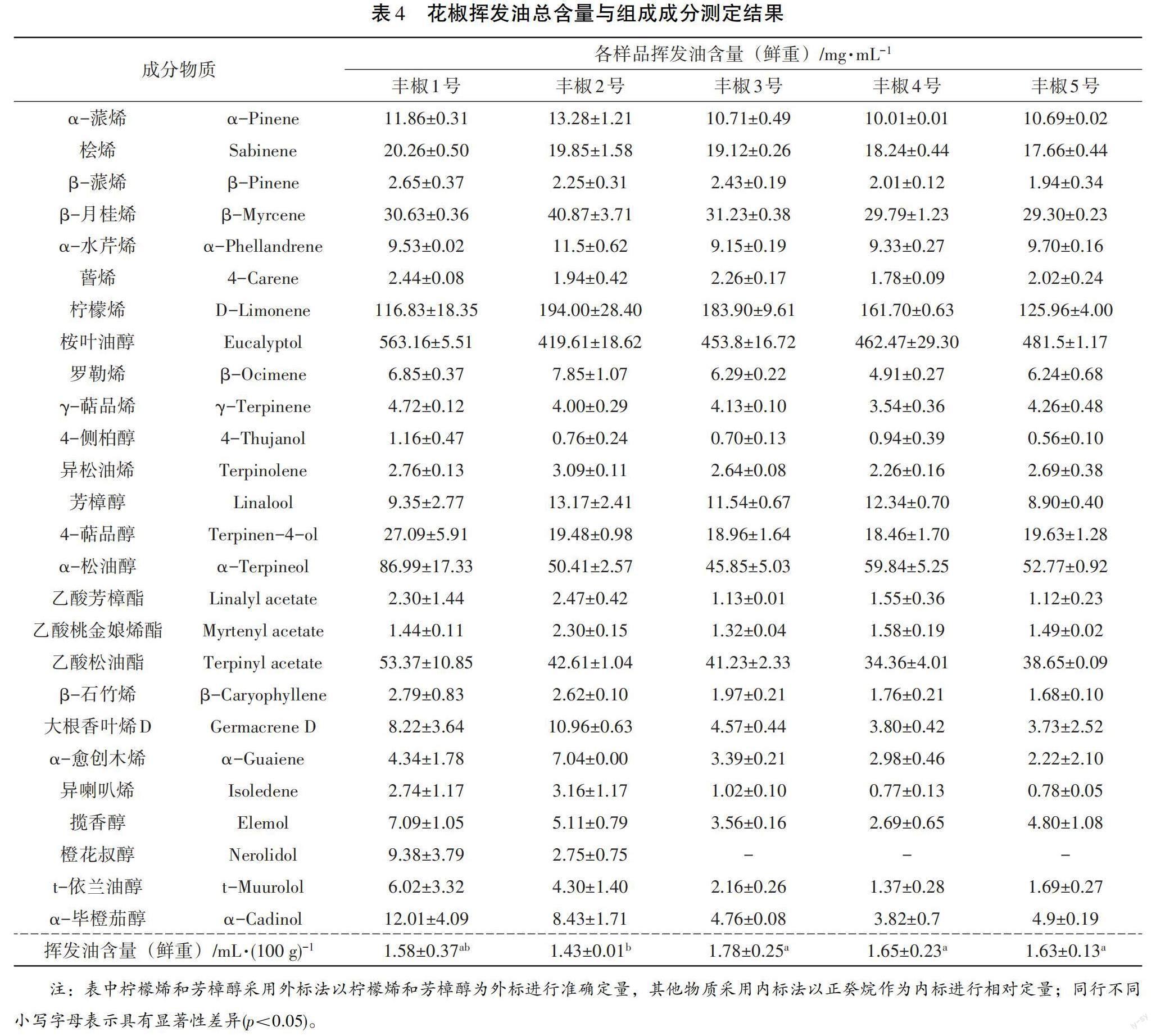
2.2 花椒挥发油含量与组成成分
5种花椒挥发油含量测定结果显示(见表4),丰椒3号、丰椒4号和丰椒5号鲜花椒的挥发油含量都显著高于丰椒2号,这说明丰椒2号的香气最弱。按照中华人民共和国国家标准《花椒》(GB/T30391-2013), 这5种花椒的香气均达到了“鲜花椒一级标准”。挥发油组成成分测定结果显示,从5种花椒的挥发油中共分析鉴定出26种物质,其中桉叶油醇、柠檬烯、α-松油醇、乙酸松油酯、β-月桂烯、桧烯、α-蒎烯、4-萜品醇、芳樟醇的含量都超过了10 mg·mL-1,可能是这5种鲜花椒的挥发油中的主体香气物质;其中丰椒1号的桉叶油醇、桧烯、α-松油醇、4-萜品醇、乙酸松油酯的含量均高于其他花椒,这表明丰椒1号的香味可能最为浓郁,但5种鲜花椒挥发油中各种香气物质的比例和组成差异较大,其香气特征也应有较大不同。
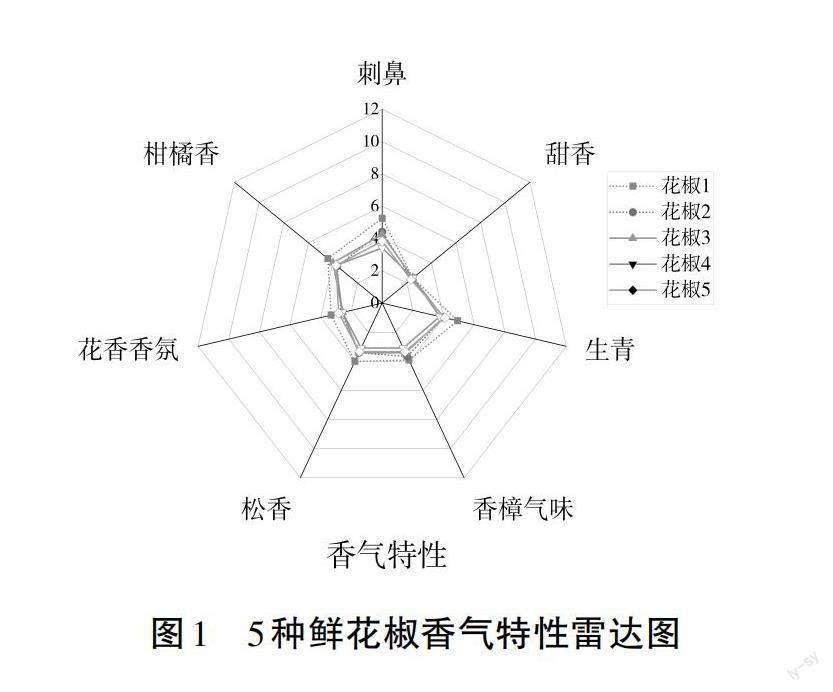
2.3 花椒香气特性
5种鲜花椒香气的定量评价分析(QDA)结果如图1所示,其中与香气相关的属性为刺鼻、甜香、生青、香樟气味、松香、花香香氛、柑橘香和薄荷香。丰椒1号(花椒1)在除甜香外的所有其他属性指标上均获得了最高的分数,这说明丰椒1号具有较优的整体香气。
进一步使用主成分分析法(PCA)分析5种鲜花椒样品与其香气感官特征属性之间的关系发现(见图2),5种鲜花椒样品的香气特征各有不同,其中丰椒4号(花椒4)与其他花椒样品距离最远,也与各香气感官属性距离最远,说明其香气特征与其他5种鲜花椒样品差距最大,香气强度相对较弱。值得注意的是,相较于其他花椒样品,丰椒1号(花椒1)距离薄荷香、刺鼻、柑橘香、香樟气味、花香香氛和整体香气强度的距离均是最短的,说明丰椒1号具有最强的薄荷香、刺鼻、柑橘香、香樟气味、花香香氛及整体香气强度。
2.4 花椒麻味物质(花椒酰胺)含量
花椒麻味物质含量测定结果显示(见表5),丰椒5号的麻味物质总含量最高,丰椒2号和丰椒2号麻味物质总含量最低;4种主要麻味物质(花椒酰胺)的含量在5种鲜花椒中均存在显著差异,值得注意的是,丰椒5号的4种主要花椒酰胺含量均高于其他花椒样品,说明丰椒5号的麻味最厚重。
2.5 花椒麻感特性
5种鲜花椒麻感定量评价分析(QDA)结果如图3所示,其中与麻感相关的属性为麻木感、刺痛感、灼热感、振动感、垂涎感和苦味,丰椒5号(花椒5)在除刺痛感外的所有其他属性上均获得了较高的分数,说明丰椒5号具有较优的整体麻感。
进一步使用主成分分析(PCA)法分析这5种鲜花椒样品与其麻味感官属性之间的关系发现(见图4),5种鲜花椒的麻感特征各有不同,其中丰椒2号(花椒2)与其他花椒样品的距离最远,也与各麻味感官属性距离最远,说明其麻感特征与其他花椒样品差距最大。值得注意的是,相较于其他花椒样品,丰椒5号(花椒5)距离垂涎感、麻木感、振动感、灼热感的距离均是最短的,说明丰椒5号具有极强的垂涎感、麻木感、振动感、灼热感。
2.6 花椒麻感-時间特征
对5种鲜花椒样品的整体麻感强度进行了时间-强度(TI)方法的测定,结果如图5所示。5种鲜花椒样品具有相似的麻感-时间特性,均呈现麻感强度快速上升然后缓慢下降的趋势特点,花椒入口后麻感一直快速持续上升,120~210 s时麻感达到最强值,随着时间进一步延长,麻感逐渐降低,麻感消失时间在780~900 s。
运用XLSTAT软件对5种鲜花椒样品的TI曲线进行分析,并提取出6个特征参数,分别为麻感最大强度(Imax)、最大麻感强度出现的时间(tmax)、最大麻感强度持续时间(tpl)、麻感总体持续时间(tT)、曲线下面积(ms,uc)、麻感感知增加率(rinc)。结果显示(见表6),5种鲜花椒样品中,丰椒5号(花椒5)的麻感最大、强度最高,且最大麻感强度出现的时间最晚,麻感总体持续时间最长。
3 结论
5种鲜花椒的颗粒大小和籽皮比均没有显著差异,丰椒1号中的矿物质含量最高,丰椒1号和丰椒5号中的有机物质含量最高,丰椒5号中的不挥发性有机物质含量最高。5种鲜花椒样品的香气优劣顺序为丰椒1号>丰椒3号、丰椒5号(但香气特性有一定差异)>丰椒2号(但其香气特性与丰椒3号最近)>丰椒4号(且其香气特性与其他5种明显不一样)。5种鲜花椒样品的麻味优劣顺序为丰椒5号>丰椒1号和丰椒3号>丰椒2号和丰椒4号,丰椒5号中主要麻味物质的含量均高于其他花椒样品。
从香气和麻味这两个指标综合分析,丰都县5种鲜花椒样品中,综合品质较好的为丰椒1号和丰椒5号,其中丰椒1号的香气品质最好,丰椒5号的麻味品质最好。
参考文献:
[1] 阚建全,陈科伟,任廷远,等.花椒麻味物质的生理作用研究进展[J].食品科学技术学报,2018,36(1):11-17.
[2] 王星斗,王文君,任媛媛,等.花椒育种研究进展[J].世界林业研究,2022,35(5):31-36.
[3] 王刚,祝诗平,阚建全,等.花椒挥发油含量的近红外光谱无损检测[J].农业机械学报,2008,39(3):79-81.
[4] 马尧.不同种质资源花椒主要品质性状差异及其影响因素研究[D].杨凌:西北农林科技大学,2021.
[5] 祝诗平,王刚,杨飞,等.基于近红外光谱的花椒麻味物质快速检测方法[J].红外与毫米波学报,2008,27(2):129-132.
[6] YANG X. Aroma constituents and alkylamides of red and green huajiao (Zanthoxylum bungeanum and Zanthoxylum schinifolium)[J]. Journal of Agricultural and Food Chemistry, 2008, 56(5): 1689-1696.
[7] LUO J, KE J, HOU X, et al. Composition, structure and flavor mechanism of numbing substances in Chinese prickly ash in the genus Zanthoxylum: A review[J]. Food Chemistry, 2022, 373: 131454.
[8] MA Y, TIAN L, WANG X, et al. Alkylamide profiling of pericarps coupled with chemometric analysis to distinguish prickly ash pericarps[J]. Foods, 2021, 10(4): 866.
[9] FENG X, HUANG P, DUAN P, et al. Dynamic Zanthoxylum pungency characteristics and their correlation with sanshool composition and chemical structure[J]. Food Chemistry, 2023, 407: 135138.
[10] FENG S, LIU Z, CHEN L, et al. Phylogenetic relationships among cultivated Zanthoxylum species in China based on cpDNA markers[J]. Tree Genetics & Genomes, 2016, 12: 1-9.
[11] FENG S, ZHAO L, LIU Z, et al. De novo transcriptome assembly of Zanthoxylum bungeanum using Illumina sequencing for evolutionary analysis and simple sequence repeat marker development[J]. Scientific Reports, 2017, 7(1): 16754.
[12] PREMARATHNE M D G P, FUKUTOME N, YAMASAKI K, et al. Elucidation of Japanese pepper (Zanthoxylum piperitum De Candolle) domestication using RAD-Seq[J]. Scientific Reports, 2021, 11(1): 6464.
[13] LIU J, WAN J, ZHANG Y, et al. The establishment of comprehensive quality evaluation model for flavor characteristics of green Sichuan pepper (Zanthoxylum armatum DC.) in Southwest China[J]. Food Chemistry, 2023, 18: 100721.
[14] XU S, YU L, HOU Y, et al. Chemical composition, chemotypic characterization, and histochemical localization of volatile components in different cultivars of Zanthoxylum bungeanum Maxim. Leaves[J]. Journal of Food Science, 2023, 88(4): 1336-1348.
[15] FENG S, LIU Z, HU Y, et al. Genomic analysis reveals the genetic diversity, population structure, evolutionary history and relationships of Chinese pepper[J]. Horticulture Research, 2020, 7: 158.
[16] FENG S, LIU Z, CHENG J, et al. Zanthoxylum-specific whole genome duplication and recent activity of transposable elements in the highly repetitive paleotetraploid Z. bungeanum genome[J]. Horticulture Research, 2021, 8(1): 205.
[17] WANG M, TONG S, MA T, et al. Chromosome-level genome assembly of Sichuan pepper provides insights into apomixis, drought tolerance, and alkaloid biosynthesis[J]. Molecular Ecology Resources, 2021, 21(7): 2533-2545.
[18] HU L, XU Z, FAN R, et al. The complex genome and adaptive evolution of polyploid Chinese pepper (Zanthoxylum armatum and Zanthoxylum bungeanum)[J]. Plant Biotechnology Journal, 2023, 21(1): 78-96.
(責任编辑:丁志祥)
