桑叶多酚的提取方法优化及应用研究
2023-11-03占鹏飞霍进喜吴伟杰陈慧芝潘美良马焕艳李有贵孙雨晴
占鹏飞,赵 辉,霍进喜,吴伟杰,钟 石,陈慧芝,潘美良,牛 犇,马焕艳,李有贵,孙雨晴*
(1. 湖州市农业科技发展中心,浙江 湖州 313000;2. 中国计量大学生命科学学院,浙江 杭州 310018;3. 浙江省农业科学院,浙江 杭州 310021;4. 浙江省农业技术推广中心,浙江 杭州 310020)
桑树是我国的特色经济作物,桑叶除了可以用来养蚕外,还是一种传统中药材。桑叶含有多酚、生物碱、多糖、黄酮等多种药效成分[1],具有抗氧化[2]、降血糖[3-4]、抗衰老和降血脂[5]等多种功效。多酚是桑叶功效物质之一,可以清除多种自由基,发挥抗氧化[2]、抗衰老[5]、降血糖[6]等作用,因此多酚含量是桑叶品质的重要指标之一。桑叶多酚常用的提取方法有蒸煮法、微波提取法、超声波提取法等,但已经报道的各研究方法的优化条件存在很多差异,且各有侧重的考察因素,尤其是微波、超声波等的提取方法中因为仪器型号、功率等的不同造成提取率和测定含量差异较大。本研究采用简单易行、对设备要求最低的蒸煮提取法,并利用单因素试验研究粉碎粒度、提取溶剂、提取温度、提取时间对福林酚法测定桑叶多酚含量的影响,明确最优提取条件,考察该提取测定方法的精确度、重复性、回收率、中间精确度等参数,为在常规实验条件下测定桑叶多酚提供方法参考和依据。最后,用获得的最优提取测定方法测定20 个桑品种在不同时间点的桑叶多酚含量,并将桑叶多酚含量与降糖活性成分1-脱氧野尻霉素(Deoxynojirimycin,DNJ)进行关联分析,阐述桑叶多酚在不同品种、不同季节下的变化规律以及与DNJ的关系。
1 材料与方法
1.1 材料
含量测定方法优化研究所用桑叶品种为‘强桑1号’,2021年8月采摘自浙江省农业科学研究院桑园试验区。多酚含量测定的不同桑品种见表1,分别于2022年4月25日、2022年5月9日、2022年8月10 日采摘自浙江省农科院桑园试验区。桑叶于60 ℃以下温度烘干后使用。

表1 桑品种表Table 1 Mulberry varieties
1.2 主要试剂
没食子酸购于上海麦克林生化科技有限公司,DNJ、氯甲酸-9-芴基甲酯购于德国Sigma公司,福林酚试剂购于北京华科盛精细化工产品贸易有限公司;碳酸钠、乙腈、硼酸钾、甘氨酸、乙酸、乙醇、甲醇等均为分析纯。
1.3 多酚含量的测定
标准曲线制作:精确称取没食子酸对照品25 mg于50 mL容量瓶中,加水溶解并稀释至刻度线处,精确量取5 mL置于50 mL量瓶中,用水稀释至刻度线处,摇匀,即得没食子酸标准品溶液(0.05 mg/mL 没食子酸溶液)。精确量取对标准品溶液0.1、0.2、0.4、0.6、0.8、1.0 mL,分别置于10 mL 离心管中,各加入福林酚试剂0.2 mL,再分别加水2.3、2.2、2.0、1.8、1.6、1.4 mL,加入2.4 mL 29%碳酸钠溶液,摇匀,放置30 min,以相应的试剂为空白,在760 nm 波长处测定吸光度值,以吸光度值为纵坐标,质量浓度为横坐标,绘制标准曲线。
样品测定:精确量取样品溶液0.4 mL 于10 mL离心管中,分别加入福林酚试剂0.2 mL、水2 mL、29%碳酸钠溶液2.4 mL,摇匀,放置30 min,室温下3 500×g离心5 min,取上清液,以相应的试剂为空白,测定760 nm 处吸光度值;从标准曲线中读出供试品溶液中多酚浓度,根据样品稀释倍数换算成干燥桑叶粉中多酚的含量,多酚含量以没食子酸(Gallic acid,GAE)当量计算。
式中桑叶粉以干质量计,测定液多酚浓度单位为mg/mL,提取液体积单位为mL,桑叶粉质量为g。
1.4 桑叶多酚含量在不同提取条件下的单因素考察
1.4.1 粉碎粒度考察
桑叶粉碎后,精确称取过30 目筛或80 目筛的粉末1 g,置锥形瓶中,加70%乙醇50 mL,称定质量,60 ℃水浴加热1 h,放冷,再称定质量,用提取溶剂补足减失的质量,摇匀,滤过,精确量取续滤液2 mL,置10 mL 量瓶中,用70%乙醇稀释至刻度,摇匀,即得待测样品。各平行3份操作,测定多酚含量。
1.4.2 提取溶剂考察
精确称取过80目筛的桑叶粉1 g,置锥形瓶中,加入不同溶剂(水、50%乙醇、70%乙醇、95%乙醇)50 mL,后续步骤按照1.4.1 粉碎粒度考察中所述方法提取桑叶多酚并测定多酚含量,各平行3份操作。
1.4.3 料液比考察
精确称取过80目筛的桑叶粉1 g,置锥形瓶中,加入不同体积(50、60、70 mL)70%乙醇,后续步骤按照1.4.1 粉碎粒度考察中所述方法提取桑叶多酚并测定多酚含量,各平行3份操作。
1.4.4 提取温度考察
精确称取过80目筛的桑叶粉1 g,置锥形瓶中,加入50 mL 的70%乙醇,称定质量,不同温度(60、70、80 ℃)水浴加热1 h,后续步骤按照1.4.1粉碎粒度考察中所述方法提取桑叶多酚并测定多酚含量,各平行3份操作。
1.4.5 提取时间考察
精确称取过80目筛的桑叶粉1 g,置锥形瓶中,加入50 mL 的70%乙醇,称定质量,在80 ℃水浴中加热回流为不同时间(1 h、2 h、3 h),后续步骤按照1.4.1 粉碎粒度考察中所述方法提取桑叶多酚并测定多酚含量,各平行3份操作。
1.4.6 精确度考察
精确称取过80目筛的桑叶粉1 g,置锥形瓶中,加入50 mL 的70%乙醇,称定质量,80 ℃加热回流1 h,放冷,再称定质量,用70%乙醇补足减失的质量,摇匀,滤过,精确量取续滤液2 mL,置10 mL 量瓶中,用70%乙醇稀释至刻度,摇匀,即得待测样品。精确量取同一待测样品溶液0.4 mL 6份于6支10 mL离心管中,分别测定多酚含量。
1.4.7 重复性考察
精确称取6份过80目筛的桑叶粉1 g,置锥形瓶中,分别加入50 mL 的70%乙醇,称定质量,80 ℃加热回流1 h,放冷,再称定质量,用70%乙醇补足减失的质量,摇匀,滤过,精确量取续滤液2 mL,置10 mL量瓶中,用70%乙醇稀释至刻度,摇匀,即得待测样品,分别测定6份样品中多酚含量。
1.4.8 回收率考察
精确称取过80 目筛的桑叶粉0.5 g,置锥形瓶中,加入一定量的没食子酸(相当于0.5 g 样品含量的80%、100%、120%,各平行操作3份),加入70%乙醇50 mL,称定质量,80 ℃加热回流1 h,放冷,再称定质量,用70%乙醇补足减失的质量,摇匀,滤过,精确量取续滤液2 mL,置10 mL 量瓶中,用70%乙醇稀释至刻度,摇匀,分别测定多酚含量。
1.4.9 中间精确度试验
由不同实验人员于不同时间取本品粉末约1 g,按重复性考察试验,平行操作6份,于不同仪器上测定。
1.5 桑叶DNJ的测定
桑叶粉碎过80 目筛,0.2 g 样品加200 mL pH 2.0的0.1%乙酸缓冲液超声提取20 min,10 000 r/min离心10 min,保留上清液;精确吸取样品溶液10 µL,置1.5 mL离心管中,与10 µL 0.2 mol/L(pH=7)硼酸钾缓冲液在1.5 mL试管中混合,加入20 µL 5 mmol/LFMOC-CL(溶解于乙腈中),迅速混匀并在室温条件下反应10 min。加10 µL 0.1 mol/L甘氨酸液终止反应,待上样。DNJ 标准品(Sigma)为对照品,用0.1%乙酸缓冲液溶解后,稀释成不同浓度,相同HPLC 条件下测定峰面积,制作标准曲线,桑叶中DNJ含量根据标准曲线计算。每个样品3个重复。
HPLC 分析条件为:分离柱SunFireTM C18(4.6 mm×250 mm,5 µm),流动相0.05%乙酸与乙腈的体积比为65∶35,柱温为室温,流速1 mL/min,进样量10 µL,采用2414检测器采集荧光信号,测定峰面积。
1.6 统计方法
采用SPSS 16软件统计,两组之间比较采用Student's test,P<0.05为差异有统计学意义。结果以平均值±标准差表示。相关性分析采用皮尔逊法计算。
2 结果与分析
2.1 标准曲线的制作
以吸光度值为纵坐标,没食子酸含量为横坐标,绘制标准曲线,回归方程为y=16.591x+0.071 1,R2=0.999 4,表明没食子酸在25~250 µg范围内线性关系良好(图1)。
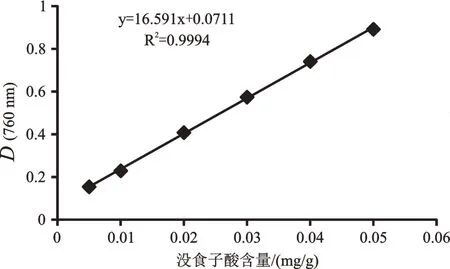
图1 标准曲线Fig. 1 Standard curve
2.2 粉碎粒度考察
结果(图2)表明,通过30 目筛粉末提取所测得的多酚质量分数为(10.31±0.52)mg/g,通过80 目筛的粉末所测得的多酚质量分数为(12.92±0.32)mg/g,因此选择多酚含量更高的80 目筛为粉碎粒度。本研究没有进一步提高粉碎粒度是因为过粒度过细会导致后续过滤困难。

图2 粉碎粒度对桑叶多酚含量的影响Fig. 2 Effect of pulverized particle size on polyphenol content in mulberry leaves
2.3 提取溶剂考察
结果(图3)表明,水、50%乙醇、70%乙醇、95%乙醇提取所测得的多酚质量分数分别为(10.24±0.41)、(11.82±1.82)、(12.80±0.822)、(6.53±0.53)mg/g,以70%乙醇为溶剂的提取效率最高,所以选取70%乙醇作为最优提取溶剂。

图3 提取溶剂对桑叶多酚含量的影响Fig. 3 Effect of extraction solvent on polyphenol content in mulberry leaves
2.4 液料比考察
结果(图4)表明,提取1 g桑叶样品加入提取溶剂40、50、60、70 mL 所测得多酚的质量分数分别为(11.49±0.35)、(12.48±0.31)、(12.42±0.50)、(12.53±0.44)mg/g,提取溶剂用量达到50 mL 时提取效率不再提高,因此选用更加节省溶剂的50 mL作为提取溶剂的体积,即料液比为1∶50。

图4 料液比对桑叶多酚含量的影响Fig. 4 Effect of solid-liquid ratio on polyphenol content in mulberry leaves
2.5 提取温度考察
60 ℃、70 ℃、80 ℃提取测得的多酚质量分数分别为(12.42±0.33)、(12.50±0.410)、(13.01±0.60)mg/g(图5),80 ℃回流处理的多酚含量高于60 ℃、70 ℃,即随着温度的提高多酚提取率呈上升趋势,但是由于提取溶剂为70%的乙醇,其沸点约为83 ℃,因此提取温度不宜继续提高,所以选取80 ℃回流处理作为提取温度。

图5 提取温度对桑叶多酚含量的影响Fig. 5 Effect of temperature on polyphenol content of mulberry leaves
2.6 提取时间考察
结果(图6)表明,提取时间1、2、3h 所测得多酚的质量分数分别为(12.77±0.32)、(12.74±0.40)、(12.81±0.41)mg/g,3 个时间点之间多酚含量的变化不大,因此选择时间最短的1 h作为提取时间。

图6 提取时间对桑叶多酚含量的影响Fig. 6 Effect of extraction time on polyphenol content in mulberry leaves
2.7 精确度考察
通过上述单因素试验,确定最优提取条件为粉碎粒度80目、提取溶剂70%乙醇、料液比为1 g样品对应50 mL 溶剂(即1∶50)、提取温度80 ℃、提取时间1 h,按照此提取方法提取桑叶多酚,取同一份桑叶粉提取液6 份测定多酚含量,如表2 所示,6 个平行测定的相对标准偏差RSD 为1.26%,结果表明本方法精确度良好。

表2 桑叶多酚测定方法的精密度考察结果Table 2 Precision of the method for determining polyphenols in mulberry leaves
2.8 重复性考察
为了考察提取方法的考察重复性,在粉碎粒度80 目、提取溶剂70%乙醇、料液比1∶50、提取温度80 ℃、提取时间1 h条件下提取6份桑叶粉并测定多酚含量。如表3所示,测得6份样品的多酚含量RSD为2.38%,结果表明本提取测定方法的重复性良好。

表3 桑叶多酚测定方法的重复性考察结果Table 3 Repeatability of the determination method of mulberry leaf polyphenols
2.9 回收率考察
为了考察提取方法的回收率,粉碎粒度80目的6 份桑叶粉加入不同量没食子酸标品,并在提取溶剂70%乙醇、料液比1∶50、提取温度80 ℃、提取时间1 h条件下分别考察加样回收率。如表4所示,本方法的加样回收率在96.30%~102.51%之间,RSD 为2.15,该结果表明本方法的准确度良好。

表4 加样回收率结果Table 4 The recovery rate of addition sample
2.10 中间精确度试验
为了考察不同操作环境下的中间精确度情况,试验采用不同实验员、不同仪器测定同样样品,结果(表5)表明2个实验人员的12份样品含量RSD为2.28%,表明本方法中间精确度良好。

表5 中间精密度试验结果Table 5 Intermediate precision test results
2.11 不同品种、不同采收时间的桑叶中多酚含量
不同品种和采收时间桑叶多酚含量测定结果见表6。由于‘荷叶白’‘农桑14’‘强桑1号’为浙江省的主栽品种,因此本研究将相同采样时间的不同品种的桑叶多酚含量分别与这3 个品种进行了比较。其中‘浦六2 号’的多酚质量分数5 月上旬达到(27.18±1.07)mg/g,显著高于同期‘荷叶白’‘农桑14’‘强桑1 号’含量(P<0.05),分别高出40.76%、31.88%、75.35%;其在所测20 种品种的3 个采样时间中为最高值,且其4月下旬质量分数也高达26.06 mg/g,4 月、5 月、8 月3 个采样时间点的平均值也高达(21.57±8.76)mg/g。‘92-53’桑品种的多酚含量也很高,其在3 个采收时间点的多酚平均质量分数最高(21.97±4.30)mg/g,且8月上旬的多酚含量在同期采收桑品种中含量也最高。从采样时间的平均多酚含量看,4 月、5 月、8 月3 个采样时间点桑叶中多酚含量整体呈下降趋势。
2.12 多酚含量与DNJ含量的相关性
我们在测定这20种桑品种多酚含量的同时,也测定了DNJ 的含量,同样也将不同品种的含量与浙江省主栽品种‘荷叶白’‘农桑14’‘强桑1号’在相同采样时间下进行了比较。如表7 所示,不同品种桑叶的DNJ含量也存在很大差异。‘马交1号’8月份的DNJ 含量质量分数(6.22±0.09)mg/g,在所测20 个品种的3 个采样时间中也为最高值,与同期‘荷叶白’含量没有显著差异(P>0.05),但是显著高于同期‘农桑14’和‘强桑1号’DNJ含量(P<0.05),分别比二者含量提高67.65%和58.27%,其4月、5月、8月3个采样时间点的平均值也为20 个品种中最高。DNJ 含量最低的为‘恒10’,其在5 月的质量分数甚至低至(0.02±0.00)mg/g,3 个采样时间点的DNJ 质量分数均值也仅为(1.23±1.59)mg/g。从采样时间的平均DNJ 含量看,8 月的桑叶DNJ 含量显著高于4 月和5月,而4 月和5 月二者之间变化不大。通过与多酚含量的关联分析发现,DNJ 含量与多酚含量之间存在显著的负相关(图7)。
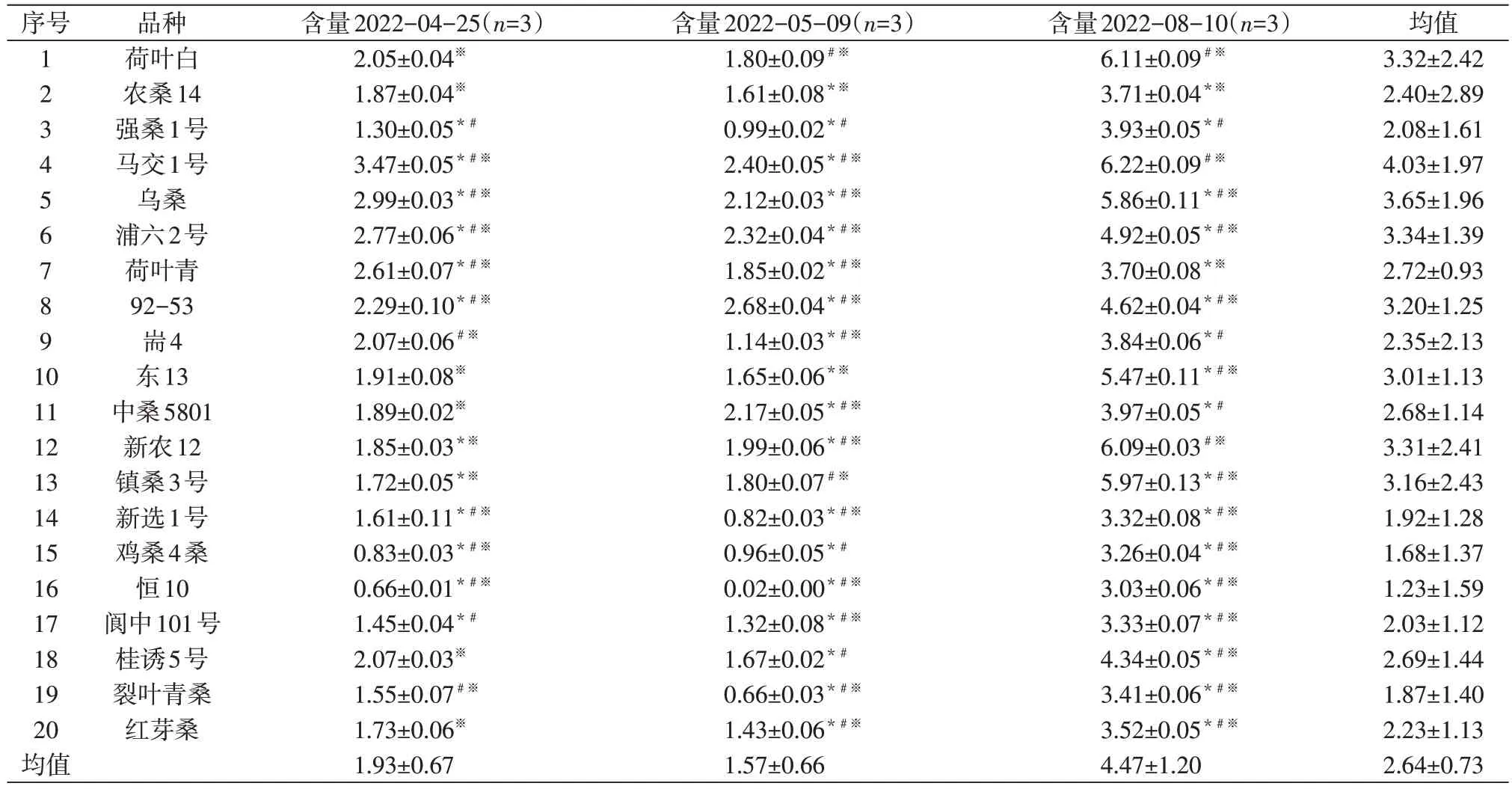
表7 不同品种主不同采样时间桑叶DNJ含量Table 7 DNJ content in mulberry leaves of different varieties at different sampling times mg/g

图7 桑叶多酚含量与DNJ含量的相关性Fig. 7 Correlation between polyphenol content and dnj content in mulberry leaves
3 讨论
桑叶多酚提取测定方法研究已有多篇报道,但是所用方法和侧重的考察条件各有不同。刘咏等[7]通过正交试验对水煮浸提法中的温度、料液比、浸提时间及酸碱度等因素进行优化,综合确定多酚、黄酮、多糖的同时提取的最佳条件为80 ℃、料液比1∶100、pH=10、浸提60 min。陈向阳等[8]以蛋白桑叶为材料,用单因素试验研究了十二烷基硫酸钠(Sodium lauryl sulfate,SDS)用量、超声功率、超声温度、乙醇体积分数等因素对多酚含量的影响,获得最佳条件为超声时间15 min,料液比1∶25,SDS 用量0.34%,超声功率250 W,超声温度60 ℃,乙醇体积分数50%,该条件下测定多酚含量达1.51%。祁伟亮等[9]采用超声波辅助提取法,通过正交试验获得最佳多酚提取条件为30%乙醇、提取时间70 min、超声波温度70 ℃、固液比1∶35。周昊等[10]利用超声波和微波协同法提取桑叶总多酚,其最佳提取工艺为料液比1∶20,提取时间93 s,微波功率326 W,超声波功率304 W。本研究采用简单易行、对试验设备要求最低的蒸煮法提取桑叶多酚,依次考察了桑叶的粉碎粒度、提取溶剂、料液比、提取温度、提取时间等提取条件对多酚含量的影响,最后确定了粉碎粒度为过80目筛、料液比1∶50、70%乙醇80 ℃水浴加热回流1 h的桑叶多酚提取条件。本方法没有加入酸、碱、表面活性剂等物质,也避免了微波超声波等仪器型号和功率差异造成的提取效率差异,可以供绝大部分实验室参考和使用,测定结果便于不同的研究之间的数据相互参考比较。
利用本方法测定了本单位试验基地20 种桑品种在不同采收时间的多酚含量,发现不同品种桑叶间的多酚含量存在很大差异。这与其他研究中报道的不同品种[11]、不同产地[12]、不同采收时间[13]桑叶多酚含量变化大的结论相一致。本研究还发现所测品种的桑叶多酚在4 月下旬、5 月上旬、8 月上旬3个采样时间点的含量在各品种中整体呈下降趋势,8 月的含量最低。沈维治等[13]报道了广东省农业科学院桑园基地的‘育2’‘紫白4’‘大10’‘湘7920’‘抗青10号’‘粤桑11号’6个品种的随季节变化的规律,发现桑叶多酚于5 月过后逐渐下降,至7月、8 月份最低,然后又缓慢上升直至10 月的现象。本研究中所测桑品种变化规律与之相一致,推测这种现象很可能与气温和光照等变化相关。另外,本研究还发现桑叶多酚含量最低的8 月,降血糖活性成分DNJ 含量却最高,多酚含量与DNJ 呈负相关。这与崔梦迪等[14]在陕西4个主栽桑品种中以及黄金枝等[15]在30 个江西栽培桑品种中发现的现象相一致,但该现象的原因尚需要进一步研究。
综上所述,本研究优化了桑叶多酚的提取测定方法,确定了粉碎粒度为过80 目筛、料液比1∶50、70%乙醇80 ℃水浴加热回流1 h的桑叶多酚提取条件,证明该方法具有较高的可重复性和准确性。利用该方法测定了浙江省农科院桑园基地中保留的20个桑品种资源在不同采样时间的多酚含量,发现了不同桑品种在4月下旬、5月上旬和8月上旬的采样时间下多酚含量逐渐降低的变化规律。同时,测定了这些品种在各采样时间点的DNJ 含量,并与多酚含量进行了关联分析,明确了桑叶多酚与DNJ 呈负相关的关系。
