特发性肺纤维化合并肺癌的放射治疗
2023-11-03王昊李龙浩李英
王昊 李龙浩 李英
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种病因不明的间质性肺疾病,以肺组织慢性进行性纤维化为特征,IPF急性加重(acute exacerbation of idiopathic pulmonary fibrosis,AE-IPF)时患者可因呼吸功能急剧恶化而死亡[1]。放射性肺损伤(radiation induced lung injury,RILI)是胸部放射治疗中最常见的并发症,分为两个阶段:早期(<6个月)放射性肺炎(radiation pneumonitis,RP)和晚期(>6个月)放射性肺纤维化[2]。IPF合并肺癌目前在临床上受到高度关注,此类患者治疗棘手,因手术、化疗、免疫治疗、靶向治疗、放射治疗等均可能导致患者呼吸功能急剧恶化甚至死亡,故治疗选择往往有限。胸部放疗在肺癌的治疗中有着重要的地位,可有效地控制肺部肿瘤病灶,但同时也会对周围肺组织产生损伤使患者出现呼吸困难甚至呼吸衰竭等症状。患者呼吸功能的恶化可能是由RILI直接引起的,也可能是由放射线损伤肺部后诱发了AE-IPF引起的,还可能是其他原因,如感染等。尽管欧洲癌症研究和治疗组织建议合并IPF的肺癌患者避免行胸部放射治疗[3-4],但IPF目前并未被普遍认为是胸部放射治疗的绝对禁忌证。在一项国际调查问卷中有54%的医生认为这部分患者应该接受胸部放射治疗[5]。本文就特发性肺纤维化合并肺癌的放射治疗相关的研究进展综述如下。
一、危险因素
1 与患者或疾病相关的危险因素
IPF确切的发病机制目前仍不清楚,但一些危险因素已被确定。高龄和男性与较高的发病率相关,其他重要的危险因素还包括吸烟、污染环境暴露、遗传因素以及合并其他疾病[1,6-10]。IPF急性加重的病因目前也不清楚,有研究表明感染、反流误吸、污染环境暴露以及较高的吸烟指数与急性加重的发生相关[8-9,11-13]。
高龄、肺功能差、体力状况差、肺中、下叶肿瘤以及吸烟史,包括既往吸烟和正在吸烟,均可使RP的风险增加;合并其他疾病,包括慢性阻塞性肺疾病、间质性肺疾病、自身免疫性疾病也可增加RP的风险[2,14]。
2 与药物治疗相关的危险因素
许多抗癌药物在使用时会增加RILI的发生率,包括化疗药物如博莱霉素、环磷酰胺、长春新碱、紫杉烷、阿霉素、放线菌素、丝裂霉素、吉西他滨等;靶向药物如厄洛替尼、贝伐珠单抗等[2]。
一些抗癌药物可导致药物相关性间质性肺疾病,从而诱发IPF的急性加重。据报道,化疗药物引起IPF急性加重的发生率高达8.7%~11.5%[11]。免疫检查点抑制剂的应用亦可导致肺损伤,进而引发药物相关性间质性肺炎[15]。可致肺纤维化进展的化疗药物有甲氨蝶呤、丝裂霉素、博莱霉素、 环磷酰胺等;靶向药物有吉非替尼、厄洛替尼等[16-17]。
因此,为降低合并IPF的肺癌患者在接受胸部放疗后呼吸功能急剧恶化的风险,临床医生应将AE-IPF与RP的危险因素综合起来考虑,有必要告诫患者采取戒烟、戒酒、加强体育锻炼、远离污染环境等生活干预措施;对高龄患者还需考虑接种流感疫苗、肺炎疫苗等以预防感染;对有胃肠道症状的患者还需考虑使用PPI、止吐药以减少反流误吸;此外,在选择抗肿瘤药物时也应更加谨慎,尽量避免使用有肺部毒性的药物。
二、预测因子
1 预测AE-IPF的生物标志物和生理学参数
KL-6与多种间质性肺疾病高度相关,包括过敏性肺炎、放射性肺炎、药物相关性间质性肺炎、胶原血管病相关性间质性肺炎以及特发性间质性肺炎等[18]。一项回顾性真实世界研究显示血浆KL-6≥2.5 ng/mL的患者有着更高的急性加重风险(调整后风险比4.52),而血浆KL-6≥3.5 ng/mL则是急性加重的显著预测因子(调整后风险比5.39)[19]。荟萃分析表明对于IPF急性加重,KL-6的总比值比为2.72,总敏感度为72%,总特异度为60%[20]。
肺功能指标与IPF急性加重的发生相关,用力肺活量降低或一氧化碳弥散量降低是急性加重最重要的危险因素。其他指标如6分钟步行距离降低、动脉血氧分压降低、肺泡动脉氧分压差降低、肺动脉高压等也预示着急性加重的风险增加[16,21-23]。
2 预测RP的生物标志物和剂量学参数
白细胞介素(IL)、转化生长因子-β(TGF-β)、KL-6和表面活性蛋白-D(SP-D)是目前研究最多的用于预测RP的生物标志物。郭雷鸣等[24]的前瞻性研究表明血清IL-17A水平升高与RP发病率升高有着显著的相关性。Wang等[25]的前瞻性研究显示放疗前较低的IL-8水平与≥2级RILI的风险增加相关;放疗开始后2周TGF-β1水平与放疗前TGF-β1水平的比值升高也与≥2级RILI的风险增加相关;两者结合平均肺剂量的预测模型ROC曲线下面积(area under curve,AUC)为0.73。Zhang等[26]通过比较放疗前后血清Ape1/Ref-1水平和TGF-β1水平发现两者在RP组的升高较无RP组更为显著;两者结合的预测模型AUC为0.842。血清KL-6水平较高或SP-D水平较高也与≥2级RP的风险增加相关[27-29]。
最常用于预测RP的剂量学参数是平均肺剂量(mean lung dose,MLD)和接受某一剂量及以上的肺体积百分比(Vdose)。Liu等[30]的回顾性研究表明全肺V20、全肺MLD及同侧肺MLD均与≥2级RP的风险增加显著相关;后两者与临床因素(呼吸系统共病、既往胸部放疗、右肺肿瘤)结合后预测模型AUC分别为0.76(全肺MLD)和0.77(同侧肺MLD)。Pan等[31]的回顾性研究显示总剂量≥60Gy、V20≥20%及MLD≥12Gy均为≥3级RILI的独立预测因子;后两者结合中性粒细胞与淋巴细胞的比值后预测模型AUC为0.82 。计划靶区体积与全肺照射体积的比值也与≥2级RP的发生显著相关,该比值的预测效果良好,AUC为0.88(敏感度90.0%, 特异度72.4%)[32]。
因此,对合并IPF的肺癌患者,若拟行胸部放疗,除了放疗的剂量学参数应重点关注,患者的心肺功能测试以及上述血清学检查也应重点关注,这些指标的异常往往预示着患者在放疗后可能会出现呼吸困难。对于指标异常的患者,能否采取胸部放疗需慎重考虑;若拟行胸部放疗,时机也需把握,待上述检查结果回至正常或许是一个比较好的选择。
三、放射治疗
1 放射治疗后RP的发生率
多项研究表明合并间质性肺疾病是有症状和严重RP的重要危险因素,可显著提高有症状和严重RP的发生率。采用立体定向放射治疗(stereotactic body radiation therapy,SBRT)时,合并间质性肺疾病的肺癌患者相较于无间质性肺疾病的肺癌患者1年内≥2级、≥3级和≥4级RP的发生率均明显提高(分别为55.0% ∶13.3%,P<0.001;10.0% ∶1.5%,P=0.020;57% ∶2%,P<0.001)[27,33]。采用三维适形放射治疗或单分割碳离子放射治疗时也是如此[28,34]。合并或不合并间质性肺疾病的肺癌患者在不同放射治疗技术下RP的发生率(见表1)。
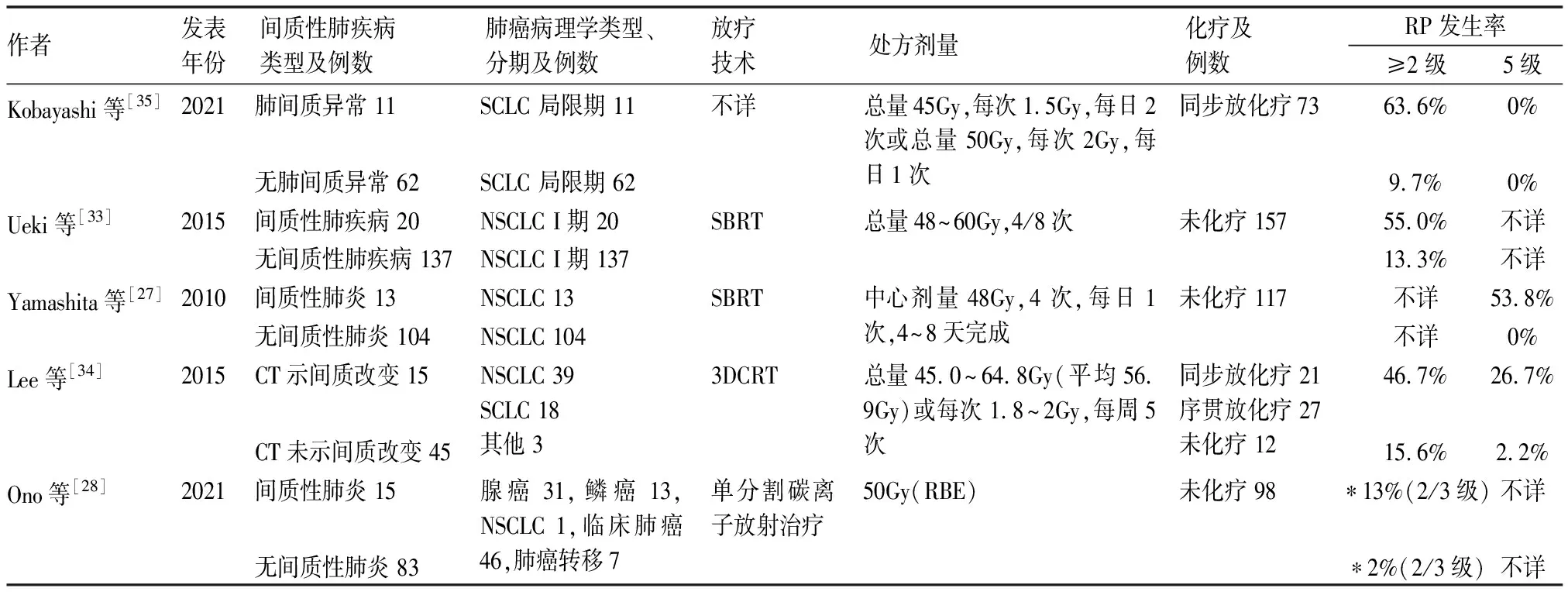
表1 合并或不合并间质性肺疾病的肺癌患者放射治疗后RP的发生率
2 放射治疗后的生存率
尽管合并间质性肺疾病会显著提高有症状和严重RP的发生率,但这并不意味着对于此类患者而言胸部放疗是一项绝对禁忌。有研究显示相较于单纯患有肺癌的患者,合并间质性肺疾病的肺癌患者在接受放疗或放化疗后生存率并没有显著降低[33,36-37];且在这部分患者中,接受放化疗的生存率和中位生存期均高于仅接受化疗的患者[35]。
Ueki等[33]回顾性分析了157名只接受SBRT的非小细胞肺癌患者,结果显示治疗前存在间质性肺疾病的患者与治疗前不存在间质性肺疾病的患者相比3年生存率无显著差异。Glick等[37]的研究也表明治疗前存在或不存在间质性肺疾病的肺癌的患者在接受SBRT后中位生存期无显著差异。Higo等[36]回顾性分析了77名接受放化疗的肺癌患者后发现合并肺间质异常并不显著影响2年生存率;对于合并肺间质异常的肺癌患者,若不存在低肺活量或HRCT上的蜂窝状改变,则放化疗是可行且有效的。
Kobayashi等[35]回顾性分析了149名接受一线治疗方案的局限期小细胞肺癌患者,结果显示合并肺间质异常的患者接受同步放化疗比单纯化疗有着更好的2年、5年生存率(分别为36% ∶8%;26% ∶0)和中位生存期(17.5月 ∶14.4月)。
质子治疗似乎可以减少合并IPF的肺癌患者致死性肺炎的发生率。Ono等[38]报道了16名接受质子束治疗肺肿瘤的IPF患者,其中6.3%(1/16)的人出现了5级肺炎。该比例相较于Yamashita和Lee等在立体定向放射治疗和三维适形放射治疗中报道的5级肺炎发生率(分别为53.8%和26.7%)要低的多[27,34]。Kim等[39]在一项回顾性研究中直接比较了质子治疗与X射线治疗对合并IPF的肺癌患者的差异,结果显示质子治疗对GAP指数为Ⅱ~Ⅲ期的患者有明显的优势,1年总生存率明显更高(50.0% ∶26.4%,P=0.036);对全体患者总致死性肺炎的发生率也倾向于更低[0(0/8) ∶18.2%(4/22),P=0.140]。
3 放射治疗的限制建议
Jin等[40]回顾性分析了134名接受容积调强放射治疗的肺癌患者后发现将V10、V13、V20和V30分别限制在49%、41%、26%和17%以下时可限制RP发生率<10%。而对于使用立体定向放射治疗的肺癌患者,Liu等[30]建议将所有病人的全肺MLD、同侧肺MLD和全肺V20分别限制在5.9Gy、19.7Gy和10%以下以使≥2级RP发生率<10%;若患者合并其他呼吸系统疾病则上述参数需各自进一步限制在4.2Gy、6.5Gy和6.8%以下。Ono等[28]的研究表明采用单分割碳离子放射治疗时,将V5、V10、V15、V20、V25、V30和MLD分别限制在11.0%、9.4%、7.8%、6.8%、 4.5%、3.5%和3.0 Gy (相对生物有效性)以下可避免症状性RP的发生。
在进行胸部照射时,除了要尽力避免RP的发生,AE-IPF的发生也应尽量避免。Kobayashi等[41]回顾了37名合并间质性肺疾病的肺癌患者在接受放化疗后急性加重的发生情况后发现V20<25%时间质性肺疾病急性加重的发生率有更低的倾向(23% ∶59%,P=0.078)。采用不同放射治疗技术时的限制建议(见表2)。

表2 采用不同放射治疗技术时的限制建议
4 抗肺纤维化治疗对放射治疗后肺部毒性的减轻作用
尼达尼布和吡非尼酮可延缓肺纤维化进展且有着良好的安全性和耐受性,已被ATS/ERS/JRS/ALAT指南推荐用于IPF的抗肺纤维化治疗[43]。它们对放射治疗后的肺部毒性似乎也有一定的减轻作用。张凌云等[44]报道了1位接受胸部放疗后发生RILI的肺癌患者在使用尼达尼布治疗4个月后临床症状、肺弥散功能及肺纤维化病灶均见好转。陈诚等[45]回顾性分析了170名接受调强放射治疗的食管癌患者后发现放疗期间同步使用吡非尼酮能降低2级和3级以上RP发生率(分别为14.73% ∶3.92%,P=0.007;10.99% ∶3.92%,P=0.014)。吴陈宾等[46]的研究也显示吡非尼酮能在不影响食管癌放疗疗效的前提下,减轻早期和晚期RILI的发生率。
尽管欧洲癌症研究和治疗组织建议合并IPF的肺癌患者避免行胸部放射治疗[3-4],但IPF目前并未被普遍认为是胸部放射治疗的绝对禁忌证。在一项国际调查问卷中有54%的医生认为这部分患者应该接受胸部放射治疗[5]。上述研究的结果也表明IPF并非是胸部放疗的绝对禁忌证,合并IPF的肺癌患者是可以在胸部放疗中获益的,但这需要临床医生能够准确地识别出患者中的低风险人群,并避免相关危险因素,同时制定合适的放疗方案,包括放疗技术的选择和放疗剂量的把控。抗纤维化药物尼达尼布和吡非尼酮已被证实能够延缓IPF的病情进展,对于放疗后的肺部毒性似乎也有一定的减轻作用,但是否在放疗期间推荐使用还需更多的随机对照试验研究证据。
四、总结与展望
在对IPF合并肺癌的患者实施胸部放射治疗前,需综合患者的一般情况、局部肿瘤情况、内科治疗方案、肺功能及血清学检查等进行全面的风险评估,并制定个体化的放疗方案。决策应充分考虑潜在的益处和风险,并由多学科团队合作商议进行。放疗技术的选择和剂量的实施都必须慎重考虑。质子治疗似乎是一个比较好的选择,但目前尚缺乏随机对照试验研究数据以推荐其标准使用,还需更多的证据以明确其是否能使患者受益。尼达尼布和吡非尼酮对放射治疗后的肺部毒性似乎有一定的减轻作用,证实还需更多的随机对照试验研究数据。
